جلد 17، شماره 3 - ( پاییز 1399 )
جلد 17 شماره 3 صفحات 209-200 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Mehrabi Habibabadi H, Sharifi Z, Parsania M, Pourfathollah A, Haghighat S. Comparison of Western blotting and PCR assays for confirmation of HTLV-1 virus in volunteer blood donors. Sci J Iran Blood Transfus Organ 2020; 17 (3) :200-209
URL: http://bloodjournal.ir/article-1-1315-fa.html
URL: http://bloodjournal.ir/article-1-1315-fa.html
مهرابی حبیب آبادی حسین، شریفی زهره، پارسانیا مسعود، پورفتح الله علی اکبر، حقیقت ستاره. مقایسه آزمایشهای الکتروکمی لومینسانس، وسترن بلات و PCR برای تائید ویروس HTLV-1 در داوطلبان اهدای خون. فصلنامه پژوهشی خون. 1399; 17 (3) :200-209
استاد مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون
متن کامل [PDF 465 kb]
(1637 دریافت)
| چکیده (HTML) (3133 مشاهده)
مقدمه
HTLV ویروسی با زنجیره RNA از خانواده رتروویریده و جنس دلتا رتروویروس میباشد که اولین بار توسط پوئز در سال 1980 در انسان شناخته شد(3-1). نوع 1 این ویروس (HTLV-I) در سال 1979 در مبتلایان به بیماری لنفوپرولیفراتیو سلول T و دو سال بعد نوع 2 ویروس (HTLV-II) در یک فرد مبتلا به لوکمی سلول مویی (Hairy Cell Leukemia) به عنوان اولین رتروویروسهای انسانی شناسایی شدند)4(. به علاوه موارد محدودی از آلودگی انسان به نوع 3 و 4 این ویروس در سالهای اخیر از آفریقای مرکزی گزارش شده است(5، 6). اغلب مبتلایان به عفونت (HTLV-I)در بیشتر عمر خود بدون علامت باقی میمانند و تنها در کمتر از 10%، عوارض ناشی از این ویروس را آشکار میکنند(7، 2، 1). راههای انتقال ویروس شامل: 1- دریافت خون و یا فرآوردههای خونی آلوده، 2- تماس جنسی، 3- مادر به کودک و 4- اعتیاد تزریقی میباشد و آلودگی HTLV-I گسترش جهانی دارد(10، 8). روشهایی که برای تشخیص ویروس HTLVبه کار برده میشود شامل روشهای سرولوژی و مولکولی میباشد. یکی از روشهای سرولوژیک، روش الکتروکمی لومینسانس است. الکتروکمی لومینسانس، تکنولوژی جدیدی است. وقتی یک الکترون از سطح تهییج شده یا بالاتر به سطح پایینتر انرژی میرسد و انرژی خود را به صورت نور متصاعد میکند، واکنش را به نام لومینسانس میشناسیم(14-11). شناسایی ویروس توسط این روش، ساندویچ دوتایی آنتیژن اطلاق میگردد، بدین صورت که آنتیژنهای نوترکیب خاصHTLV بیوتینه شده (HTLV-I gp21 و HTLV‑ II p24) و آنتیژنهای نوترکیب اختصاصی HTLV (HTLV-I gp21 و HTLV‑ II p24) که با کمپلکس روتنیوم نشانهگذاری شدهاند و همراه با نمونه تشکیل ساندویچ میدهند. بعد از آن با افزودن میکرو ذرات پوشیده شده با استرپتاویدین به فاز جامد متصل میشود. ترکیب واکنش به صورت مغناطیسی روی سطح الکترود در سلول اندازهگیری میشود و ترکیباتی که متصل نشوند، توسط ProCell II M برداشته میشوند. با استفاده از نور سنج نتایج به صورت خودکار با مقایسه سیگنالهای نمونههای مثبت که قبلاً توسط کالیبراسیون به دست آمده، تعیین میشود.
یکی دیگر از روشهای کلیدی آزمایش وسترن بلات میباشد. این روش یک آزمایش تأییدکننده است و وجود نوعی پادتن(ایمونوگلوبولین نوع جی) علیه چند نوع پروتئین ویروسی را بررسی میکند. افتراق بین HTLV I و HTLV II از طریق استفاده از rgp46-I ، یک واحد پروتئین نوترکیب پوششدار HTLV I و rgp46-II و یک واحد پروتئین نوترکیب پوششدار HTLV II انجام میشود. GD21 ، یک پروتئین نوترکیب پوششدار اپیتوپ اختصاصی مشترک HTLV I و HTLV II است که برای افزایش اختصاصیت تشخیص مورد استفاده قرار میگیرد. علاوه بر این، افتراق بین انواع ویروس HTLV تحت تأثیر استفاده پروتئین gag(p19, p24) قرار میگیرد. اگر p19 بزرگتر یا مساوی p24 باشد، عفونت HTLV-I و اگر p24 بزرگتر از p19 باشد، عفونت HTLV-II پیشنهاد میگردد.
واکنش زنجیرهای پلیمراز(PCR)، یک روش آزمایشگاهی مولکولی است که همانندسازی و تکثیر قطعهای از D ژنوم ویروسی در دو ناحیه LTR و Tax توسط روش Nested PCR انجام میشود.
بررسی و مقایسه نتایج واکنشزای آزمایش الایزا با آزمایشهای تأییدی جهت تشخیص HTLV-I واقعی در جمعیت اهداکنندگان خون به منظور افزایش ضریب سلامت خون در گیرندگان و جلوگیری از معافیتهای کاذب و حفظ اهدکنندگان و تأمین ذخایر خونی مهم میباشد. هدف از این مطالعه، مقایسه آزمایشهای الکتروکمی لومینسانس، وسترن بلات و PCR به منظور تایید ویروس HTLV-I بود.
مواد و روشها
این مطالعه تجربی در سال 1397 در آزمایشگاه ویروسشناسی مرکز تحقیقات مؤسسه عالی طب انتقال خون انجام شد. تعداد 66 نمونه(62 مرد و 4 زن) که با کیت الایزا (ایتالیا، Diapro HTLV I-II Ab Kit) دارای جذب نوری مثبت و یا جذب نوری سر مرز به کنترل مثبت بودند، جمعآوری شدند. جذب نوری تعداد 6 نمونه بر اساس معیار cut off دارای واکنش قوی بودند و تعداد 60 نمونه سر مرز مثبت گزارش شدند. برای همه این نمونهها، مجدد با همان کیت، آزمایش انجام شد. همچنین بر روی این نمونهها و با استفاده از آزمایش الکتروکمی لومینسانس(آلمان، Roche ECL Kit) و بر اساس دستورالعمل کیت آزمایش انجام شد. بر روی نمونههای مثبت، آزمایش وسترن بلات(سوئیس، MP Kit) بر اساس دستورالعمل کیت انجام شد. برای انجام PCR ، اهداکنندگان با نتایج واکنشزا با الایزا دوباره فراخوان شده
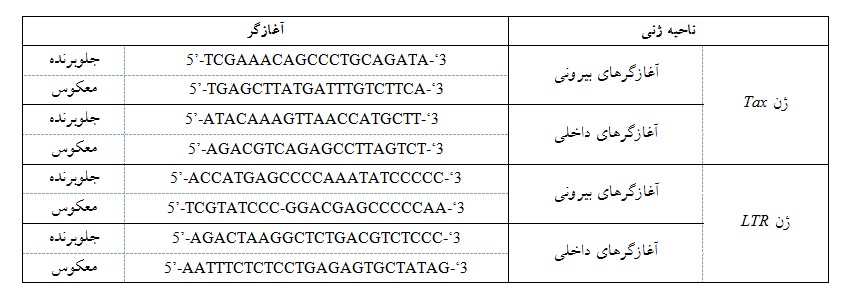
و نمونه خون کامل همراه با ماده ضد انعقاد از آنها اخذ گردید. ابتدا از نمونهها DNA ژنومی استخراج(تایوان، FavorGen) گردید و به وسیله نانودراپ، غلظتها سنجش شد. در ادامه با DNA ژنومی استخراج شده، برای نمونهها آزمایش Nested PCR (دستگاه آلمانی، PEQ STAR) با آغازگرهای هر دو ناحیه ژنی TAX و LTR انجام شد و حجم محتویات میکروتیوبها به همراه چرخههای دمایی در نظر گرفته شد(جداول 3-1).
جدول 1: توالی آغازگرهای دو ناحیه Tax و LTR
جدول 2: حجم مواد میکروتیوبهای Nested PCR

جدول 3: چرخههای دمایی Nested PCR

در نوبت اول با استفاده از آغازگرهای اختصاصی ناحیه بیرونی Tax با آغازگر جلوبرنده به طول 7276-7257 و آغازگر معکوس به طول 8467-8447 و ناحیه LTR با آغازگر جلوبرنده به طول 31-9 و معکوس به طول 779-757 تکثیر شدند و در نوبت دوم با استفاده از آغازگرهای اختصاصی داخلی ناحیه Tax با آغازگر جلوبرنده به طول 7293-7274 و معکوس به طول 8393-8374 و ناحیه LTR با آغازگر جلوبرنده به طول 119-97 و معکوس به طول 746-722 تکثیر شدند و در پایان محصول ران دوم، Nested PCR روی ژل آگاروز 5/1%، با ولتاژ 100 الکتروفورز گردید و باندها روی ژل داک بررسی شد. نهایتاً محصولات PCR با باندهای اختصاصی نواحی LTR (bp 682) و Tax (bp 1119) تفسیر شدند. به منظور صحت فرآیند استخراج و PCR ، ژن بتااکتین به عنوان ژن خانهداری(Gene House Keeping) استفاده شد. آزمایش PCR در دستگاه آلمانی، PRQ STAR انجام شد.
یافتهها
در مطالعه انجام شده، 66 نمونه از داوطلبان اهدای خون(شامل 62 مرد با میانگین سنی 56/37 سال و 4 زن با میانگین سنی 92/38 سال همچنین تعداد 53 نفر متأهل و 13 نفر مجرد، بررسی شدند که در الایزای مجدد تعداد 8 نمونه(1/12%) مثبت شدند. در آزمایشهای الکتروکمی لومینسانس و وسترن بلات ، تعداد 4 (6%) نمونه مثبت نتایج یکسان و مشابه داشتند(شکل 1).
کیت وسترن بلات MPمورد استفاده، برای اولین بار تائیدیه FDA را به عنوان تست تأییدی دریافت کرده است.
هم چنین 8 نمونه با دو تکرار واکنشزای الایزا برای نمونهگیری مجدد فراخوان شدند که همه افراد فراخوان شده غیر از یک نفر، همکاری کردند و نمونه جدید گرفته شد. پس از استخراج DNA ژنومی، غلظت و خلوص DNA با نانودراپ اندازهگیری شد که خلوص DNA ژنومی برابر 8/1 بود. هم چنین آزمایش PCR بر روی DNA استخراجی نمونهها با آغازگر بتااکتین انجام شد و در تمام موارد محصول PCR مورد تائید قرار گرفت. در ادامه کار با بررسی حضور ژنوم ویروس 1-HTLV ، نتایج آزمایش Nested PCR برای سه نمونه در هر دو ناحیهTAX (bp 1119) و LTR (bp 682) درکنار نشانگر وزن مولکولی 100 جفت بازی مثبت شد و باند مورد نظر مشاهده گردید(شکل2).

شکل شماره 1: نتایج وسترن بلات نمونه های مثبت الایزا

شکل 2: نتایج ژل الکتروفورز محصول Nested PCR ویروس HTLVI . چاهک 1 نشانگر وزن مولکولی 100 جفت بازی. چاهک 2 محصول PCR ژن TAX (bp 1119( و چاهک 3 محصول PCR ژن LTR (bp 682).
بحث
در این مطالعه در الایزای اولیه، موارد واکنشزا و سر مرزی HTLV-I ، تعداد 8 (1/12%) نمونه مثبت شد و از این 8 نمونه واکنشی الایزا، در بررسی با آزمایشهای الکتروکمی لومینسانس و وسترن بلات، تعداد 4 (6%) نمونه بـه صـورت یکسان در هر دو آزمایش تائید شد. هم چنین
همان نمونه ها با آزمایش PCR هم مورد تائید قرار گرفتند.
ویروس HTLV ، یک رتروویروس است که ژنوم آن RNA تک رشتهای میباشد. این ویروس با فعالیت نسخهبرداری معکوس، DNA میسازد که به داخل ژنوم میزبان وارد میشود و با فرار از پاسخهای سیستم ایمنی میزبان، میتواند سالهای طولانی در بدن باقی بماند(16). تنوع ژنتیکی ویروس در مناطق جغرافیایی مختلف متفاوت است ولی در یک منطقه معمولاً یکسان است. میزان موتاسیون در این ویروس نسبت به سایر ویروسها بسیار کم است و در حدود 1% در طی هزاران سال میباشد(17). حدود 15 تا 20 میلیون نفر در سراسر دنیا به این ویروس آلوده هستند که از این بین 8%-2% به سمت بیماریهای شدید مرتبط با HTLV-1 میروند و بقیه به صورت ناقلین بدون علامت باقی میمانند(17). در مطالعه ژیاهوی بی و همکاران در سال 2012، به منظور ارزیابی گذر آزمایشهای نسل سوم HIV (enzyme linked immunosorbent assay/EIA) به نسل چهارم (electrochemiluminescence immunoassay/ChIA)، تعداد 227761 نمونه با EIA و تعداد 115835 نمونه با ChIA بررسی شدند و موارد مثبت هر دو آزمایش با آزمایش تائیدی وسترن بلات تکرار شد و حساسیت بالینی ChIA 88/99% و EIA 64/99% اعلام شد(18). در مطالعه ریموند بوآدو در سال 2016، به منظور بررسی و مقایسه ویژگی و حساسیت نمونه خون کامل و نمونه سرم با استفاده از کیتهای تشخیصی HIV ، تست تشخیصی سریع(RDT : Rapid diagnostic Test)، بر روی 280 بیمار مبتلا به HIV و غیر آلوده توسط آزمایش الکتروکمی لومینسانس انجام شد و مشخص گردید که نمونههای خونی کامل از ویژگیها و حساسیتهای بالاتر و ارزش تشخیصی مثبت و منفی بالاتری نسبت به سرم برخوردار هستند(19). در مطالعه آنجا دی وقلیره و همکاران در سال 2017، به منظور غربالگری و شیوع HCV در بین بیماران HIV مثبت در شهر کامبوج، تعداد 3045 بیمار HIV مثبت بدون سابقه درمان با HCV با روش الکتروکمی لومینسانس مورد ارزیابی قرار دادند و تعداد 230 (55/7%) مورد تشخیص داده شد که غربالگری هدفمند HCV در بین بیماران HIV مثبت را ارائه دادند(20). الکتروکمی لومینسانس، مزایای خوبی نسبت به روشهای تشخیصی دیگر مانند الایزا دارا میباشد، از جمله این مزایا میتوان قابلیت اتوماسیون کامل دستگاه در حذف کامل خطای تکنیکی، دارای معرف غیر ایزوتوپی بسیار پایدار و با کاربرد آسان، حساسیت بالا جهت
اندازهگیری آنالیتها با مقادیر بسیار کم و همچنین در مدت زمان کوتاه، سنجش با کیفیت بالا، برگشت سریع و آماده شدن برای سنجش دیگر و همچنین با توجه به عملکرد دستگاه قدرت تکرارپذیری بسیار بالا و کاهش مصرف معرفها و در نتیجه کاهش هزینهها و کاهش زمان را میتوان از ویژگیهای این سیستم بیان کرد. علاوه بر مزایا دارای معایب و محدودیتهایی نیز است که این محدودیتها شامل: بسته بودن سیستم )در این روش بایستی حتماً از دستگاه و کیتها و محلولها و همچنین سر سمپلر و چاهکهای مخصوصی استفاده شود که کاملاً انحصاری و در اختیار یک شرکت مشخص است(، هزینه قابل توجه دستگاه و همچنین کیتها و محلولهای آن میباشد. عبدالوهاب مرادی و همکاران، فراوانی آنتیبادی ضد TLV-1 را در 181 بیمار تالاسمی ماژور شهرستان گرگان در سالهای 83 و 84 مورد مطالعه قرار داده و موارد مثبت واقعی را 4/4% (8 نفر) گزارش نمودهاند. روش کار مرادی برای غربالگری اولیه الایزا و تست تائیدی وسترن بلات بود. در غربالگری به وسیله الایزا از 181 بیمار تالاسمی، 27 نفر (9/14%) مثبت شده بودند اما در آزمایش تائیدی وسترن بلات تنها 8 نفر (4/4%) نتایج مثبت را نشان دادند(21). در مطالعه انارکی و همکاران سال 2003، به منظور تشخیص ویروس HTLV در 175 بیمار تالاسمی شهر تهران با آزمایش الایزا، تعداد 12(8/6%) نمونه مثبت گزارش شد و آزمایش تائیدی وسترن بلات، تعداد 11 (3/6%) نمونه را تائید کرد(22). در مطالعه شهابی و همکاران سال 2014، به منظور تشخیص ویروس HTLV ، تعداد 201719 نمونه از داوطلبان اهدای خون در خراسان رضوی در سالهای 87-85 مورد مطالعه قرار گرفتند. در این مطالعه نتایج آزمایش الایزا 850 (42/0%) نمونه مثبت بود و با آزمایش وسترن بلات تعداد 32 (016/0%) نمونه تائید شد(23). در مطالعه جمیلی و همکاران سال 2013، به منظور تشخیص ویروس HTLV ، تعداد 21228 نمونه اهداکنندگان خون در سالهای 87-86 در شهر سبزوار بررسی شدند. نتایج غربالگری با آزمایش الایزا در تعداد 116(55/0%) نمونه مثبت بود و در بررسی با آزمایش تائیدی وسترن بلات، تعداد 56 (26/0%) نمونه مثبت تائید شد(24). در مطالعه استرامر و همکاران سال 2018، جهت غربالگری ویروس HTLV از دو آزمایش الایزا و کمیلومینسانت استفاده کردند و نتایج مثبت هر آزمایش با آزمایش دیگر تکرار شد و 100 نمونه repeat-reactive با آزمایش تکمیلی وسترن بلات مورد سنجش قرار گرفتند که نتایج شامل 79 نمونه منفی و 21 نمونه نامشخص بودند(25). وسترن بلات در مقایسه با آزمایش الایزا٬ اختصاصیتر است ولی چون آزمایش نسبتاً گرانی محسوب میشود و از حساسیت کمتری برخوردار است به عنوان اولین آزمایش انجام نمیگیرد و بیشتر در تائید نتایج مثبت شده آزمایش الایزا به کار میرود. آزمایش وسترن بلات در همراهی با آزمایش الایزا بیش از 99% مورد اطمینان خواهد بود. از مزایای وسترن بلات میتوان به قابلیت تشخیص سطح پیکوگرم پروتئین در نمونه اشاره کرد(26). اجازه میدهد تا این روش برای بسیاری از اهداف به عنوان ابزار تشخیصی مؤثر استفاده شود(27-28). حساسیت و اختصاصی بودن وسترن بلات به دو دلیل اصلی آن است: 1) جداسازی پروتئینهایی که از نظر اندازه، بار و ترکیب با یکدیگر متفاوت هستند به وسیله ژل الکتروفورز انجام میشود. پروتئینهای دناتوره شده با اتصال به SDS (سدیم دودسیل سولفات) یک بار منفی داده میشوند، سپس بر اساس اندازه جدا میشوند. 2) اثر متقابل آنتیبادی و آنتیژن. مانند همه روشها، وسترن بلات هم محدودیتهای خود را نیز دارد(28، 27). محدودیت اصلی وسترن بلات این است که فقط در صورت وجود یک آنتیبادی اولیه علیه پروتئین مورد نظر میتوان آن را انجام داد(29). در مطالعه موناوردی و همکاران در سال 2011، به منظور تشخیص ویروس HTLV در 60 بیمار با بدخیمی خون بستری در بخش انکولوژی بیمارستان حضرت رسول، در غربالگری نمونهها با آزمایش الایزا، تعداد 18 (30%) نمونه مثبت گزارش شد و برای تائید آنها از آزمایش Real-time PCR ناحیه TAX استفاده شد که تعداد 12 (20%) نمونه مورد تائید قرار گرفت(30). در مطالعه ثقفی و همکاران در سال 2018، در میان 125 فرد مبتلا به بیماری تنفسی- خود ایمنی سارکوئیدوز در مقایسه با جمعیت سالم شهر مشهد، وجود HTLV1 با آزمایش الایزا در تعداد 5 نمونه مثبت تشخیص داده شد و همان نمونهها با آزمایش PCR تائید شد. و در نهایت فروانی HTLV1 در این بیماران در شمال شرقی ایران 4% گزارش شد(31). در مطالعه پیرایش فرد و همکاران در سال 2018، به منظور تشخیص ویروس HTLV تعداد 2000 نمونه اهداکنندگان شهر تهران، 100 نمونه بیمارHIV مقبت و 100 نمونه بیمار بتا تالاسمی و در مجموع 2200 نمونه غربالگری شد که با آزمایش الایزا تعداد 34 نمونه اهداکنندگان و 12 نمونه بیمار HIV مثبت شدند و با آزمایش تائیدی Nested PCR، تعداد 1 نمونه از اهداکنندگان، 5 نمونه از بیماران HIV مثبت و 8 نمونه از بیماران بتا تالاسمی تائید شد(15). روش Nested PCRجهت افزایش حساسیت PCR و همچنین به حداقل رساندن تکثیر غیر اختصاصی و محصولات کاذب PCR طراحی میشود که سبب اتصال آغازگر به جایگاههای پیشبینی شده DNA هدف شود. Nested PCR شامل 2 مجموعه از آغازگر است که آنها در دو نوبت کاری پی در پی در واکنش PCR استفاده میشوند. عملکرد مجموعه دوم آغازگر این است که به جایگاه هدف دوم در داخل توالی تکثیر شده با مجموعه اول آغازگر اتصال یابند. به طوری که بسیار بعید است که توالی کاذب یا ناخواسته، جایگاه اتصال برای هر دو مجموعه آغازگرها داشته باشد. به خاطر این که تکثیر با آغازگرهای اختصاصی، انجام میشود، روش بسیار اختصاصی است. به علت تولید میلیونها نسخه از طریق تکثیر در کمتر از سه ساعت، روش نسبتاً سریعی است. در مواردی که افراد از نظر ایمنی قادر به تولید آنتیبادی نباشند، از این آزمایش میتوان برای تائید استفاده نمود. در کنار این مزایا و قابلیت اجرا، این روش معایب بالقوهای نیز دارد. اولین و مهمترین عیب، هزینه آن است. در مقایسه با آزمونهای سنتی تکنیکی، گران قیمت است و انجام PCR به مهارت و تخصص نیاز دارد. علاوه بر این جهت انجام PCR باید دانش دقیقی از بیوانفورماتیک برای طراحی آغازگرها، برای وارد کردن جایگاههای محدود کننده و غیره داشت(33، 32).
نتیجهگیری
در این مطالعه در آزمایش الایزای اولیه، تعداد 66 نمونه واکنشزا و سر مرز بودند. در الایزای مجدد فقط 8 نمونه مثبت شدند. و در بررسی با آزمایشهای الکتروکمی لومینسانس، وسترن بلات و PCR همه 4 نمونه نتایج مشابه داشتند. اولین قدم متداول در تشخیص آلودگی افراد، برای تشخیص آنتیبادیهای اختصاصی این ویروس، آزمایش الایزا میباشد. الایزا حساسیت بالا دارد ولی ممکن است اختصاصیت بالایی نداشته باشد و با آنتیبادیهای دیگری واکنش متقاطع بدهد. این امر خود نشاندهنده ویژگی پایین و مثبت کاذب در کیتهای آنتیبادی به روش الایزای موجود در بازار میباشد. بنابراین استفاده از آزمایش الکتروکمی لومینسانس با حساسیت بالا میتواند باعث کاهش موارد مثبت کاذب روش الایزا شود و به همراه آزمایشهایی با ویژگی بالا مانند روش وسترن بلات و یا روش PCRبه عنوان آزمایش تائیدی و تکمیلی استفاده گردد.
تشکر و قدردانی
این مطالعه حاصل پایاننامه دانشجویی در مقطع PhD میکروبیولوژی و دارای کد اخلاق IR.TMI.REC.1396.014 از مؤسسه عالی طب انتقال خون میباشد. از مدیریت پایگاه انتقال خون استان گلستان، آقای دکتر بنیعقیل و پرسنل پایگاه هم چنین از خانم پاز کارشناس آزمایشگاه ویروسشناسی، کمال تشکر و قدردانی را داریم.
متن کامل: (5135 مشاهده)
مقایسه آزمایشهای الکتروکمی لومینسانس، وسترن بلات و PCR برای تائید
ویروس HTLV-1 در داوطلبان اهدای خون
حسین مهرابی حبیبآبادی1، زهره شریفی2، مسعود پارسانیا3، علیاکبر پورفتحاله4، ستاره حقیقت5
چکیده
سابقه و هدف
ویروس لنفوتروپیک سلول T انسانی نوعI ، با دو بیماری در انسان یعنی لوکمی/لنفوم T بزرگسالان و پاراپارسیس اسپاستیک گرمسیری مرتبط است. حدود 5 تا 10 میلیون نفر با HTLV-1 در سراسر جهان آلوده شدهاند. به منظور افزایش سلامت خون در گیرندگان و جلوگیری از نتایج کاذب در داوطلبان اهدای خون، نیاز است روشهای شناسایی عوامل عفونی، از حساسیت و اختصاصیت بالا برخوردار باشند. هدف از این مطالعه؛ مقایسه آزمایشهـای الکتروکمی لومینسانس، وسترن بلاتینگ و PCR ، برای تائید ویروس HTLV-1 بود.
مواد و روشها
این مطالعه تجربی در سال 1397 بر روی تعداد 66 نمونه(62 مرد و 4 زن) که با کیت الایزا دارای آنتیبادی علیه ویروس HTLV-1بودند و با روشهای الکتروکمی لومینسانس و وسترن بلات آزمایش شدند، انجام شد. همچنین جهت تشخیص ویروس با روش PCR ، اهداکنندگان خون مجدد فراخوان شدند و نمونه جدید از آنان اخذ شد. پس از استخراج DNA ، آزمایش Nested PCR با آغازگرهای هر دو ناحیه TAX و LTR انجام شد.
یافتهها
در این مطالعه تعداد 8 (1/12%) نمونه از 66 نمونه که با آزمایش الایزا، مجدداً واکنش نشان داده بودند، انتخاب شدند. تعداد 4 (6%) نمونه با روش الکتروکمی لومینسانس، حاوی آنتیبادی علیه HTLV-1 بودند. در بررسی با روشهای وسترن بلات و Nested PCR نیز، همان 4 (6%) نمونه مجدد مثبت شدند.
نتیجه گیری
استفاده از آزمایشهای الکتروکمی لومینسانس، وسترن بلات و روش PCRکه در این مطالعه نتایج مشابهی داشتند، برای تایید ویروس HTLV-1 مناسب میباشند.
کلمات کلیدی: وسترن بلات، کمی لومینسانس، Nested PCR ، HTLV-1
تاریخ دریافت: 30/7 /98
تاریخ پذیرش: 26/11/98
1- دانشجوی PhD میکروبیولوژی ـ گروه میکروبیولوژی، دانشکده علوم و فناوریهای نوین، علوم پزشکی تهران ـ دانشگاه آزاد اسلامی ـ تهران ـ ایران
2- مؤلف مسئول: PhD ویروسشناسی ـ استاد مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
3- PhD ویروسشناسی ـ دانشیار گروه میکروبیولوژی، دانشکده پزشکی، علوم پزشکی تهران ـ دانشگاه آزاد اسلامی ـ تهران ـ ایران
4- PhD ایمنیشناسی ـ استاد گروه ایمونولوژی ،دانشکده علوم پزشکی دانشگاه تربیت مدرس ـ تهران ـ ایران
5- PhD میکروبیولوژی ـ استادیار گروه میکروبیولوژی ،دانشکده علوم و فناوریهای نوین، علوم پزشکی تهران ـ دانشگاه آزاد اسلامی ـ تهران ـ ایران
ویروس HTLV-1 در داوطلبان اهدای خون
حسین مهرابی حبیبآبادی1، زهره شریفی2، مسعود پارسانیا3، علیاکبر پورفتحاله4، ستاره حقیقت5
چکیده
سابقه و هدف
ویروس لنفوتروپیک سلول T انسانی نوعI ، با دو بیماری در انسان یعنی لوکمی/لنفوم T بزرگسالان و پاراپارسیس اسپاستیک گرمسیری مرتبط است. حدود 5 تا 10 میلیون نفر با HTLV-1 در سراسر جهان آلوده شدهاند. به منظور افزایش سلامت خون در گیرندگان و جلوگیری از نتایج کاذب در داوطلبان اهدای خون، نیاز است روشهای شناسایی عوامل عفونی، از حساسیت و اختصاصیت بالا برخوردار باشند. هدف از این مطالعه؛ مقایسه آزمایشهـای الکتروکمی لومینسانس، وسترن بلاتینگ و PCR ، برای تائید ویروس HTLV-1 بود.
مواد و روشها
این مطالعه تجربی در سال 1397 بر روی تعداد 66 نمونه(62 مرد و 4 زن) که با کیت الایزا دارای آنتیبادی علیه ویروس HTLV-1بودند و با روشهای الکتروکمی لومینسانس و وسترن بلات آزمایش شدند، انجام شد. همچنین جهت تشخیص ویروس با روش PCR ، اهداکنندگان خون مجدد فراخوان شدند و نمونه جدید از آنان اخذ شد. پس از استخراج DNA ، آزمایش Nested PCR با آغازگرهای هر دو ناحیه TAX و LTR انجام شد.
یافتهها
در این مطالعه تعداد 8 (1/12%) نمونه از 66 نمونه که با آزمایش الایزا، مجدداً واکنش نشان داده بودند، انتخاب شدند. تعداد 4 (6%) نمونه با روش الکتروکمی لومینسانس، حاوی آنتیبادی علیه HTLV-1 بودند. در بررسی با روشهای وسترن بلات و Nested PCR نیز، همان 4 (6%) نمونه مجدد مثبت شدند.
نتیجه گیری
استفاده از آزمایشهای الکتروکمی لومینسانس، وسترن بلات و روش PCRکه در این مطالعه نتایج مشابهی داشتند، برای تایید ویروس HTLV-1 مناسب میباشند.
کلمات کلیدی: وسترن بلات، کمی لومینسانس، Nested PCR ، HTLV-1
تاریخ دریافت: 30/7 /98
تاریخ پذیرش: 26/11/98
1- دانشجوی PhD میکروبیولوژی ـ گروه میکروبیولوژی، دانشکده علوم و فناوریهای نوین، علوم پزشکی تهران ـ دانشگاه آزاد اسلامی ـ تهران ـ ایران
2- مؤلف مسئول: PhD ویروسشناسی ـ استاد مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
3- PhD ویروسشناسی ـ دانشیار گروه میکروبیولوژی، دانشکده پزشکی، علوم پزشکی تهران ـ دانشگاه آزاد اسلامی ـ تهران ـ ایران
4- PhD ایمنیشناسی ـ استاد گروه ایمونولوژی ،دانشکده علوم پزشکی دانشگاه تربیت مدرس ـ تهران ـ ایران
5- PhD میکروبیولوژی ـ استادیار گروه میکروبیولوژی ،دانشکده علوم و فناوریهای نوین، علوم پزشکی تهران ـ دانشگاه آزاد اسلامی ـ تهران ـ ایران
مقدمه
HTLV ویروسی با زنجیره RNA از خانواده رتروویریده و جنس دلتا رتروویروس میباشد که اولین بار توسط پوئز در سال 1980 در انسان شناخته شد(3-1). نوع 1 این ویروس (HTLV-I) در سال 1979 در مبتلایان به بیماری لنفوپرولیفراتیو سلول T و دو سال بعد نوع 2 ویروس (HTLV-II) در یک فرد مبتلا به لوکمی سلول مویی (Hairy Cell Leukemia) به عنوان اولین رتروویروسهای انسانی شناسایی شدند)4(. به علاوه موارد محدودی از آلودگی انسان به نوع 3 و 4 این ویروس در سالهای اخیر از آفریقای مرکزی گزارش شده است(5، 6). اغلب مبتلایان به عفونت (HTLV-I)در بیشتر عمر خود بدون علامت باقی میمانند و تنها در کمتر از 10%، عوارض ناشی از این ویروس را آشکار میکنند(7، 2، 1). راههای انتقال ویروس شامل: 1- دریافت خون و یا فرآوردههای خونی آلوده، 2- تماس جنسی، 3- مادر به کودک و 4- اعتیاد تزریقی میباشد و آلودگی HTLV-I گسترش جهانی دارد(10، 8). روشهایی که برای تشخیص ویروس HTLVبه کار برده میشود شامل روشهای سرولوژی و مولکولی میباشد. یکی از روشهای سرولوژیک، روش الکتروکمی لومینسانس است. الکتروکمی لومینسانس، تکنولوژی جدیدی است. وقتی یک الکترون از سطح تهییج شده یا بالاتر به سطح پایینتر انرژی میرسد و انرژی خود را به صورت نور متصاعد میکند، واکنش را به نام لومینسانس میشناسیم(14-11). شناسایی ویروس توسط این روش، ساندویچ دوتایی آنتیژن اطلاق میگردد، بدین صورت که آنتیژنهای نوترکیب خاصHTLV بیوتینه شده (HTLV-I gp21 و HTLV‑ II p24) و آنتیژنهای نوترکیب اختصاصی HTLV (HTLV-I gp21 و HTLV‑ II p24) که با کمپلکس روتنیوم نشانهگذاری شدهاند و همراه با نمونه تشکیل ساندویچ میدهند. بعد از آن با افزودن میکرو ذرات پوشیده شده با استرپتاویدین به فاز جامد متصل میشود. ترکیب واکنش به صورت مغناطیسی روی سطح الکترود در سلول اندازهگیری میشود و ترکیباتی که متصل نشوند، توسط ProCell II M برداشته میشوند. با استفاده از نور سنج نتایج به صورت خودکار با مقایسه سیگنالهای نمونههای مثبت که قبلاً توسط کالیبراسیون به دست آمده، تعیین میشود.
یکی دیگر از روشهای کلیدی آزمایش وسترن بلات میباشد. این روش یک آزمایش تأییدکننده است و وجود نوعی پادتن(ایمونوگلوبولین نوع جی) علیه چند نوع پروتئین ویروسی را بررسی میکند. افتراق بین HTLV I و HTLV II از طریق استفاده از rgp46-I ، یک واحد پروتئین نوترکیب پوششدار HTLV I و rgp46-II و یک واحد پروتئین نوترکیب پوششدار HTLV II انجام میشود. GD21 ، یک پروتئین نوترکیب پوششدار اپیتوپ اختصاصی مشترک HTLV I و HTLV II است که برای افزایش اختصاصیت تشخیص مورد استفاده قرار میگیرد. علاوه بر این، افتراق بین انواع ویروس HTLV تحت تأثیر استفاده پروتئین gag(p19, p24) قرار میگیرد. اگر p19 بزرگتر یا مساوی p24 باشد، عفونت HTLV-I و اگر p24 بزرگتر از p19 باشد، عفونت HTLV-II پیشنهاد میگردد.
واکنش زنجیرهای پلیمراز(PCR)، یک روش آزمایشگاهی مولکولی است که همانندسازی و تکثیر قطعهای از D ژنوم ویروسی در دو ناحیه LTR و Tax توسط روش Nested PCR انجام میشود.
بررسی و مقایسه نتایج واکنشزای آزمایش الایزا با آزمایشهای تأییدی جهت تشخیص HTLV-I واقعی در جمعیت اهداکنندگان خون به منظور افزایش ضریب سلامت خون در گیرندگان و جلوگیری از معافیتهای کاذب و حفظ اهدکنندگان و تأمین ذخایر خونی مهم میباشد. هدف از این مطالعه، مقایسه آزمایشهای الکتروکمی لومینسانس، وسترن بلات و PCR به منظور تایید ویروس HTLV-I بود.
مواد و روشها
این مطالعه تجربی در سال 1397 در آزمایشگاه ویروسشناسی مرکز تحقیقات مؤسسه عالی طب انتقال خون انجام شد. تعداد 66 نمونه(62 مرد و 4 زن) که با کیت الایزا (ایتالیا، Diapro HTLV I-II Ab Kit) دارای جذب نوری مثبت و یا جذب نوری سر مرز به کنترل مثبت بودند، جمعآوری شدند. جذب نوری تعداد 6 نمونه بر اساس معیار cut off دارای واکنش قوی بودند و تعداد 60 نمونه سر مرز مثبت گزارش شدند. برای همه این نمونهها، مجدد با همان کیت، آزمایش انجام شد. همچنین بر روی این نمونهها و با استفاده از آزمایش الکتروکمی لومینسانس(آلمان، Roche ECL Kit) و بر اساس دستورالعمل کیت آزمایش انجام شد. بر روی نمونههای مثبت، آزمایش وسترن بلات(سوئیس، MP Kit) بر اساس دستورالعمل کیت انجام شد. برای انجام PCR ، اهداکنندگان با نتایج واکنشزا با الایزا دوباره فراخوان شده
و نمونه خون کامل همراه با ماده ضد انعقاد از آنها اخذ گردید. ابتدا از نمونهها DNA ژنومی استخراج(تایوان، FavorGen) گردید و به وسیله نانودراپ، غلظتها سنجش شد. در ادامه با DNA ژنومی استخراج شده، برای نمونهها آزمایش Nested PCR (دستگاه آلمانی، PEQ STAR) با آغازگرهای هر دو ناحیه ژنی TAX و LTR انجام شد و حجم محتویات میکروتیوبها به همراه چرخههای دمایی در نظر گرفته شد(جداول 3-1).
جدول 1: توالی آغازگرهای دو ناحیه Tax و LTR

جدول 2: حجم مواد میکروتیوبهای Nested PCR

جدول 3: چرخههای دمایی Nested PCR

در نوبت اول با استفاده از آغازگرهای اختصاصی ناحیه بیرونی Tax با آغازگر جلوبرنده به طول 7276-7257 و آغازگر معکوس به طول 8467-8447 و ناحیه LTR با آغازگر جلوبرنده به طول 31-9 و معکوس به طول 779-757 تکثیر شدند و در نوبت دوم با استفاده از آغازگرهای اختصاصی داخلی ناحیه Tax با آغازگر جلوبرنده به طول 7293-7274 و معکوس به طول 8393-8374 و ناحیه LTR با آغازگر جلوبرنده به طول 119-97 و معکوس به طول 746-722 تکثیر شدند و در پایان محصول ران دوم، Nested PCR روی ژل آگاروز 5/1%، با ولتاژ 100 الکتروفورز گردید و باندها روی ژل داک بررسی شد. نهایتاً محصولات PCR با باندهای اختصاصی نواحی LTR (bp 682) و Tax (bp 1119) تفسیر شدند. به منظور صحت فرآیند استخراج و PCR ، ژن بتااکتین به عنوان ژن خانهداری(Gene House Keeping) استفاده شد. آزمایش PCR در دستگاه آلمانی، PRQ STAR انجام شد.
یافتهها
در مطالعه انجام شده، 66 نمونه از داوطلبان اهدای خون(شامل 62 مرد با میانگین سنی 56/37 سال و 4 زن با میانگین سنی 92/38 سال همچنین تعداد 53 نفر متأهل و 13 نفر مجرد، بررسی شدند که در الایزای مجدد تعداد 8 نمونه(1/12%) مثبت شدند. در آزمایشهای الکتروکمی لومینسانس و وسترن بلات ، تعداد 4 (6%) نمونه مثبت نتایج یکسان و مشابه داشتند(شکل 1).
کیت وسترن بلات MPمورد استفاده، برای اولین بار تائیدیه FDA را به عنوان تست تأییدی دریافت کرده است.
هم چنین 8 نمونه با دو تکرار واکنشزای الایزا برای نمونهگیری مجدد فراخوان شدند که همه افراد فراخوان شده غیر از یک نفر، همکاری کردند و نمونه جدید گرفته شد. پس از استخراج DNA ژنومی، غلظت و خلوص DNA با نانودراپ اندازهگیری شد که خلوص DNA ژنومی برابر 8/1 بود. هم چنین آزمایش PCR بر روی DNA استخراجی نمونهها با آغازگر بتااکتین انجام شد و در تمام موارد محصول PCR مورد تائید قرار گرفت. در ادامه کار با بررسی حضور ژنوم ویروس 1-HTLV ، نتایج آزمایش Nested PCR برای سه نمونه در هر دو ناحیهTAX (bp 1119) و LTR (bp 682) درکنار نشانگر وزن مولکولی 100 جفت بازی مثبت شد و باند مورد نظر مشاهده گردید(شکل2).

شکل شماره 1: نتایج وسترن بلات نمونه های مثبت الایزا

شکل 2: نتایج ژل الکتروفورز محصول Nested PCR ویروس HTLVI . چاهک 1 نشانگر وزن مولکولی 100 جفت بازی. چاهک 2 محصول PCR ژن TAX (bp 1119( و چاهک 3 محصول PCR ژن LTR (bp 682).
بحث
در این مطالعه در الایزای اولیه، موارد واکنشزا و سر مرزی HTLV-I ، تعداد 8 (1/12%) نمونه مثبت شد و از این 8 نمونه واکنشی الایزا، در بررسی با آزمایشهای الکتروکمی لومینسانس و وسترن بلات، تعداد 4 (6%) نمونه بـه صـورت یکسان در هر دو آزمایش تائید شد. هم چنین
همان نمونه ها با آزمایش PCR هم مورد تائید قرار گرفتند.
ویروس HTLV ، یک رتروویروس است که ژنوم آن RNA تک رشتهای میباشد. این ویروس با فعالیت نسخهبرداری معکوس، DNA میسازد که به داخل ژنوم میزبان وارد میشود و با فرار از پاسخهای سیستم ایمنی میزبان، میتواند سالهای طولانی در بدن باقی بماند(16). تنوع ژنتیکی ویروس در مناطق جغرافیایی مختلف متفاوت است ولی در یک منطقه معمولاً یکسان است. میزان موتاسیون در این ویروس نسبت به سایر ویروسها بسیار کم است و در حدود 1% در طی هزاران سال میباشد(17). حدود 15 تا 20 میلیون نفر در سراسر دنیا به این ویروس آلوده هستند که از این بین 8%-2% به سمت بیماریهای شدید مرتبط با HTLV-1 میروند و بقیه به صورت ناقلین بدون علامت باقی میمانند(17). در مطالعه ژیاهوی بی و همکاران در سال 2012، به منظور ارزیابی گذر آزمایشهای نسل سوم HIV (enzyme linked immunosorbent assay/EIA) به نسل چهارم (electrochemiluminescence immunoassay/ChIA)، تعداد 227761 نمونه با EIA و تعداد 115835 نمونه با ChIA بررسی شدند و موارد مثبت هر دو آزمایش با آزمایش تائیدی وسترن بلات تکرار شد و حساسیت بالینی ChIA 88/99% و EIA 64/99% اعلام شد(18). در مطالعه ریموند بوآدو در سال 2016، به منظور بررسی و مقایسه ویژگی و حساسیت نمونه خون کامل و نمونه سرم با استفاده از کیتهای تشخیصی HIV ، تست تشخیصی سریع(RDT : Rapid diagnostic Test)، بر روی 280 بیمار مبتلا به HIV و غیر آلوده توسط آزمایش الکتروکمی لومینسانس انجام شد و مشخص گردید که نمونههای خونی کامل از ویژگیها و حساسیتهای بالاتر و ارزش تشخیصی مثبت و منفی بالاتری نسبت به سرم برخوردار هستند(19). در مطالعه آنجا دی وقلیره و همکاران در سال 2017، به منظور غربالگری و شیوع HCV در بین بیماران HIV مثبت در شهر کامبوج، تعداد 3045 بیمار HIV مثبت بدون سابقه درمان با HCV با روش الکتروکمی لومینسانس مورد ارزیابی قرار دادند و تعداد 230 (55/7%) مورد تشخیص داده شد که غربالگری هدفمند HCV در بین بیماران HIV مثبت را ارائه دادند(20). الکتروکمی لومینسانس، مزایای خوبی نسبت به روشهای تشخیصی دیگر مانند الایزا دارا میباشد، از جمله این مزایا میتوان قابلیت اتوماسیون کامل دستگاه در حذف کامل خطای تکنیکی، دارای معرف غیر ایزوتوپی بسیار پایدار و با کاربرد آسان، حساسیت بالا جهت
اندازهگیری آنالیتها با مقادیر بسیار کم و همچنین در مدت زمان کوتاه، سنجش با کیفیت بالا، برگشت سریع و آماده شدن برای سنجش دیگر و همچنین با توجه به عملکرد دستگاه قدرت تکرارپذیری بسیار بالا و کاهش مصرف معرفها و در نتیجه کاهش هزینهها و کاهش زمان را میتوان از ویژگیهای این سیستم بیان کرد. علاوه بر مزایا دارای معایب و محدودیتهایی نیز است که این محدودیتها شامل: بسته بودن سیستم )در این روش بایستی حتماً از دستگاه و کیتها و محلولها و همچنین سر سمپلر و چاهکهای مخصوصی استفاده شود که کاملاً انحصاری و در اختیار یک شرکت مشخص است(، هزینه قابل توجه دستگاه و همچنین کیتها و محلولهای آن میباشد. عبدالوهاب مرادی و همکاران، فراوانی آنتیبادی ضد TLV-1 را در 181 بیمار تالاسمی ماژور شهرستان گرگان در سالهای 83 و 84 مورد مطالعه قرار داده و موارد مثبت واقعی را 4/4% (8 نفر) گزارش نمودهاند. روش کار مرادی برای غربالگری اولیه الایزا و تست تائیدی وسترن بلات بود. در غربالگری به وسیله الایزا از 181 بیمار تالاسمی، 27 نفر (9/14%) مثبت شده بودند اما در آزمایش تائیدی وسترن بلات تنها 8 نفر (4/4%) نتایج مثبت را نشان دادند(21). در مطالعه انارکی و همکاران سال 2003، به منظور تشخیص ویروس HTLV در 175 بیمار تالاسمی شهر تهران با آزمایش الایزا، تعداد 12(8/6%) نمونه مثبت گزارش شد و آزمایش تائیدی وسترن بلات، تعداد 11 (3/6%) نمونه را تائید کرد(22). در مطالعه شهابی و همکاران سال 2014، به منظور تشخیص ویروس HTLV ، تعداد 201719 نمونه از داوطلبان اهدای خون در خراسان رضوی در سالهای 87-85 مورد مطالعه قرار گرفتند. در این مطالعه نتایج آزمایش الایزا 850 (42/0%) نمونه مثبت بود و با آزمایش وسترن بلات تعداد 32 (016/0%) نمونه تائید شد(23). در مطالعه جمیلی و همکاران سال 2013، به منظور تشخیص ویروس HTLV ، تعداد 21228 نمونه اهداکنندگان خون در سالهای 87-86 در شهر سبزوار بررسی شدند. نتایج غربالگری با آزمایش الایزا در تعداد 116(55/0%) نمونه مثبت بود و در بررسی با آزمایش تائیدی وسترن بلات، تعداد 56 (26/0%) نمونه مثبت تائید شد(24). در مطالعه استرامر و همکاران سال 2018، جهت غربالگری ویروس HTLV از دو آزمایش الایزا و کمیلومینسانت استفاده کردند و نتایج مثبت هر آزمایش با آزمایش دیگر تکرار شد و 100 نمونه repeat-reactive با آزمایش تکمیلی وسترن بلات مورد سنجش قرار گرفتند که نتایج شامل 79 نمونه منفی و 21 نمونه نامشخص بودند(25). وسترن بلات در مقایسه با آزمایش الایزا٬ اختصاصیتر است ولی چون آزمایش نسبتاً گرانی محسوب میشود و از حساسیت کمتری برخوردار است به عنوان اولین آزمایش انجام نمیگیرد و بیشتر در تائید نتایج مثبت شده آزمایش الایزا به کار میرود. آزمایش وسترن بلات در همراهی با آزمایش الایزا بیش از 99% مورد اطمینان خواهد بود. از مزایای وسترن بلات میتوان به قابلیت تشخیص سطح پیکوگرم پروتئین در نمونه اشاره کرد(26). اجازه میدهد تا این روش برای بسیاری از اهداف به عنوان ابزار تشخیصی مؤثر استفاده شود(27-28). حساسیت و اختصاصی بودن وسترن بلات به دو دلیل اصلی آن است: 1) جداسازی پروتئینهایی که از نظر اندازه، بار و ترکیب با یکدیگر متفاوت هستند به وسیله ژل الکتروفورز انجام میشود. پروتئینهای دناتوره شده با اتصال به SDS (سدیم دودسیل سولفات) یک بار منفی داده میشوند، سپس بر اساس اندازه جدا میشوند. 2) اثر متقابل آنتیبادی و آنتیژن. مانند همه روشها، وسترن بلات هم محدودیتهای خود را نیز دارد(28، 27). محدودیت اصلی وسترن بلات این است که فقط در صورت وجود یک آنتیبادی اولیه علیه پروتئین مورد نظر میتوان آن را انجام داد(29). در مطالعه موناوردی و همکاران در سال 2011، به منظور تشخیص ویروس HTLV در 60 بیمار با بدخیمی خون بستری در بخش انکولوژی بیمارستان حضرت رسول، در غربالگری نمونهها با آزمایش الایزا، تعداد 18 (30%) نمونه مثبت گزارش شد و برای تائید آنها از آزمایش Real-time PCR ناحیه TAX استفاده شد که تعداد 12 (20%) نمونه مورد تائید قرار گرفت(30). در مطالعه ثقفی و همکاران در سال 2018، در میان 125 فرد مبتلا به بیماری تنفسی- خود ایمنی سارکوئیدوز در مقایسه با جمعیت سالم شهر مشهد، وجود HTLV1 با آزمایش الایزا در تعداد 5 نمونه مثبت تشخیص داده شد و همان نمونهها با آزمایش PCR تائید شد. و در نهایت فروانی HTLV1 در این بیماران در شمال شرقی ایران 4% گزارش شد(31). در مطالعه پیرایش فرد و همکاران در سال 2018، به منظور تشخیص ویروس HTLV تعداد 2000 نمونه اهداکنندگان شهر تهران، 100 نمونه بیمارHIV مقبت و 100 نمونه بیمار بتا تالاسمی و در مجموع 2200 نمونه غربالگری شد که با آزمایش الایزا تعداد 34 نمونه اهداکنندگان و 12 نمونه بیمار HIV مثبت شدند و با آزمایش تائیدی Nested PCR، تعداد 1 نمونه از اهداکنندگان، 5 نمونه از بیماران HIV مثبت و 8 نمونه از بیماران بتا تالاسمی تائید شد(15). روش Nested PCRجهت افزایش حساسیت PCR و همچنین به حداقل رساندن تکثیر غیر اختصاصی و محصولات کاذب PCR طراحی میشود که سبب اتصال آغازگر به جایگاههای پیشبینی شده DNA هدف شود. Nested PCR شامل 2 مجموعه از آغازگر است که آنها در دو نوبت کاری پی در پی در واکنش PCR استفاده میشوند. عملکرد مجموعه دوم آغازگر این است که به جایگاه هدف دوم در داخل توالی تکثیر شده با مجموعه اول آغازگر اتصال یابند. به طوری که بسیار بعید است که توالی کاذب یا ناخواسته، جایگاه اتصال برای هر دو مجموعه آغازگرها داشته باشد. به خاطر این که تکثیر با آغازگرهای اختصاصی، انجام میشود، روش بسیار اختصاصی است. به علت تولید میلیونها نسخه از طریق تکثیر در کمتر از سه ساعت، روش نسبتاً سریعی است. در مواردی که افراد از نظر ایمنی قادر به تولید آنتیبادی نباشند، از این آزمایش میتوان برای تائید استفاده نمود. در کنار این مزایا و قابلیت اجرا، این روش معایب بالقوهای نیز دارد. اولین و مهمترین عیب، هزینه آن است. در مقایسه با آزمونهای سنتی تکنیکی، گران قیمت است و انجام PCR به مهارت و تخصص نیاز دارد. علاوه بر این جهت انجام PCR باید دانش دقیقی از بیوانفورماتیک برای طراحی آغازگرها، برای وارد کردن جایگاههای محدود کننده و غیره داشت(33، 32).
نتیجهگیری
در این مطالعه در آزمایش الایزای اولیه، تعداد 66 نمونه واکنشزا و سر مرز بودند. در الایزای مجدد فقط 8 نمونه مثبت شدند. و در بررسی با آزمایشهای الکتروکمی لومینسانس، وسترن بلات و PCR همه 4 نمونه نتایج مشابه داشتند. اولین قدم متداول در تشخیص آلودگی افراد، برای تشخیص آنتیبادیهای اختصاصی این ویروس، آزمایش الایزا میباشد. الایزا حساسیت بالا دارد ولی ممکن است اختصاصیت بالایی نداشته باشد و با آنتیبادیهای دیگری واکنش متقاطع بدهد. این امر خود نشاندهنده ویژگی پایین و مثبت کاذب در کیتهای آنتیبادی به روش الایزای موجود در بازار میباشد. بنابراین استفاده از آزمایش الکتروکمی لومینسانس با حساسیت بالا میتواند باعث کاهش موارد مثبت کاذب روش الایزا شود و به همراه آزمایشهایی با ویژگی بالا مانند روش وسترن بلات و یا روش PCRبه عنوان آزمایش تائیدی و تکمیلی استفاده گردد.
تشکر و قدردانی
این مطالعه حاصل پایاننامه دانشجویی در مقطع PhD میکروبیولوژی و دارای کد اخلاق IR.TMI.REC.1396.014 از مؤسسه عالی طب انتقال خون میباشد. از مدیریت پایگاه انتقال خون استان گلستان، آقای دکتر بنیعقیل و پرسنل پایگاه هم چنین از خانم پاز کارشناس آزمایشگاه ویروسشناسی، کمال تشکر و قدردانی را داریم.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |






