جلد 16، شماره 3 - ( پاییز 1398 )
جلد 16 شماره 3 صفحات 200-194 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Ghasemzadegan H, Shahabi M, Rezaei N, Sharifi Z. Design a Real Time PCR with SYBR Green for quantification of HTLV-1 proviral load for blood donors. bloodj 2019; 16 (3) :194-200
URL: http://bloodjournal.ir/article-1-1248-fa.html
URL: http://bloodjournal.ir/article-1-1248-fa.html
قاسم زادگان حمیده، شهابی مجید، رضایی نگار، شریفی زهره. راهاندازی روش Real-Time PCR جهت تعیین بار پرووایرال ویروس لنفوتروپیک T انسانی نوع I به روش سایبرگرین جهت نمونههای اهداکنندگان خون. فصلنامه پژوهشی خون. 1398; 16 (3) :194-200
استاد مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پزوهشی طب انتقال خون
متن کامل [PDF 476 kb]
(5382 دریافت)
| چکیده (HTML) (3946 مشاهده)
مقدمه
ویروس HTLV(Human T-cell Leukemia/Lymphoma)، یک رتروویروس متعلق به خانواده رتروویریده میباشد. شیوع ویروس لوسمی/لنفوم سلولهای T انسانی(HTLV-1) در مناطق اندمیک در اهدا کنندگان خون بین 1/2-6/0 درصد و در مناطق غیر اندمیک کمتر از 1/0 درصد است(1). ژنوم ویروس دو کپی از RNA تک رشتهای میباشد. این ویروسها فعالیت ترانس کریپتازی معکوس دارند که از روی RNA میتوانند DNA بسازند. HTLV-1 از طریق خون و محصولات خونی آلوده، استفاده از داروهای داخل رگی، تماس جنسی و انتقال از مادر به نوزاد از طریق شیر مادر منتقل میشود. احتمال سرایت ویروس HTLVاز راه انتقال خون به میزان شیوع ویروس در جمعیت عمومی و اهداکنندگان، مرحله و دوره کمون بیماری، نوع محصول خونی دریافت شده و مدت زمان ذخیرهسازی محصولات خونی بستگی دارد(2). تقریباً 30% افراد آلوده به این ویروس بدون علامت هستند .نوع بیماری ایجاد شده با روش انتقال ویروس در ارتباط است. انتقال خون بیشتر با ایجاد HAM/TSP(HTLV-1 Associated Myelopathy/ Tropical Spastic Paraparesis) مرتبط است. البته موارد ATL هم مشاهده شده است(2). بعد از انتقال ویروس، رونویسی معکوس از RNA ژنومی آن باعث تولید DNA پرو وایرال میشود، پروویروسها به وسیله اینتگراز ویروسی به درون ژنوم میزبان وارد میشوند. سپس آلودگی HTLV-1 ، با حداقل تولید ذرات ویروسی، در سلولهای در حال تقسیم منتشر میگردد. بنابراین تعیین میزان پرو ویروس بازتابی از تعداد سلولهای آلوده میباشد. آزمایشهای سرولوژیکی که برای تشخیص HTLV استفاده میشود قادر به تشخیص بیماری در مرحله ابتدایی آلودگی یعنی زمانی که هنوز سیستم ایمنی در مرحله شروع پاسخ است و هنوز آنتیبادیهای اختصاصی علیهHTLV-1 در سرم فرد ظاهر نشده است(یا این که تیتر پایین است) نمیباشند(2). هم چنین به علت خطر انتقال ویروس HTLV-1 از راه خون و فرآوردههای خونی و با توجه به آلودگی اهداکنندگان خون در مناطق آندمیک با این ویروس برای دستیابی به تعداد کپی پرو ویروس و وضعیت آن در پیشرفت بیماری در اهداکنندگان، وجود یک آزمایش کمی و مولکولی برای تعیین پرووایرال لود در اهداکنندگان خون نیاز است(2). علاوه بر این، آزمایش PCR برای تایید جوابهای نامشخص وسترن بلات نیز کارآیی دارد(3). این پروژه با استفاده از روش کلونینگ پلاسمید حاوی ژن Tax به عنوان استاندارد، آزمایش Real- Time PCR برای تعیین پرووایرال لود راهاندازی شد. HTLV-1 معمولاً به صورت خارج از سلول دیده نمیشود (5، 4)، بنابراین به جای RNA ویروس برای تعیین پرووایرال لود ویروس، از سلولهای تک هستهای خون محیطی که پروویروس HTLV-1 را حمل میکنند استفاده میشود(5). DNA ژنومی از سلولهای تک هستهای خون محیطی که پروویروس HTLV-1 را حمل میکنند استخراج شده و سپس بر روی DNA استخراج شده، آزمایش PCR انجام شد. با استفاده از محصول ژن Tax در وکتور pTZ57R/T کلونینگ این ژن انجام شد. در نهایت از پلاسمید حاوی ژن Tax به عنوان استاندارد آزمایش Real-Time PCR استفاده شد.
مواد و روشها
در یک مطالعه تجربی، ابتدا نمونه چند نفر از اهداکنندگان خون آلوده به HTLV-1 در استان خراسان رضوی در لولههای حاوی EDTA جمعآوری شد و به آزمایشگاه ویروسشناسی منتقل گردید. در غربالگری اولیه آزمایش الایزا(کیت MP دیاگنوستیکا) بر روی سرم این بیماران انجام شد. سپس برای تایید نتیجه آن بر روی همان نمونهها آزمایش وسترن بلات(کیت MP دیاگنوستیکا) انجام گردید و نتایج آزمایش الایزا با وسترن بلات تایید شد. سپس استخراج DNA از نمونههای بافیکوت اهداکنندگان خون آلوده به HTLV-1 با استفاده از کیت یکتا تجهیز آزما به شماره ساخت DNB2015042202 انجام شد و بر روی ژن Tax با استفاده از Master Mix (دانمارک، آمپلیکون) آغازگرها و چرخه دمایی مشخص آزمایش Nested PCR انجام شد(جداول 1 و 2). موارد مثبت جهت کلونینگ و تهیه استاندارد، تحت Real Time PCR جهت پرووایرال لود با استفاده از آغازگرها قرار گرفتند(جدول 3).

محصولاتPCR پس از انجام آزمایش، از لحاظ تکثیر ژن TAX بررسی شدند. برای تایید محصول PCR ، الکتروفورز بر روی ژل آگارز 5/1% انجام شد.
کلونینگ و واکنش اتصال (Ligation Reaction) محصول PCR با استفاده از کیت خالصسازی محصول PCR (آلمان، رُوش) انجام شد. سپس کلونینگ ژن Tax-1 با استفاده از کیت کلونینگ فرمنتاز در پلاسمید pTZ57R/T صورت پذیرفت. واکنش اتصال قطعات محصول PCR با پلاسمید pTZ57R/T طبق روش کیت انجام شد. برای انتقال پلاسمید نوترکیب به باکتری E.coli مستعد سوش TG1 (Transformation) از روش شوک حرارتی استفاده شد. استخراج پلاسمید نوترکیب با استفاده از کیت رُوش صورت پذیرفت. با استفاده از روش PCR و آغازگر اختصاصی قطعه مورد نظر، وجود قطعه DNA خارجی در ناقل پلاسمیدی تایید شد(جدول 3).
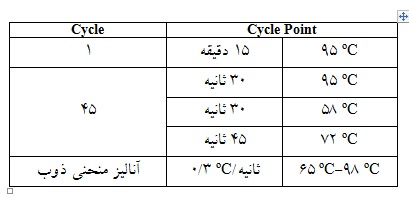
جهت تعیین توالی، نمونه پلاسمیدهای نوترکیب خالص شده به همراه آغازگرهای ژن Tax به شرکت ژن فنآوران ارسال گردید. جهت انجام آزمایش Real - Time PCR ، بعد از تهیه منحنی استاندارد و انجام مراحل کنترل کیفی، آزمایش Real - Time PCR به روش سایبرگرین روی DNA ژنومی استخراج شده انجام شد. از ژن Tax که توسط روش کلونینـگ بـه دسـت آمـد، به عنوان استاندارد Real - Time PCR استفاده شد. ابتدا تعداد کپی پلاسمید نوترکیب محاسبه شد سپس بر روی پلاسمید نوترکیب، رقتسازی(copy/µL 109 - copy/µL 101) انجام شد و آزمایـش Real - Time PCR بـا استفـاده از چرخـه دمایـی
منحنی استاندارد رسم شد(جدول 4).
جهت ولیدیشن Real - Time PCR مراحل زیر انجام شد: حساسیت (Analytical Sensitivity) : سه رقت از استاندارد (copy/µL103-copy/µL101) در سه روز مختلف به صورت تکرار 8 تایی آزمایش استفاده شد.
خطی بودن(Linearity): پنج رقت از استاندارد PTZ-HTLV-1 (copy/µL106-copy/µL102) به صورت پنج تایی در یک روز آزمایش شد. دقت(Precision): شش رقت از استاندارد(copy/µL106-copy/µL101) به صورت شش تایی در یک روز برای اینترا اسی. کارآیی(Efficiency): آمپلیفیکاسیون میباشد که با فرمول /slope1-10 E= محاسبه میشود. شیب خط و 2R (Slope) : در واقع خطی بودن نتایج را نشان میدهد.
جدول 4: جدول زمانبندی Real Time PCR
یافتهها
محصول آزمایش Nested PCR الکتروفورز شد. وجود باندbp 890 نشاندهنده تکثیر ژن Tax بود(شکل 1).
پس از مرحله کلونینگ، بر روی پلاسمید نوترکیب آزمایش PCR و الکتروفورز انجام شد. هم چنین پلاسمید نوترکیب تعیین سکانس شد و کلونینگ تایید گردید.
در نهایت آزمایش Real - Time PCR بر روی رقتهای مختلف پلاسمید نوترکیب انجام شد. حساسیت (Analytical Sensitivity) در سه رقت از استاندارد (copy/µL103-copy/µL101) در سه روز مختلف به صورت تکرار 8 تایی آزمایش انجام شد که قادر به تشخیص copy/µL101 ذره ویروسی بود. خطی بودن و کارآیی آمپلیفیکاسیون دارای شیب خط ، برابر 3/3 و2R آن 98/0> بود (نمودار 1). جهت بررسی اختصاصی بودن واکنشها از منحنی ذوب استفاده شد که دمای 89 درجه سانتیگراد نشان داد واکنش آزمایش اختصاصی میباشد(نمودار 2).

شکل 1: مشاهده باند bp 890 نشاندهنده حضور ژن Tax در نمونهها در کنار مارکر bp 100
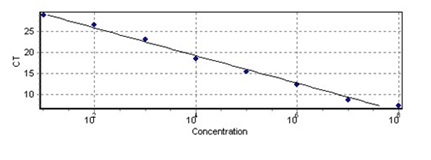
نمودار 1: نمودار منحنی استاندارد Real Time PCR با استفاده از رقتهای مختلف پلاسمید نوترکیب(copy/µL 109- copy/µL 101)

نمودار 2: نمودار منحنی استاندارد Real Time PCR با استفاده از رقتهای مختلف پلاسمید نوترکیب (copy/µL109-copy/µL101)
بحث
در مقالات متعددی از سنجش لود ویروس به عنوان یک فاکتور پیشآگهی و پایش بیماران تحت درمان نام برده شده است(7، 6). چون پرووایرال لود یک فاکتور مهم در ایجاد و پیشرفت بیماریهای مرتبط با HTLV-1 است، نیاز به انجام یک آزمایش کمی احساس میشود. آیکو ماساکی و همکاران در مقاله خود بیان کردند که پرووایرال لود بالاتر در سلولهای تک هستهای خون محیطی به عنوان یک فاکتور خطر در ایجاد ATL میباشد.
هم چنین ارتباط مستقیم و چشمگیری بین پرووایرال لود در سلولهای تک هستهای خون محیطی و میزان بیان (Program Cell Death Protein) PD-1 و کاهش عملکرد Tax-CTL وجود دارد(8).
واترز و همکاران در مطالعه خود بیان کردند که آزمایش qPCR (Quantitative PCR) ولید شده، به عنوان یک آزمایش کارآمد که قادر به اندازهگیری پرووایرال لود باشد و هم چنین قابلیت تکرارپذیری داشته باشد، مورد نیاز است. از آن جایی که هنوز یک بیومارکر اختصاصی برای پیشبینی پیشرفت بیماری در افراد بدون علامت وجود ندارد و از طرفی میزان آنتیبادی اختصاصی علیه HTLV-1 با پرووایرال لود ویروس همبستگی دارد، میتوان از پرووایرال لود به عنوان روشی برای پیشبینی نتایج عفونت و پیشرفت بیماری استفاده نمود(9).
به طور روتین از روش الایزا برای غربالگری اهداکنندگان خون استفاده میشود و به کمک وسترن بلات نتایج آن تایید میگردد. آزمایش الایزا حساسیت بالا دارد ولی ممکن است اختصاصیت بالایی نداشته باشد و با آنتیژنهای دیگری واکنش متقاطع بدهد. وسترن بلات نیز یک روش سنجش ایمنی بر پایه آنتیبادی میباشد که به عنوان آزمایش تاییدی در کسانی که از نظر آنتیبادی با آزمایش الایزا مثبت بودهاند استفاده میشود. وسترن بلات و روشهای مبتنی بر سنجش آنتیبادی در بیماران با سرکوب یا ضعف سیستم ایمنی، در کسانی که در دوره پنجره هستند، در عفونتهای اخیر و در نوزادان روش مناسبی نمیباشد. در روش وسترن بلات گاهی جوابها نامشخص است که میزان این جوابها از 2/0 در مناطق غیر اندمیک تا 50% در مناطق اندمیک متغیر است. این جوابهای بدون پاسخ ممکن است نشاندهنده عفونت واقعی HTLV-1 ، مثبت کاذب و یا تغییرات سرمی باشد. پس برای رفع این مشکل نیاز به آزمایشهای مولکولی میباشد. روشهایی که بر اساس ازدیاد DNA است مثل PCR و Real Time PCR روشهای مناسبی هستند. مزیت روش qPCR آلودگی کمتر نسبت به PCR معمولی میباشد. هم چنین میتوان در هر مرحلهای از آزمایش نتیجه را مشاهده کرد و مانند PCR معمولی نیاز نیست که کل پروسه به اتمام برسد.
از طرفی نسبت به روشهای متداول کشت، سرعت بالاتر و قیمت مناسبتر دارد. روش Real Time به دو شکل میتواند انجام شود. یکی به روش سایبرگرین و دیگری روش .TaqMan prob مزیت روش سایبرگرین نسبت به پروب این است که روش سایبرگرین مقرون به صرفهتر است و هم چنین دردسرهای طراحی پروب را هم ندارد(10).
لی و همکارانش در مطالعه خود برای سنجش پرووایرال لود ویروس HTLV-1 از رده سلولی MT2 به عنوان استاندارد استفاده کردند در این مطالعه به دلیل عدم دسترسی به این سل لاین از روش کلونینگ استفاده شد. رسـم منحنی استاندارد با پلاسمید نوترکیب حاوی ژن Tax-1 نشان داد که این روش با شیب خط 3/3 و 99/0= 2R قابل مقایسه با سل لاین MT2جهت رسم منحنی استاندارد در Real Time PCR میباشد و نتایج آن مشابه نتایج لی و همکارانش بود. هم چنین دمای ذوب در آزمایش با پلاسمید نوترکیب 89 درجه سانتیگراد یعنـی نزدیـک بـا دمـای ذوب سـل لایـن MT2یعنــی 88 درجه سانتیگـراد بـود. دامنـه پـرووایـرال در ایـن مطالعـه
(copy/µL106-copy/µL101) ذره ویروسی بود.
نتیجهگیری
این آزمایش دارای دامنه مناسبی جهت تعیین پرووایرال لود از copy/µL106 تا 101(حد پایینتر و بالاتر تشخیصی) در هر واکنش پرووایرال لود HTLV-I بود و میتواند جهت بررسی رابطه بین بار پرو ویروس و بیماریزایی مورد استفاده قرار گیرد.
تشکر و قدردانی
این پژوهش حاصل پایاننامه کارشناسی ارشد مرکز تحقیقات مؤسسه عالی آموزشی و پژوهشی طب انتقال خون میباشد. بدین وسیله از مؤسسه به جهت حمایت مالی تشکر میگردد.
متن کامل: (2307 مشاهده)
راهاندازی روش Real – Time PCR جهت تعیین بار پرووایرال ویروس لنفوتروپیک T
انسانی نوع I به روش سایبرگرین جهت نمونههای اهداکنندگان خون
حمیده قاسمزادگان1، مجید شهابی2، نگار رضایی3، زهره شریفی4
چکیده
سابقه و هدف
استان خراسان در ایران برای ویروسHTLV-1 اندمیک است. با توجه به ناکارآمد بودن آزمایشهای سرولوژیکی در شناسایی ویروسها در دوره کمون، تایید جوابهای نامشخص وسترن بلات و خطر انتقال ویروس HTLV-1 از راه خون و فرآوردههای خونی، آزمایش Real – Time PCR به روش سایبرگرین راهاندازی شد. نمونههای مورد آزمایش، مربوط به اهداکنندگان خون آلوده به این ویروس در پایگاه انتقال خون استان خراسان رضوی در سال 1396 بودند.
مواد و روشها
در یک مطالعه تجربی، با استفاده از روش کلونینگ و رسم منحنی استاندارد، آزمایش Real - Time PCR برای تعیین پرووایرال لود راهاندازی شد. ابتدا DNAژنومی از سلولهای تک هستهای خون محیطی استخراج شد. سپس محصول PCR ژن Tax ، در یک وکتور کلونینگ قرار داده شد و با رقتسازی، منحنی استاندارد رسم و آزمایش Real – Time PCR با روش سایبرگرین راهاندازی شد.
یافتهها
با استفاده از محصول PCR برای ژن Tax، وکتور pTZ57/T و باکتریE.Coli (سوش TG1) کلونینگ انجام شد. صحت کلونینگ با Colony PCR و تعیین سکانس تایید شد. محصول کلونینگ به عنوان استاندارد آزمایش Real –Time PCR استفاده شد و با رقتسازی، منحنی استاندارد رسم شد. شیب خط منحنی استاندارد 3/3 slope= و 99/0 = 2R بوده که نشاندهنده خطی بودن و کارآیی واکنش آزمایش میباشد.
نتیجه گیری
روش Real –Time PCR جهت تعیین پرووایرال لود ویروس HTLV-1 مناسب است.
کلمات کلیدی: ویروس HTLV-1 ، پروویروس، Real - Time PCR
تاریخ دریافت: 29/11/97
تاریخ پذیرش: 22/5 /98
1- دانشجوی کارشناسی ارشد هماتولوژی و بانک خون ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
2- PhD بیوتکنولوژی ـ استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
3- PhD اپیدمیولوژی ـ استادیار مرکز تحقیقات بیماریهای غیرواگیر پژوهشگاه غدد و متابولیسم دانشگاه علوم پزشکی تهران ـ تهران ـ ایران
4- مؤلف مسئول: PhD ویروسشناسی ـ استاد مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
انسانی نوع I به روش سایبرگرین جهت نمونههای اهداکنندگان خون
حمیده قاسمزادگان1، مجید شهابی2، نگار رضایی3، زهره شریفی4
چکیده
سابقه و هدف
استان خراسان در ایران برای ویروسHTLV-1 اندمیک است. با توجه به ناکارآمد بودن آزمایشهای سرولوژیکی در شناسایی ویروسها در دوره کمون، تایید جوابهای نامشخص وسترن بلات و خطر انتقال ویروس HTLV-1 از راه خون و فرآوردههای خونی، آزمایش Real – Time PCR به روش سایبرگرین راهاندازی شد. نمونههای مورد آزمایش، مربوط به اهداکنندگان خون آلوده به این ویروس در پایگاه انتقال خون استان خراسان رضوی در سال 1396 بودند.
مواد و روشها
در یک مطالعه تجربی، با استفاده از روش کلونینگ و رسم منحنی استاندارد، آزمایش Real - Time PCR برای تعیین پرووایرال لود راهاندازی شد. ابتدا DNAژنومی از سلولهای تک هستهای خون محیطی استخراج شد. سپس محصول PCR ژن Tax ، در یک وکتور کلونینگ قرار داده شد و با رقتسازی، منحنی استاندارد رسم و آزمایش Real – Time PCR با روش سایبرگرین راهاندازی شد.
یافتهها
با استفاده از محصول PCR برای ژن Tax، وکتور pTZ57/T و باکتریE.Coli (سوش TG1) کلونینگ انجام شد. صحت کلونینگ با Colony PCR و تعیین سکانس تایید شد. محصول کلونینگ به عنوان استاندارد آزمایش Real –Time PCR استفاده شد و با رقتسازی، منحنی استاندارد رسم شد. شیب خط منحنی استاندارد 3/3 slope= و 99/0 = 2R بوده که نشاندهنده خطی بودن و کارآیی واکنش آزمایش میباشد.
نتیجه گیری
روش Real –Time PCR جهت تعیین پرووایرال لود ویروس HTLV-1 مناسب است.
کلمات کلیدی: ویروس HTLV-1 ، پروویروس، Real - Time PCR
تاریخ دریافت: 29/11/97
تاریخ پذیرش: 22/5 /98
1- دانشجوی کارشناسی ارشد هماتولوژی و بانک خون ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
2- PhD بیوتکنولوژی ـ استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
3- PhD اپیدمیولوژی ـ استادیار مرکز تحقیقات بیماریهای غیرواگیر پژوهشگاه غدد و متابولیسم دانشگاه علوم پزشکی تهران ـ تهران ـ ایران
4- مؤلف مسئول: PhD ویروسشناسی ـ استاد مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
مقدمه
ویروس HTLV(Human T-cell Leukemia/Lymphoma)، یک رتروویروس متعلق به خانواده رتروویریده میباشد. شیوع ویروس لوسمی/لنفوم سلولهای T انسانی(HTLV-1) در مناطق اندمیک در اهدا کنندگان خون بین 1/2-6/0 درصد و در مناطق غیر اندمیک کمتر از 1/0 درصد است(1). ژنوم ویروس دو کپی از RNA تک رشتهای میباشد. این ویروسها فعالیت ترانس کریپتازی معکوس دارند که از روی RNA میتوانند DNA بسازند. HTLV-1 از طریق خون و محصولات خونی آلوده، استفاده از داروهای داخل رگی، تماس جنسی و انتقال از مادر به نوزاد از طریق شیر مادر منتقل میشود. احتمال سرایت ویروس HTLVاز راه انتقال خون به میزان شیوع ویروس در جمعیت عمومی و اهداکنندگان، مرحله و دوره کمون بیماری، نوع محصول خونی دریافت شده و مدت زمان ذخیرهسازی محصولات خونی بستگی دارد(2). تقریباً 30% افراد آلوده به این ویروس بدون علامت هستند .نوع بیماری ایجاد شده با روش انتقال ویروس در ارتباط است. انتقال خون بیشتر با ایجاد HAM/TSP(HTLV-1 Associated Myelopathy/ Tropical Spastic Paraparesis) مرتبط است. البته موارد ATL هم مشاهده شده است(2). بعد از انتقال ویروس، رونویسی معکوس از RNA ژنومی آن باعث تولید DNA پرو وایرال میشود، پروویروسها به وسیله اینتگراز ویروسی به درون ژنوم میزبان وارد میشوند. سپس آلودگی HTLV-1 ، با حداقل تولید ذرات ویروسی، در سلولهای در حال تقسیم منتشر میگردد. بنابراین تعیین میزان پرو ویروس بازتابی از تعداد سلولهای آلوده میباشد. آزمایشهای سرولوژیکی که برای تشخیص HTLV استفاده میشود قادر به تشخیص بیماری در مرحله ابتدایی آلودگی یعنی زمانی که هنوز سیستم ایمنی در مرحله شروع پاسخ است و هنوز آنتیبادیهای اختصاصی علیهHTLV-1 در سرم فرد ظاهر نشده است(یا این که تیتر پایین است) نمیباشند(2). هم چنین به علت خطر انتقال ویروس HTLV-1 از راه خون و فرآوردههای خونی و با توجه به آلودگی اهداکنندگان خون در مناطق آندمیک با این ویروس برای دستیابی به تعداد کپی پرو ویروس و وضعیت آن در پیشرفت بیماری در اهداکنندگان، وجود یک آزمایش کمی و مولکولی برای تعیین پرووایرال لود در اهداکنندگان خون نیاز است(2). علاوه بر این، آزمایش PCR برای تایید جوابهای نامشخص وسترن بلات نیز کارآیی دارد(3). این پروژه با استفاده از روش کلونینگ پلاسمید حاوی ژن Tax به عنوان استاندارد، آزمایش Real- Time PCR برای تعیین پرووایرال لود راهاندازی شد. HTLV-1 معمولاً به صورت خارج از سلول دیده نمیشود (5، 4)، بنابراین به جای RNA ویروس برای تعیین پرووایرال لود ویروس، از سلولهای تک هستهای خون محیطی که پروویروس HTLV-1 را حمل میکنند استفاده میشود(5). DNA ژنومی از سلولهای تک هستهای خون محیطی که پروویروس HTLV-1 را حمل میکنند استخراج شده و سپس بر روی DNA استخراج شده، آزمایش PCR انجام شد. با استفاده از محصول ژن Tax در وکتور pTZ57R/T کلونینگ این ژن انجام شد. در نهایت از پلاسمید حاوی ژن Tax به عنوان استاندارد آزمایش Real-Time PCR استفاده شد.
مواد و روشها
در یک مطالعه تجربی، ابتدا نمونه چند نفر از اهداکنندگان خون آلوده به HTLV-1 در استان خراسان رضوی در لولههای حاوی EDTA جمعآوری شد و به آزمایشگاه ویروسشناسی منتقل گردید. در غربالگری اولیه آزمایش الایزا(کیت MP دیاگنوستیکا) بر روی سرم این بیماران انجام شد. سپس برای تایید نتیجه آن بر روی همان نمونهها آزمایش وسترن بلات(کیت MP دیاگنوستیکا) انجام گردید و نتایج آزمایش الایزا با وسترن بلات تایید شد. سپس استخراج DNA از نمونههای بافیکوت اهداکنندگان خون آلوده به HTLV-1 با استفاده از کیت یکتا تجهیز آزما به شماره ساخت DNB2015042202 انجام شد و بر روی ژن Tax با استفاده از Master Mix (دانمارک، آمپلیکون) آغازگرها و چرخه دمایی مشخص آزمایش Nested PCR انجام شد(جداول 1 و 2). موارد مثبت جهت کلونینگ و تهیه استاندارد، تحت Real Time PCR جهت پرووایرال لود با استفاده از آغازگرها قرار گرفتند(جدول 3).
جدول 1: آغازگرهای مورد استفاده جهت Nested PCR

جدول 2: جدول زمانی و دمایی آزمایش Nested PCR

جدول 3: توالی آغازگرهای Real Time PCR

جدول 2: جدول زمانی و دمایی آزمایش Nested PCR

جدول 3: توالی آغازگرهای Real Time PCR

محصولاتPCR پس از انجام آزمایش، از لحاظ تکثیر ژن TAX بررسی شدند. برای تایید محصول PCR ، الکتروفورز بر روی ژل آگارز 5/1% انجام شد.
کلونینگ و واکنش اتصال (Ligation Reaction) محصول PCR با استفاده از کیت خالصسازی محصول PCR (آلمان، رُوش) انجام شد. سپس کلونینگ ژن Tax-1 با استفاده از کیت کلونینگ فرمنتاز در پلاسمید pTZ57R/T صورت پذیرفت. واکنش اتصال قطعات محصول PCR با پلاسمید pTZ57R/T طبق روش کیت انجام شد. برای انتقال پلاسمید نوترکیب به باکتری E.coli مستعد سوش TG1 (Transformation) از روش شوک حرارتی استفاده شد. استخراج پلاسمید نوترکیب با استفاده از کیت رُوش صورت پذیرفت. با استفاده از روش PCR و آغازگر اختصاصی قطعه مورد نظر، وجود قطعه DNA خارجی در ناقل پلاسمیدی تایید شد(جدول 3).
جهت تعیین توالی، نمونه پلاسمیدهای نوترکیب خالص شده به همراه آغازگرهای ژن Tax به شرکت ژن فنآوران ارسال گردید. جهت انجام آزمایش Real - Time PCR ، بعد از تهیه منحنی استاندارد و انجام مراحل کنترل کیفی، آزمایش Real - Time PCR به روش سایبرگرین روی DNA ژنومی استخراج شده انجام شد. از ژن Tax که توسط روش کلونینـگ بـه دسـت آمـد، به عنوان استاندارد Real - Time PCR استفاده شد. ابتدا تعداد کپی پلاسمید نوترکیب محاسبه شد سپس بر روی پلاسمید نوترکیب، رقتسازی(copy/µL 109 - copy/µL 101) انجام شد و آزمایـش Real - Time PCR بـا استفـاده از چرخـه دمایـی
منحنی استاندارد رسم شد(جدول 4).
جهت ولیدیشن Real - Time PCR مراحل زیر انجام شد: حساسیت (Analytical Sensitivity) : سه رقت از استاندارد (copy/µL103-copy/µL101) در سه روز مختلف به صورت تکرار 8 تایی آزمایش استفاده شد.
خطی بودن(Linearity): پنج رقت از استاندارد PTZ-HTLV-1 (copy/µL106-copy/µL102) به صورت پنج تایی در یک روز آزمایش شد. دقت(Precision): شش رقت از استاندارد(copy/µL106-copy/µL101) به صورت شش تایی در یک روز برای اینترا اسی. کارآیی(Efficiency): آمپلیفیکاسیون میباشد که با فرمول /slope1-10 E= محاسبه میشود. شیب خط و 2R (Slope) : در واقع خطی بودن نتایج را نشان میدهد.
جدول 4: جدول زمانبندی Real Time PCR

یافتهها
محصول آزمایش Nested PCR الکتروفورز شد. وجود باندbp 890 نشاندهنده تکثیر ژن Tax بود(شکل 1).
پس از مرحله کلونینگ، بر روی پلاسمید نوترکیب آزمایش PCR و الکتروفورز انجام شد. هم چنین پلاسمید نوترکیب تعیین سکانس شد و کلونینگ تایید گردید.
در نهایت آزمایش Real - Time PCR بر روی رقتهای مختلف پلاسمید نوترکیب انجام شد. حساسیت (Analytical Sensitivity) در سه رقت از استاندارد (copy/µL103-copy/µL101) در سه روز مختلف به صورت تکرار 8 تایی آزمایش انجام شد که قادر به تشخیص copy/µL101 ذره ویروسی بود. خطی بودن و کارآیی آمپلیفیکاسیون دارای شیب خط ، برابر 3/3 و2R آن 98/0> بود (نمودار 1). جهت بررسی اختصاصی بودن واکنشها از منحنی ذوب استفاده شد که دمای 89 درجه سانتیگراد نشان داد واکنش آزمایش اختصاصی میباشد(نمودار 2).

شکل 1: مشاهده باند bp 890 نشاندهنده حضور ژن Tax در نمونهها در کنار مارکر bp 100

نمودار 1: نمودار منحنی استاندارد Real Time PCR با استفاده از رقتهای مختلف پلاسمید نوترکیب(copy/µL 109- copy/µL 101)

نمودار 2: نمودار منحنی استاندارد Real Time PCR با استفاده از رقتهای مختلف پلاسمید نوترکیب (copy/µL109-copy/µL101)
بحث
در مقالات متعددی از سنجش لود ویروس به عنوان یک فاکتور پیشآگهی و پایش بیماران تحت درمان نام برده شده است(7، 6). چون پرووایرال لود یک فاکتور مهم در ایجاد و پیشرفت بیماریهای مرتبط با HTLV-1 است، نیاز به انجام یک آزمایش کمی احساس میشود. آیکو ماساکی و همکاران در مقاله خود بیان کردند که پرووایرال لود بالاتر در سلولهای تک هستهای خون محیطی به عنوان یک فاکتور خطر در ایجاد ATL میباشد.
هم چنین ارتباط مستقیم و چشمگیری بین پرووایرال لود در سلولهای تک هستهای خون محیطی و میزان بیان (Program Cell Death Protein) PD-1 و کاهش عملکرد Tax-CTL وجود دارد(8).
واترز و همکاران در مطالعه خود بیان کردند که آزمایش qPCR (Quantitative PCR) ولید شده، به عنوان یک آزمایش کارآمد که قادر به اندازهگیری پرووایرال لود باشد و هم چنین قابلیت تکرارپذیری داشته باشد، مورد نیاز است. از آن جایی که هنوز یک بیومارکر اختصاصی برای پیشبینی پیشرفت بیماری در افراد بدون علامت وجود ندارد و از طرفی میزان آنتیبادی اختصاصی علیه HTLV-1 با پرووایرال لود ویروس همبستگی دارد، میتوان از پرووایرال لود به عنوان روشی برای پیشبینی نتایج عفونت و پیشرفت بیماری استفاده نمود(9).
به طور روتین از روش الایزا برای غربالگری اهداکنندگان خون استفاده میشود و به کمک وسترن بلات نتایج آن تایید میگردد. آزمایش الایزا حساسیت بالا دارد ولی ممکن است اختصاصیت بالایی نداشته باشد و با آنتیژنهای دیگری واکنش متقاطع بدهد. وسترن بلات نیز یک روش سنجش ایمنی بر پایه آنتیبادی میباشد که به عنوان آزمایش تاییدی در کسانی که از نظر آنتیبادی با آزمایش الایزا مثبت بودهاند استفاده میشود. وسترن بلات و روشهای مبتنی بر سنجش آنتیبادی در بیماران با سرکوب یا ضعف سیستم ایمنی، در کسانی که در دوره پنجره هستند، در عفونتهای اخیر و در نوزادان روش مناسبی نمیباشد. در روش وسترن بلات گاهی جوابها نامشخص است که میزان این جوابها از 2/0 در مناطق غیر اندمیک تا 50% در مناطق اندمیک متغیر است. این جوابهای بدون پاسخ ممکن است نشاندهنده عفونت واقعی HTLV-1 ، مثبت کاذب و یا تغییرات سرمی باشد. پس برای رفع این مشکل نیاز به آزمایشهای مولکولی میباشد. روشهایی که بر اساس ازدیاد DNA است مثل PCR و Real Time PCR روشهای مناسبی هستند. مزیت روش qPCR آلودگی کمتر نسبت به PCR معمولی میباشد. هم چنین میتوان در هر مرحلهای از آزمایش نتیجه را مشاهده کرد و مانند PCR معمولی نیاز نیست که کل پروسه به اتمام برسد.
از طرفی نسبت به روشهای متداول کشت، سرعت بالاتر و قیمت مناسبتر دارد. روش Real Time به دو شکل میتواند انجام شود. یکی به روش سایبرگرین و دیگری روش .TaqMan prob مزیت روش سایبرگرین نسبت به پروب این است که روش سایبرگرین مقرون به صرفهتر است و هم چنین دردسرهای طراحی پروب را هم ندارد(10).
لی و همکارانش در مطالعه خود برای سنجش پرووایرال لود ویروس HTLV-1 از رده سلولی MT2 به عنوان استاندارد استفاده کردند در این مطالعه به دلیل عدم دسترسی به این سل لاین از روش کلونینگ استفاده شد. رسـم منحنی استاندارد با پلاسمید نوترکیب حاوی ژن Tax-1 نشان داد که این روش با شیب خط 3/3 و 99/0= 2R قابل مقایسه با سل لاین MT2جهت رسم منحنی استاندارد در Real Time PCR میباشد و نتایج آن مشابه نتایج لی و همکارانش بود. هم چنین دمای ذوب در آزمایش با پلاسمید نوترکیب 89 درجه سانتیگراد یعنـی نزدیـک بـا دمـای ذوب سـل لایـن MT2یعنــی 88 درجه سانتیگـراد بـود. دامنـه پـرووایـرال در ایـن مطالعـه
(copy/µL106-copy/µL101) ذره ویروسی بود.
نتیجهگیری
این آزمایش دارای دامنه مناسبی جهت تعیین پرووایرال لود از copy/µL106 تا 101(حد پایینتر و بالاتر تشخیصی) در هر واکنش پرووایرال لود HTLV-I بود و میتواند جهت بررسی رابطه بین بار پرو ویروس و بیماریزایی مورد استفاده قرار گیرد.
تشکر و قدردانی
این پژوهش حاصل پایاننامه کارشناسی ارشد مرکز تحقیقات مؤسسه عالی آموزشی و پژوهشی طب انتقال خون میباشد. بدین وسیله از مؤسسه به جهت حمایت مالی تشکر میگردد.
نوع مطالعه: پژوهشي |
موضوع مقاله:
ويروس شناسي
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |






