جلد 16، شماره 2 - ( تابستان 1398 )
جلد 16 شماره 2 صفحات 102-91 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Mostakhdemin Hosseini M, Samiee S, Shaiegan M, Mohammadi S, Jalaiekhoo H, Tabatabiepanah P et al . Evaluation of platelet antigens and antibodies in patients with platelet refractoriness. bloodj 2019; 16 (2) :91-102
URL: http://bloodjournal.ir/article-1-1233-fa.html
URL: http://bloodjournal.ir/article-1-1233-fa.html
مستخدمین حسینی محبوبه، سمیعی شهرام، شایگان مژگان، محمدی سعید، جلایی خو حسن، طباطبایی پناه پردیس و همکاران.. بررسی آنتی ژنها وآنتی بادیهای پلاکتی در بیماران مبتلا به مقاومت پلاکتی. فصلنامه پژوهشی خون. 1398; 16 (2) :91-102
محبوبه مستخدمین حسینی 

 ، شهرام سمیعی
، شهرام سمیعی 

 ، مژگان شایگان*
، مژگان شایگان* 

 ، سعید محمدی
، سعید محمدی 

 ، حسن جلایی خو
، حسن جلایی خو 
 ، پردیس طباطبایی پناه
، پردیس طباطبایی پناه 
 ، سارا مدرسی
، سارا مدرسی 



 ، شهرام سمیعی
، شهرام سمیعی 

 ، مژگان شایگان*
، مژگان شایگان* 

 ، سعید محمدی
، سعید محمدی 

 ، حسن جلایی خو
، حسن جلایی خو 
 ، پردیس طباطبایی پناه
، پردیس طباطبایی پناه 
 ، سارا مدرسی
، سارا مدرسی 

دانشیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون
متن کامل [PDF 630 kb]
(1867 دریافت)
| چکیده (HTML) (4731 مشاهده)
مقدمه
مقاومت پلاکتی (Platelet refractoriness, PR) عبارت است از عدم افزایش تعداد پلاکت تا حد مطلوب در صورتی که تزریق پلاکت بیش از دو بار انجام شده است، که با محاسبه(Corrected Count Increment) CCI یک ساعته و24 ساعته پس از تزریق پلاکت، میتوان به مقاومت پلاکتی پی برد(2، 1). ایجاد مقاومت پلاکتی و افزایش نیافتن تعداد پلاکت، باعث خونریزی شدید و احتمالاً مرگ ناشی از خونریزی میشود(3). علل ایجاد مقاومت پلاکتی، ایمیون وغیر ایمیون میباشد. از علل غیر ایمیون میتوان به تب، عفونت، اسپلنومگالی، انعقاد منتشر درون عروقی و مصرف برخی داروها نظیر هپارین اشاره کرد. در مقاومت پلاکتی ایجاد شده به یکی از دلایل فوق، میزانCCI در 24-18 ساعت بعد از تزریق کمتر، ازpt/μL 4500 خواهد شد. در مقاومت پلاکتی ایمیون،آلوآنتیبادی علیه HLA (Human Leukocyte Antigens) ایجاد میگردد و در این موارد CCI یک ساعته کمتر از pt/μL 7500 میشود(5، 4). در بیماران مبتلا به مقاومت پلاکتی که آلوآنتیبادی دارند باید، پلاکت سازگار با سرم بیمار نظیر HLA, HPA (Human platelet Antigen) انتخاب شود. گلیکوپروتئینهای غشاء پلاکتی، نقش حیاتی در فعالیتهای انعقادی پلاکت ایفا میکنند. این گلیکوپروتئینها به عنوان آلوآنتیژن، اتو آنتیژن و یا آنتیژنهای هدف برای آنتیبادیهای مختلف نیز عمل میکنند. مثل آلوآنتیژنهای اختصاصی پلاکت HPA که حاصل پلیمورفیسم در گلیکوپروتئینهای غشاء پلاکت میباشند(6). ابتدا تصور میشد که این آنتیژنها به طور اختصاصی روی پلاکتها و مگاکاریوسیتها قرار دارند اما اکنون مشخص شده که بسیاری از آنها محدوده توزیع وسیعتری دارند و روی مولکولهای چسبنده بین سلولها و ماتریکس، سلولهای T فعال و سلولهای آندوتلیال هم دیده میشوند(8، 7). آلوایمیونیزاسیون علیه آنتیژنهای اختصاصی پلاکت میتواند در افراد سالم به دنبال حاملگی، تزریق خون، پیوند و نسبت به آنتیژنهایی که گیرنده فاقد آنها هستند، رخ دهد و بر خلاف آنتیبادیهای ضد آنتیژنهای گلبولهای قرمز به صورت طبیعی ساخته نمیشوند(9). پنج عارضه به دلیل آلوایمیونیزاسیون و به دنبال ناسازگاری آنتیژنهای پلاکتی روی میدهند نظیر ترومبوسیتوپنی آلوایمیون نــوزادان( NAITP ، Neonatal Allo Immune
Thrombocytopenia)، پورپورای پس از تزریق (PTP و Post Transfusion Purpura)، مقاومت پلاکتی(PTR ، Platelet Transfusion Refractoriness)، ترومبوسیتوپنی آلوایمیون(PAT ، Passive Alloimmune Thrombocytopenia)، ترمبوسیتوپنی آلوایمیون بعد از پیوند TAT (Tranplantation-Associated Alloimmune)
(10). آنتیژنهای پلاکتی جزو مولکولهای سازگاری نسجی فرعی(MHC Minor Histocompatibility Complex) هم شمرده شدهاند و در بروز واکنش GVHD حاد(Graft Versus Host Disease) بعد از پیوند سلولهای بنیادی خونساز نیز نقش دارند(11). مقاومت پلاکتی اصولاً در افرادی که مصرف دائمی پلاکت، به صورت درمانی و یا به صورت پیشگیری دارند، به وجود میآید که در 60-20 درصد موارد به دلیل حضور آنتیبادی علیه آنتیژنهای HLA-І (A,B)میباشد. در 10% از این افراد همزمان آنتیبادی علیه آنتیژنهای پلاکتی هم قابل تشخیص است(12). در مطالعهای که در سال 1383در سازمان انتقال خون ایران انجام شد، آنتیبادیهای پلاکتی با یکی از دستورالعملهای موجود به روش فلوسیتومتری(با حذف HLA-I) در بیماران مبتلا به بدخیمیهای خونی، آنمی آپلاستیک و IPT (Immune Thrombocytopenic Purpura) مورد بررسی قرار گرفتهاند. نتایج این مطالعه نشان داد که 7/53% از این بیماران دارای آنتیبادی علیه آنتیژنهای HLA-I و 9/43% دارای آنتیبادی ضد آنتیژنهای پلاکتی بودند و 7/31% هر دو نوع آنتیبادی را داشتند[WU3] (11).
مهمترین آلوآنتیژنهای پلاکتی درگیر در مقاومت پلاکتی، -2b ، -5b ، HPA-1a قید شدهاند(12). با توجه به اطلاعاتی که در زمینه مولکولی در مورد سیستم HPA شناخته شده و لزوم تشخیص سریع و صحیح آلوایمیونیزاسیون پلاکتی و هم چنین نیاز به داشتن پلاکتهای سازگار از نظر آنتیژنهای پلاکتی برای درمان مؤثر بیماران و در نتیجه آن نیاز به تعیین آلوآنتیژنهای پلاکتی در دهنده و گیرنده پلاکت، بررسی آنتیژنها و آنتیبادیهای پلاکتی دارای اهمیت هستند(14، 13). هم چنین طی یک مطالعه آنتیژنهای پلاکتی به روش مولکولی نیز برای اهداکنندگان خون در استان تهران بررسی گردید(15). لذا با توجه به تجارب عملی برای روش مولکولی، در مطالعه حاضر هم زمان آنتیژنهای پلاکتی (به روش مولکولی) و آنتیبادیهای پلاکتی(به روش فلوسیتومتری) و بررسی آنتیبادیهای ضدHLA-I (به روش panel reactive antibody) در بیماران مبتلا به مقاومت پلاکتی بررسی شدند.
مواد و روشها
مطالعه انجام شده از نوع توصیفی بود. 49 فرد بیمار دریافتکننده مکرر فرآورده حاوی پلاکت با CCI یک ساعته کمتر از pt/μL 7500 با تشخیص مقاومت ایمیون و فاقد سابقه تب، مصرف هپارین و آمفوتریسین B، خونریزی منتشر، عفونتهای مختلف، بزرگی کبد و طحال و پیوند سلولهای بنیادی خونساز، از بیمارستان شریعتی و بیمارستان 501 ارتش پس از دریافت رضایتنامه با کد(TMI.REC.1396.001) در فاصله زمانی بهمن 1395 الی بهمن 1396 وارد مطالعه شدند. بیماریهای زمینهای در بیماران وارد شده به این مطالعه لوکمیای حاد لنفوییدی(6/32%) و میلوییدی(41%)، مالتیپل میلوما(4/24%) و 1 نفر نوروبلاستوما(2%) بودند. پس از نمونهگیری از اهداکنندگان، لولهها در دمای محیط سریعاً به آزمایشگاه منتقل شدند. در فاصله 3 ساعت از نمونهگیری، بافیکوت حاوی گلبولهای سفید آن جدا شده و استخراج DNA با استفاده از ستون فیلتردار سیلیکایی در کیت کیاژن بر اساس لیز سلولها و آزاد شدن ژنوم از پروتئینها DNA به سیلیکا ژل غشاء ستون کیت کیاژن متصل میشود. سپس جذب نوری اسید نوکلئیک در دو طول موج 260 و 280 نانومتری اندازهگیری شد[WU4] [WU5] (16). بخش سرمی نمونه نیز در دمای ˚C70- تا زمان بررسی آنتیبادیها به روش فلوسیتومتری در چند میکروتیوب تقسیم و نگهداری شد.
بررسی مولکولی آنتیژنهای پلاکتی:
برای تعیین ژنوتیپ آللهای a و b آنتیژنهای HPA-1/-2/-3/-4/-5/15 از روش PCR-SSP استفاده گردید. برای هر آلل لوله جداگانه و در نهایت برای هر نمونه DNA ، واکنش در 12 لوله جداگانه انجام شد. توالی آغازگرها(محصول بایونیر کره) که از طریق شرکت تکاپو زیست تهیه شدند در جدول آمده است(جدول 1). حجم کلی محتـوای واکنـش20 میکرولیتر(شامل 4 میکرولیتر نمونه DNA ، 3/10 میکرولیتر از مخلوط واکنش و 7/5 میکرولیتر از مخلوط آغازگرها) در هر لوله بود. مخلوط آغازگرها خود شامل یک میکرولیتر از هر یک از آغازگر مخصوص آلل(allele specific primer)، آغازگر مشترک دو آلل(common primer)، یک جفت آغازگر بتااکتین(به عنوان کنترل داخلی و کنترل مثبت واکنش) PCR و7/3 میکرولیتر dH2O بود که مقدار مصرفی هر کدام بسته به غلظت نهایی مورد نظر برای آن آغازگر داشت.
مقـدار آنزیـم DNA تک پلیمراز(Units 1000 ، رُوش) بـرای هـر واکنش 3/0 میکرولیتر بود که به مخلوط واکنش اضافه شد. مخلوط واکنش شامل: 10 میکرولیتر از 2x Master Mixبرای هر لوله واکنش میباشد. غلظت نهایی Mgcl2 در همه واکنشها 5/1 میلیمول در نظر گرفته شد. واکنش PCR در ترموسایکلر بیوراد(TC135) انجام گرفت. چرخه انجام PCR برای تکثیر به شرح زیر بود:
پس از یک دقیقه انکوباسیون در دمای °C96 برای فعال شدن، چرخه آمپلیفیکاسیون در 3 مرحله در نظر گرفته شد. مرحله اول 5 چرخه شامل: °C96 به مدت 25 ثانیه، °C68 به مدت 45 ثانیه، °C 72 به مدت 30 ثانیه، مرحله دوم 20 چرخه شامل: °C96 به مدت 25 ثانیه، °C61 به مدت 45 ثانیه، °C 72 به مدت 30 ثانیه و مرحله سوم 15چرخه شامل: °C96 به مدت 45 ثانیه، °C51 به مدت 45 ثانیه، °C 72 به مدت 30 ثانیه بود. واکنش در پایان با مرحله Elongation شامل 1 چرخه در °C 72 به مدت 3 دقیقه، تکمیل شد. پس از انجام مراحل تکثیر، برای الکتروفورز در روی ژل آگاروز 2%، محصولات PCR به نسبت 1 به 4 با ماده رنگی سایبرگرین مخلوط
جدول 1: توالی آغازگرها، اندازه، غلظت نهایی و اندازه مورد انتظار برای محصولات تکثیری در هر آنتیژن

جدول 3: فراوانی مطلق و نسبی ژنوتیپی و فراوانی آللی(ژنی) آنتیژنهای مختلف پلاکتی در بیماران مورد مطالعه
HPA-1a/1b HPA-2a/2b HPA-3a/3b HPA-4a/4b HPA-5a/5b HPA-15a/15b S.M B-actin
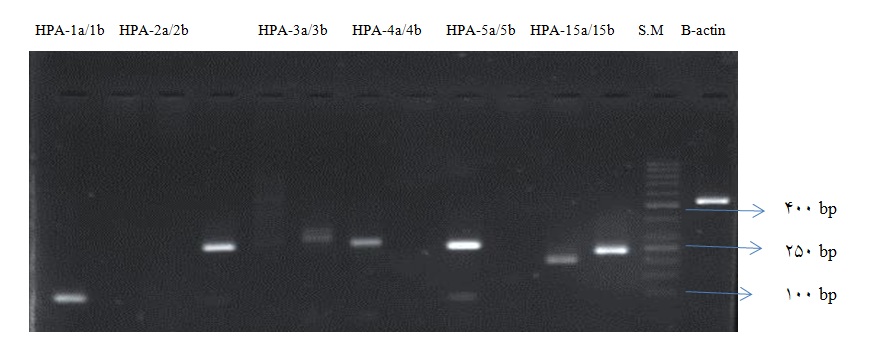
شکل 1: نتایج الکتروفورز محصول PCR مربوط به ژنهای مختلف HPAs : از سمت چپ به راست: ستون اول و دوم مربوط به آللهای HPA-1a/ 1b، ستونهای سوم و چهارم مربوط به آللهای HPA-2a/2b ، ستونهای 5 و 6 مربوط به آللهای HPA-3a/3b ، ستونهای 7 و 8 مربوط به آللهای HPA-4a/4b، ستونهای 9 و 10 مربوط به آللهای HPA-5a/5b و ستونهای 11 و12 مربوط به آللهای HPA-15a/15b، ستون اول از سمت چپ مربوط به بتااکتین(کنترل داخلی) و ستون دوم از چپ سایز مارکر bp 50 میباشند.
نتیجه قرائت به شرح زیر بود:
HPA-1a+/1b-، HPA-2a-/2b+، HPA-3a-/3b+ /HPA-4a+/4b- / HPA-5a+/5b-/ HPA-15a+/15b+
ژنوتیپ وی: HPA-1a/1a ، HPA-2a/2a ، HPA-3a/3b ، HPA-4a/4a ، HPA-5a/5a و HPA-15a/15 بود. نمونه دوم مربوط به یک آقا با شمارش پلاکتی یک ساعت بعد از تزریق 5000 میکرولیتر، با نتیجه فلوسیتومتری 48/11% مثبت برای آنتیبادیهای ضد HPA و PRA منفی برای آنتیبادیهای HLA و ژنوتیپ: HPA-1a/1b، HPA-2a/2b، HPA-3a/3b، HPA-4a/4a ، HPA-5a/5a و HPA-15a/15b بود. در کل 18 بیمار علیرغم نقص در CCI یک ساعته(ابتلا به مقاومت پلاکتی ایمیون) در این طرح فاقد هر گونه آنتیبادی ضد HLA و ضد HPA به روشهای به کار رفته، بودند.
یافتههای آزمایش PCR-SSP :
در الکتروفورز ژل برای HPA-1 برای دو نمونه، نتایج مناسبی حاصل نشد و محاسبات وفور آللهای a وb آن بر مبنای 47 نفر انجام گرفت. در سایر موارد نتایج برای 49 نفر کامل شدند. در این مطالعه هیچ یک از افراد آلل b برای -5 HPA-4, نداشتند. وفور آلل a برای آنتیژنهای HPA-1, -2, -3 بیشتر از آللb به دست آمد اما وفور HPA-15b از آلل HPA-15a در این مطالعه بیشتر شد (جدول 3)(شکل 1).
بحث
این مطالعه بر روی 49 بیمار مبتلا به مقاومت پلاکتی ایمیون انجام شد. وفور آللهای آنتیژنهای پلاکتی HPA-1a و HPA-1b به ترتیب 6/0 و 4/0، HPA-2a وHPA-2b به ترتیب47/0 و 53/0، HPA-3a و HPA-3b به ترتیب 75/0 و 25/0، HPA-4a دارای فراوانی ژنی 1 (یا 100%)، HPA-5a نیز دارای فراوانی ۱ (یا 100%) و HPA-15a و HPA-15b به ترتیب 31/0 و 69/0 بود. HPA-4b و HPA-5b در هیچ یک از افراد مشاهده نشد. فراوانترین میزان هموزیگوسیتی در بین افراد مورد بررسی مربوط به HPA-5a/5a و HPA-4a/4a با 100% و سپس HPA-3a/3a با وفور 1/55% بود. کمترین میزان هموزیگوسیتی مربوط به HPA-1a/1a (با وفور 5/8%) و HPA-2a/2a (با وفور 2/8%) است. بیشترین میزان هتروزیگوسیتی مربوط HPA-2a/1b (با وفور6/77%) و HPA-1a/1b (با وفور 5/57%) و کمترین میزان هموزیگوسیتی مربوط به HPA-3a/3b (با وفور 3/16%) است.
30 نفر(2/61%) از بیماران، آنتیبادی ضد HLA داشتند و 19 نفر فاقد این آنتیبادیها بودند. دو نفر(1/4%) دارای آنتیبادی ضد HPA بودند که یک نفر از آنها دارای آنتیبادی ضد HLA نیز بود. وفور گزارش شده برای آنتیبادیهای ضد HLA و ضد HPAدر بیماران مبتلا به مقاومت پلاکت به ترتیب60%-20% و 25%-8% میباشد که در بسیاری موارد با آنتیبادیهای ضد HLA همراهند (20، 12). در مطالعهای در سال 1383 در سازمان انتقال خون ایران، در مورد آنتیبادیها در بیماران مبتلا به اختلالات خونی مانند لوسمی حاد و آنمی آپلاستیک که به درمان با پلاکت پاسخ مناسب نداده بودند، مشخص شد وفور آنتیبادی ضد آنتیژنهای HLA-Iبرابر7/53% و وفور آنتیبادی ضد آنتیژنهای پلاکتی 9/43% بود که 7/31% افراد دارای هر دو نوع آنتیبادی بودند(11). در مطالعهای در مورد بررسی و شناسایی آنتیبادیهای ضد HPA در 204 بیمار مبتلا به مقاومت پلاکتی(به روش الایزا) در آلمان و چین، مشخص شد که 114 نفر (88/55%) آنها دارای این آنتیبادیها هستند و از این 114 نفر، تعداد 110 (5/96%) نفر فقط آنتیبادی ضد HLA، 2 نفر فقط آنتیبادی ضد پلاکتی و 2 نفر هر دو آنتیبادی را داشتند(21). وفور این آنتیبادیها در بیماران این مطالعه در محدوده مطالعههای مشابه قبلی قرار میگیرند.
در سرم 18 نفر از افراد مطالعه حاضر که CCI یک ساعته آنها کمتر از pt/μL7500 بود(بیانگر ابتلا به مقاومت پلاکتی ایمن)، آنتیبادی ضد HLA دیده نشد. علت این امر این است که آنتیبادی ضد HLA در این تحقیق با روش سمیت سلولی وابسته به کمپلمان بررسی شدند. سمیت سلولی وابسته به کمپلمان از سال 1960 و تا سالها بعد به عنوان معیار استاندارد برای بررسی آنتیبادیهای ضد HLA به کار گرفته شد. اما این روش قادر به ردیابی برخی آنتیبادیهایی که از نظر بالینی مهم هستند، دارا نمیباشد(22).
هم چنین مطرح شده است گرچه سالها آنتیبادیها تنها روش حذف ایمونولوژیک پلاکتها شناخته شدند اما مطالعهها، حذف ایمونولوژیک پلاکت در غیاب آنتیبادیها را مطرح کردهاند.
تخریب پلاکتها در غیاب آنتیبادی به عوامل غیر ایمونولوژیک نسبت داده شده اما در برخی بیماران فاقد آنتیبادی، عوامل غیر ایمونولوژیک نیز در تخریب پلاکتها مطرح نیستند و در این رابطه به نقش سلولهای TCD8+ در پاکسازی پلاکتها در غیاب آنتیبادی اشاره شدهاند و مطرح گردیده این مکانیسم در بیماران مقاومت پلاکتی نیز قابل استناد است(23).
فراوانی آنتیژنهای پلاکتی در اهداکنندگان خون در کشورهای مختلف از جمله در ایران بررسی شده است. وفور ژنی یا آللی آنتیژنها در اهداکنندگان خون در کشورهای مختلف شامل انگلستان، چین، ژاپن، بحرین، اسپانیا، فنلاند، اتریش، کره، آمریکا، عربستان، تایلند و هم چنین ایران در محدودههای زیر به دست آمدهاند: 99/0-
75/0 : HPA-1a، 25/0 -01/0 : HPA-1b، 96/0-54/0 :
HPA-2a ، 46/0-04/0 : HPA-2b،95/0-48/0:HPA-3a ، 52/0-05/0: HPA-3b، 1-93/0: HPA-4a، 07/0-01/0: HPA-4b ، 99/0-79/0: HPA-5a ، 14/0-01/0 : HPA-5b، 54/0-47/0: HPA-15a، 53/047/0: HPA-15b (15).
در بررسی وفور ژنی محاسبه شده برای بیماران در مطالعه حاضر با محدودههای وفور ژنهای پلاکتی در جمعیتهای مختلف افراد ظاهراً سالم، مشخص شد که فراوانی به دست آمده برای آلل a برای ژنهای HPA-1,-2,-15 کمتر از محدوده فوق است در حالی که وفور آلل b برای همین آنتیژنها بیشتر از محدوده فوق میباشد(شاید به علت این که در مطالعه ما بیماران بررسی شدهاند) و وفور آللی سایر آللها در مطالعه ما در محدوده مطالعههای قبلی است. وفور ژنوتیپی و آللی بین این بیماران(ایرانی) با اهداکنندگان خون(ایرانی) در مطالعه مدنی و همکاران در جدول مقایسه شده است(16)(جدول 4).
مقایسه آماری وفور ژنوتیپی برای HPA-1b/1b ، HPA-1a/1b ، HPA-1a/1a ، HPA-2a/2b ، HPA-3a/3b و HPA-3b/3b و هم چنین وفور آللهای a وb برای آنتیژنهای HPA-1, -3 در بیماران مورد مطالعه با اهداکنندگان خون هم نژاد ایرانی تفاوت معناداری دارند(0001/0 p<)(16). در بیماران، هموزیگوسیتی برای آلل b مربوط به HPA-1,-2 مشاهده شد در حالی که اهداکنندگان فاقد آن هستند. این تفاوت وقوع احتمالی در بیماران طی دریافت پلاکت از اهداکنندگان خون هتروزیگوت ab برای این آنتیژنها را مطرح میکند. اثبات این امر احتیاج به تعیین نوع آنتیبادیهای پلاکتی در بیماران دارد. در جمعیتهای مختلف وفور آلل b برای HPA-15 در مقایسه با آلل این آنتیژن بیشتر است که در مطالعه ما نیز چنین بود(16). اما وفور ژنوتیپی و آللی برای سایر آنتیژنها تفاوت معناداری بین این دو جمعیت نشان نداد (ارزش p در محدوده 85/0-1/0). مقایسه وفور آللی و ژنوتیپی بیماران این مطالعه با تحقیقی که بر روی بیماران انکوهماتولوژیک با ترومبوسیتوپنی کمتر از 20000 میکرولیتر و مصرفکننده فرآورده متراکم پلاکتی در برزیل انجام شده نیز نشان داد که فقط در آللهای هموزیگوتa برای HPA-3, -15 و b برای HPA-1 با هم شبیهند و وفور ژنوتیپی و آللی سایر آنتیژنهای پلاکتی بین این دو گروه بیماران تفاوت معناداری ندارند که شاید به دلایل تفاوت نژادی باشد(24). در مطالعه بررسی HPAs در 150 بیمار (65 مرد و 85 زن) مبتلا به بدخیمیهای خونی همراه با ترومبوسیتوپنی در محدوده سنی 18 الی 30 سال در برزیل به روش SSP-PCR وفور آللی به شرح زیر حاصل شد:
HPA-1a: 0.837; HPA-1b: 0.163; HPA-2a: 0.830; HPA-2b: 0.170; HPA-3a: 0.700; HPA-3b: 0.300; HPA-4a: 1; HPA-4b: 0; HPA-5a: 0.887; HPA-5b: 0.113; HPA-15a: 0.457 و HPA-15b: 0.543
که با وفور آللهای HPA-4/-5/-15 در مطالعه ما شباهت وجود داشت(25).
نتیجهگیری
اطلاعات حاصل از مطالعه ما نشان داد که فراوانی آلل a برایHPA-1/ -3/ -4 /-5 و آلل b برایHPA-2/ -15 در جمعیت مورد مطالعه بیشتر بود. وفور آللی و ژنوتیپی بین گروه بیمار مورد مطالعه و جمعیت اهداکنندگان ایرانی میتواند توضیحدهنده وقوع مقاومت پلاکتی در آنها باشد. گرچه اظهار نظر دقیق در این مورد نیاز به بررسی بیشتر اهداکنندگانی دارد که فرآوردههای خون و پلاکت آنها به این گروه بیماران تزریق شده است. تعیین ژنوتیپ آنتیژنهای پلاکتی راهکار عملی مناسبی برای بررسی علت آلوایمونیزاسیون در بیماران مبتلا به مقاومت پلاکتی و سایر موارد ترومبوسیتوپنی و کمک به مدیریت درمان آنها است و امکان انتخاب اهداکننده سازگار از نظر این آنتیژنها را برای بیماران مربوطه مقدور میسازد.
تشکر و قدردانی
این مقاله بخشی از یافتههای طرح مصوب در شورای پژوهش مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ایران(796/خ مورخ 27 خرداد 1396) با تقبل پرداخت همه هزینهها توسط این مرکز میباشد که به عنوان پایاننامه کارشناسی ارشد در دانشگاه آزاد اسلامی واحد شرق ارائه شد. نویسندگان مقاله به این وسیله از خانمها: زهرا عطایی، مونا تجریشی، الهام سلطانآبادی، شیرین عبدیزاده، دکتر مهین نیکوگفتار و آقایان دکتر محمد نوروزی عقیده و مجتبی شاکرمی که در جمعآوری نمونههای مختلف برای راهاندازی و انجام آزمایشها کمک کردهاند، تشکر مینمایند.
متن کامل: (6169 مشاهده)
آنتی ژنها وآنتی بادیهای پلاکتی در بیماران مبتلا به مقاومت پلاکتی
محبوبه مستخدمین حسینی1، شهرام سمیعی2، مژگان شایگان3، سعید محمدی4، حسن جلاییخو5،
پردیس طباطباییپناه6، سارا مدرسی7
چکیده
سابقه و هدف
مقاومت پلاکتی ایمیون از عوارض انتقال خون در بیماران با تزریق مکرر پلاکت میباشد. در این عارضه آنتیبادی بر علیه آنتیژنهای سطحی پلاکت شامل آنتیژن های اختصاصی و آنتیژنهای سازگاری بافتی ایجاد میشوند که میتوانند باعث تخریب پلاکتهای تزریق شده به وسیله سلولهای بیگانه خوار و ماکروفاژ گردند. در مطالعه حاضر، آنتیژنها و آنتیبادیهای ضد آنتیژنهای اختصاصی و آنتیبادیهای ضد HLA-I در بیماران مبتلا به مقاومت پلاکتی بررسی شد[WU1] .
مواد و روشها
در این مطالعه توصیفی، بررسی هم زمان آنتیژنها HPA-1/-2/-3-4-5-15 (به روش مولکولی PCR-SSP)، غربالگری حضور آنتیبادیهای پلاکتی(به روش فلوسیتومتری) و بررسی آنتیبادیهای ضد HLA-I به روش پانل راکتیو آنتیبادی در سرم 49 بیمار مبتلا به مقاومت پلاکتی انجام شدند[WU2] . یافتهها توسط نرمافزار فلومکس و نرمافزار محاسبهگر خودکار هاردی وینبرگ تجزیه، تحلیل شدند.
یافتهها
از 49 بیمار مبتلا به مقاومت پلاکتی، 18 بیمار زن و31 بیمار مرد بودند. شمارش پلاکتی در زنان 3202 ± 6457 در محدوده(10000-1000سلول در میکرولیتر) با شمارش پلاکتی در مردان 2518 ± 7283 در محدوده (10000-3000) اختلاف معنادار نداشت. هیچ موردی ازHPA-4b ، HPA -5b در این مطالعه دیده نشد. آنتیبادیهای ضد HLA در2/61% و آنتیبادیهای ضد HPA در 4% بیماران مورد بررسی مشاهده شدند.
نتیجه گیری
اطلاعات حاصل از مطالعه حاضر نشان داد که فراوانی آلل a برای HPA-1/ -3/ -4 /-5 و آلل b برای HPA-2/ -15 در جمعیت مورد مطالعه بیشتر بود. وفور آللی و ژنوتیپی بین گروه بیمار مورد مطالعه و جمعیت اهداکنندگان ایرانی میتواند توضیح دهنده وقوع مقاومت پلاکتی در آنها باشد.
کلمات کلیدی: پلاکتها، فلوسیتومتری، آنتیبادیها، آنتیژنها
تاریخ دریافت: 1 /8/97
تاریخ پذیرش: 22/2/98
1- دانشجوی کارشناسی ارشد زیستشناسی سلولی و مولکولی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
2- کارشناس ارشد بیوشیمی ـ مربی مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
3- مؤلف مسئول: PhD ایمونولوژی ـ دانشیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
4- PhD هماتولوژی ـ مرکز تحقیقات هماتولوژی، انکولوژی و پیوند سلولهای بنیادی ـ بیمارستان شریعتی دانشگاه علوم پزشکی تهران ـ تهران ـ ایران
5- فوق تخصص خون و انکولوژی ـ دانشکده پزشکی دانشگاه علوم پزشکی ارتش ـ تهران ـ ایران
6- دکترای زیستشناسی سلولی و مولکولی ـ استادیار دانشگاه آزاد اسلامی ـ واحد تهران شرق ـ تهران ـ ایران
7- پزشک عمومی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون و اداره کل انتقال خون تهران ـ تهران ـ ایران
محبوبه مستخدمین حسینی1، شهرام سمیعی2، مژگان شایگان3، سعید محمدی4، حسن جلاییخو5،
پردیس طباطباییپناه6، سارا مدرسی7
چکیده
سابقه و هدف
مقاومت پلاکتی ایمیون از عوارض انتقال خون در بیماران با تزریق مکرر پلاکت میباشد. در این عارضه آنتیبادی بر علیه آنتیژنهای سطحی پلاکت شامل آنتیژن های اختصاصی و آنتیژنهای سازگاری بافتی ایجاد میشوند که میتوانند باعث تخریب پلاکتهای تزریق شده به وسیله سلولهای بیگانه خوار و ماکروفاژ گردند. در مطالعه حاضر، آنتیژنها و آنتیبادیهای ضد آنتیژنهای اختصاصی و آنتیبادیهای ضد HLA-I در بیماران مبتلا به مقاومت پلاکتی بررسی شد[WU1] .
مواد و روشها
در این مطالعه توصیفی، بررسی هم زمان آنتیژنها HPA-1/-2/-3-4-5-15 (به روش مولکولی PCR-SSP)، غربالگری حضور آنتیبادیهای پلاکتی(به روش فلوسیتومتری) و بررسی آنتیبادیهای ضد HLA-I به روش پانل راکتیو آنتیبادی در سرم 49 بیمار مبتلا به مقاومت پلاکتی انجام شدند[WU2] . یافتهها توسط نرمافزار فلومکس و نرمافزار محاسبهگر خودکار هاردی وینبرگ تجزیه، تحلیل شدند.
یافتهها
از 49 بیمار مبتلا به مقاومت پلاکتی، 18 بیمار زن و31 بیمار مرد بودند. شمارش پلاکتی در زنان 3202 ± 6457 در محدوده(10000-1000سلول در میکرولیتر) با شمارش پلاکتی در مردان 2518 ± 7283 در محدوده (10000-3000) اختلاف معنادار نداشت. هیچ موردی ازHPA-4b ، HPA -5b در این مطالعه دیده نشد. آنتیبادیهای ضد HLA در2/61% و آنتیبادیهای ضد HPA در 4% بیماران مورد بررسی مشاهده شدند.
نتیجه گیری
اطلاعات حاصل از مطالعه حاضر نشان داد که فراوانی آلل a برای HPA-1/ -3/ -4 /-5 و آلل b برای HPA-2/ -15 در جمعیت مورد مطالعه بیشتر بود. وفور آللی و ژنوتیپی بین گروه بیمار مورد مطالعه و جمعیت اهداکنندگان ایرانی میتواند توضیح دهنده وقوع مقاومت پلاکتی در آنها باشد.
کلمات کلیدی: پلاکتها، فلوسیتومتری، آنتیبادیها، آنتیژنها
تاریخ دریافت: 1 /8/97
تاریخ پذیرش: 22/2/98
1- دانشجوی کارشناسی ارشد زیستشناسی سلولی و مولکولی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
2- کارشناس ارشد بیوشیمی ـ مربی مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
3- مؤلف مسئول: PhD ایمونولوژی ـ دانشیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
4- PhD هماتولوژی ـ مرکز تحقیقات هماتولوژی، انکولوژی و پیوند سلولهای بنیادی ـ بیمارستان شریعتی دانشگاه علوم پزشکی تهران ـ تهران ـ ایران
5- فوق تخصص خون و انکولوژی ـ دانشکده پزشکی دانشگاه علوم پزشکی ارتش ـ تهران ـ ایران
6- دکترای زیستشناسی سلولی و مولکولی ـ استادیار دانشگاه آزاد اسلامی ـ واحد تهران شرق ـ تهران ـ ایران
7- پزشک عمومی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون و اداره کل انتقال خون تهران ـ تهران ـ ایران
مقدمه
مقاومت پلاکتی (Platelet refractoriness, PR) عبارت است از عدم افزایش تعداد پلاکت تا حد مطلوب در صورتی که تزریق پلاکت بیش از دو بار انجام شده است، که با محاسبه(Corrected Count Increment) CCI یک ساعته و24 ساعته پس از تزریق پلاکت، میتوان به مقاومت پلاکتی پی برد(2، 1). ایجاد مقاومت پلاکتی و افزایش نیافتن تعداد پلاکت، باعث خونریزی شدید و احتمالاً مرگ ناشی از خونریزی میشود(3). علل ایجاد مقاومت پلاکتی، ایمیون وغیر ایمیون میباشد. از علل غیر ایمیون میتوان به تب، عفونت، اسپلنومگالی، انعقاد منتشر درون عروقی و مصرف برخی داروها نظیر هپارین اشاره کرد. در مقاومت پلاکتی ایجاد شده به یکی از دلایل فوق، میزانCCI در 24-18 ساعت بعد از تزریق کمتر، ازpt/μL 4500 خواهد شد. در مقاومت پلاکتی ایمیون،آلوآنتیبادی علیه HLA (Human Leukocyte Antigens) ایجاد میگردد و در این موارد CCI یک ساعته کمتر از pt/μL 7500 میشود(5، 4). در بیماران مبتلا به مقاومت پلاکتی که آلوآنتیبادی دارند باید، پلاکت سازگار با سرم بیمار نظیر HLA, HPA (Human platelet Antigen) انتخاب شود. گلیکوپروتئینهای غشاء پلاکتی، نقش حیاتی در فعالیتهای انعقادی پلاکت ایفا میکنند. این گلیکوپروتئینها به عنوان آلوآنتیژن، اتو آنتیژن و یا آنتیژنهای هدف برای آنتیبادیهای مختلف نیز عمل میکنند. مثل آلوآنتیژنهای اختصاصی پلاکت HPA که حاصل پلیمورفیسم در گلیکوپروتئینهای غشاء پلاکت میباشند(6). ابتدا تصور میشد که این آنتیژنها به طور اختصاصی روی پلاکتها و مگاکاریوسیتها قرار دارند اما اکنون مشخص شده که بسیاری از آنها محدوده توزیع وسیعتری دارند و روی مولکولهای چسبنده بین سلولها و ماتریکس، سلولهای T فعال و سلولهای آندوتلیال هم دیده میشوند(8، 7). آلوایمیونیزاسیون علیه آنتیژنهای اختصاصی پلاکت میتواند در افراد سالم به دنبال حاملگی، تزریق خون، پیوند و نسبت به آنتیژنهایی که گیرنده فاقد آنها هستند، رخ دهد و بر خلاف آنتیبادیهای ضد آنتیژنهای گلبولهای قرمز به صورت طبیعی ساخته نمیشوند(9). پنج عارضه به دلیل آلوایمیونیزاسیون و به دنبال ناسازگاری آنتیژنهای پلاکتی روی میدهند نظیر ترومبوسیتوپنی آلوایمیون نــوزادان( NAITP ، Neonatal Allo Immune
Thrombocytopenia)، پورپورای پس از تزریق (PTP و Post Transfusion Purpura)، مقاومت پلاکتی(PTR ، Platelet Transfusion Refractoriness)، ترومبوسیتوپنی آلوایمیون(PAT ، Passive Alloimmune Thrombocytopenia)، ترمبوسیتوپنی آلوایمیون بعد از پیوند TAT (Tranplantation-Associated Alloimmune)
(10). آنتیژنهای پلاکتی جزو مولکولهای سازگاری نسجی فرعی(MHC Minor Histocompatibility Complex) هم شمرده شدهاند و در بروز واکنش GVHD حاد(Graft Versus Host Disease) بعد از پیوند سلولهای بنیادی خونساز نیز نقش دارند(11). مقاومت پلاکتی اصولاً در افرادی که مصرف دائمی پلاکت، به صورت درمانی و یا به صورت پیشگیری دارند، به وجود میآید که در 60-20 درصد موارد به دلیل حضور آنتیبادی علیه آنتیژنهای HLA-І (A,B)میباشد. در 10% از این افراد همزمان آنتیبادی علیه آنتیژنهای پلاکتی هم قابل تشخیص است(12). در مطالعهای که در سال 1383در سازمان انتقال خون ایران انجام شد، آنتیبادیهای پلاکتی با یکی از دستورالعملهای موجود به روش فلوسیتومتری(با حذف HLA-I) در بیماران مبتلا به بدخیمیهای خونی، آنمی آپلاستیک و IPT (Immune Thrombocytopenic Purpura) مورد بررسی قرار گرفتهاند. نتایج این مطالعه نشان داد که 7/53% از این بیماران دارای آنتیبادی علیه آنتیژنهای HLA-I و 9/43% دارای آنتیبادی ضد آنتیژنهای پلاکتی بودند و 7/31% هر دو نوع آنتیبادی را داشتند[WU3] (11).
مهمترین آلوآنتیژنهای پلاکتی درگیر در مقاومت پلاکتی، -2b ، -5b ، HPA-1a قید شدهاند(12). با توجه به اطلاعاتی که در زمینه مولکولی در مورد سیستم HPA شناخته شده و لزوم تشخیص سریع و صحیح آلوایمیونیزاسیون پلاکتی و هم چنین نیاز به داشتن پلاکتهای سازگار از نظر آنتیژنهای پلاکتی برای درمان مؤثر بیماران و در نتیجه آن نیاز به تعیین آلوآنتیژنهای پلاکتی در دهنده و گیرنده پلاکت، بررسی آنتیژنها و آنتیبادیهای پلاکتی دارای اهمیت هستند(14، 13). هم چنین طی یک مطالعه آنتیژنهای پلاکتی به روش مولکولی نیز برای اهداکنندگان خون در استان تهران بررسی گردید(15). لذا با توجه به تجارب عملی برای روش مولکولی، در مطالعه حاضر هم زمان آنتیژنهای پلاکتی (به روش مولکولی) و آنتیبادیهای پلاکتی(به روش فلوسیتومتری) و بررسی آنتیبادیهای ضدHLA-I (به روش panel reactive antibody) در بیماران مبتلا به مقاومت پلاکتی بررسی شدند.
مواد و روشها
مطالعه انجام شده از نوع توصیفی بود. 49 فرد بیمار دریافتکننده مکرر فرآورده حاوی پلاکت با CCI یک ساعته کمتر از pt/μL 7500 با تشخیص مقاومت ایمیون و فاقد سابقه تب، مصرف هپارین و آمفوتریسین B، خونریزی منتشر، عفونتهای مختلف، بزرگی کبد و طحال و پیوند سلولهای بنیادی خونساز، از بیمارستان شریعتی و بیمارستان 501 ارتش پس از دریافت رضایتنامه با کد(TMI.REC.1396.001) در فاصله زمانی بهمن 1395 الی بهمن 1396 وارد مطالعه شدند. بیماریهای زمینهای در بیماران وارد شده به این مطالعه لوکمیای حاد لنفوییدی(6/32%) و میلوییدی(41%)، مالتیپل میلوما(4/24%) و 1 نفر نوروبلاستوما(2%) بودند. پس از نمونهگیری از اهداکنندگان، لولهها در دمای محیط سریعاً به آزمایشگاه منتقل شدند. در فاصله 3 ساعت از نمونهگیری، بافیکوت حاوی گلبولهای سفید آن جدا شده و استخراج DNA با استفاده از ستون فیلتردار سیلیکایی در کیت کیاژن بر اساس لیز سلولها و آزاد شدن ژنوم از پروتئینها DNA به سیلیکا ژل غشاء ستون کیت کیاژن متصل میشود. سپس جذب نوری اسید نوکلئیک در دو طول موج 260 و 280 نانومتری اندازهگیری شد[WU4] [WU5] (16). بخش سرمی نمونه نیز در دمای ˚C70- تا زمان بررسی آنتیبادیها به روش فلوسیتومتری در چند میکروتیوب تقسیم و نگهداری شد.
بررسی مولکولی آنتیژنهای پلاکتی:
برای تعیین ژنوتیپ آللهای a و b آنتیژنهای HPA-1/-2/-3/-4/-5/15 از روش PCR-SSP استفاده گردید. برای هر آلل لوله جداگانه و در نهایت برای هر نمونه DNA ، واکنش در 12 لوله جداگانه انجام شد. توالی آغازگرها(محصول بایونیر کره) که از طریق شرکت تکاپو زیست تهیه شدند در جدول آمده است(جدول 1). حجم کلی محتـوای واکنـش20 میکرولیتر(شامل 4 میکرولیتر نمونه DNA ، 3/10 میکرولیتر از مخلوط واکنش و 7/5 میکرولیتر از مخلوط آغازگرها) در هر لوله بود. مخلوط آغازگرها خود شامل یک میکرولیتر از هر یک از آغازگر مخصوص آلل(allele specific primer)، آغازگر مشترک دو آلل(common primer)، یک جفت آغازگر بتااکتین(به عنوان کنترل داخلی و کنترل مثبت واکنش) PCR و7/3 میکرولیتر dH2O بود که مقدار مصرفی هر کدام بسته به غلظت نهایی مورد نظر برای آن آغازگر داشت.
مقـدار آنزیـم DNA تک پلیمراز(Units 1000 ، رُوش) بـرای هـر واکنش 3/0 میکرولیتر بود که به مخلوط واکنش اضافه شد. مخلوط واکنش شامل: 10 میکرولیتر از 2x Master Mixبرای هر لوله واکنش میباشد. غلظت نهایی Mgcl2 در همه واکنشها 5/1 میلیمول در نظر گرفته شد. واکنش PCR در ترموسایکلر بیوراد(TC135) انجام گرفت. چرخه انجام PCR برای تکثیر به شرح زیر بود:
پس از یک دقیقه انکوباسیون در دمای °C96 برای فعال شدن، چرخه آمپلیفیکاسیون در 3 مرحله در نظر گرفته شد. مرحله اول 5 چرخه شامل: °C96 به مدت 25 ثانیه، °C68 به مدت 45 ثانیه، °C 72 به مدت 30 ثانیه، مرحله دوم 20 چرخه شامل: °C96 به مدت 25 ثانیه، °C61 به مدت 45 ثانیه، °C 72 به مدت 30 ثانیه و مرحله سوم 15چرخه شامل: °C96 به مدت 45 ثانیه، °C51 به مدت 45 ثانیه، °C 72 به مدت 30 ثانیه بود. واکنش در پایان با مرحله Elongation شامل 1 چرخه در °C 72 به مدت 3 دقیقه، تکمیل شد. پس از انجام مراحل تکثیر، برای الکتروفورز در روی ژل آگاروز 2%، محصولات PCR به نسبت 1 به 4 با ماده رنگی سایبرگرین مخلوط
جدول 1: توالی آغازگرها، اندازه، غلظت نهایی و اندازه مورد انتظار برای محصولات تکثیری در هر آنتیژن
| سیستم | آنتیژن | توالی آغازگر | اندازه(bp) |
| HPA-1 | 1a | 5' TCA CAG CGA GGT GAG GCC A 3' | 90 |
| 5' GGA GGT AGA GAG TCG CCA TAG 3' | |||
| 1b | 5' ACT TAC AGG CCC TGC CTC C 3' | 196 | |
| 5' AGC CGG AGT GCA ATC CTC TG 3' | |||
| HPA-2 | 2a | 5' GCCCCCAGGGCTCCTGAC 3' | 258 |
| 2b | 5' GCCCCCAGGGCTCCTGAT 3' | ||
| Common | 5' TCAGCATTGTCCTGCAGCCA 3' | ||
| HPA-3 | 3a | 5' GGG GGA GGG GCT GGG GA 3' | 293 |
| 3b | 5' GGG GGA GGG GCT GGG GC 3' | ||
| Common | 5' GGC CCT GGG ACT GTG AAT G3' | ||
| HPA-4 | 4a | 5' CTG GCC ACC CAG ATG CG 3' | 252 |
| 4b | 5' CTG GCC ACC CAG ATG CA 3' | ||
| Common | 5' GGT AGA AAG GAG CTA TAG TTT GGC 3' | ||
| HPA-5 | 5a | 5' AGA GTC TAC CTG TTT ACT ATC AAA G 3' | 246 |
| 5b | 5' AGA GTC TAC CTG TTT ACT ATC AAA A 3' | ||
| Common | 5' CTC TCA TGG AAA ATG GCA GTA CA 3' | ||
| HPA-15 | 15a | 5' TTC AAA TTC TTG GTA AAT CCT CG 3' | 225 |
| 15b | 5' TTC AAA TTC TTG GTA AAT CCT CT 3' | ||
| Common | 5' ATG AAC CTT ATG ATG ACC TAT TC 3' | ||
| bActin | جلوبرنده | 5’-AGAGCTACGAGCTGCCTGAC-3’ | 450 |
| معکوس | 5’-AGCACTGTGTTGGCGTACAG-3’ |
شده و باندهای حاصله با ترانس ایلومیناتورUV در طول موج 320 نانومتر مشاهده و با استفاده از Gel DOC عکسبـرداری صـورت گرفت و در نهایت عکسها مورد
بررسی قرار گرفتند.
تفسیر نتایج روش PCR :
غلظت آغازگرهای بتااکتین که به عنوان کنترل داخلی در هر واکنش لحاظ شدهاند طوری محاسبه گردیده که کمتر از آغازگرهای اصلی باشند و در هنگام تکثیر، رقابتی ایجاد نکنند و در نتیجه وجود باند کنترل داخل مؤید صحت روند آزمایش و مواد مورد استفاده میباشد. باندهای مربوط به آللها با استفاده از سایز مارکر و مقایسه آن با باند موجود در هر ردیف تشخیص داده شدند(جدول 1). نتایج قرائت شده، یادداشت گردیدند و سپس وفور موارد مشاهده شده با موارد قابل انتظار طبق قانون هاردی وینبرگ و با استفاده از آزمون آماری کایدو مقایسه گردید. در صورت عدم اختلاف یعنی موارد مشاهده شده با موارد قابل انتظار طبق قانون هاردی وینبرگ مطابقت دارد و با وارد کردن فراوانی آللی موارد هموزیگوت و هتروزیگوت در نرمافزار محاسبهگر خودکار هاردی وینبرگ(بر اساس معادله1= ab2+2b+ 2a)، وفـور آللهـای a و b بـرای آنتیژنهـای پلاکتی محاسبه
شدند[WU6] [WU7] . برای مقایسه فراوانی نسبی ژنها در جمعیتهــای
مختلف نیز از مقایسه نسبتها با آزمون کایدو و نرمافزار 19SPSS استفاده شد.
مقدار 05/0 p< بیانگر تفاوت معنادار میباشد. در صورت فقدان باند، تنها در حالتی جواب را منفی و به عنوان عدم حضور آلل تلقی میکنیم که تکثیر ژن کنترل (ژن بتا اکتین) صورت گرفته و باندی به اندازه bp 450 در الکتروفورز مشاهده شود.
بررسی آنتیبادیهای پلاکتی به روش فلوسیتومتری :
ابتدا Pooled پلاکتی از گروه خون O تهیه شد. نمونههای خون کامل که از 5 فرد سالم در لوله حاوی ضد انعقاد EDTA جمعآوری شده بود، توسط آنتیسرم گروهبندیABO(LORNE) گروهبندی گردید. این لوله با نیروی 200 گرم به مدت 15 دقیقه سانتریفیوژ شد. پس از سانتریفیوژ، خون کامل به سه قسمت تبدیل گردید. قسمت ته لوله حاوی RBC ، قسمت میانی بافیکوت و قسمت رویی حاوی پلاسما و پلاکت بود که به آن پلاسمای غنی از پلاکت(PRP ، Platelet Rich Plasma) گفته میشود. در این مرحله با سمپلر و به آرامی PRP از لوله جدا و در یک لوله مجزا ریخته شد. سپس 5/0 میلیلیتر از آن با دستگاه سل کانتر شمارش و تعداد کل پلاکت درPRP مورد نظر محاسبه گردید. زیرا جهت انجام آزمایشهای بعدی نیاز به تعداد mL 105×10پلاکت افراد با گروه خون O بود.50 میکرولیتر از Pooled PRP را در لوله فلوسیتومتری ریخته و 50 میکرولیتر ازسرم بیمار را به آن میافزاییم. در لوله کنترل فقط سوسپانسیون و بافر به جای سرم بیمار در لوله جداگانه اضافه گردید. به مدت 30 دقیقه در دمای 37 درجه[WU8] سانتیگراد انکوبه شد. تا واکنش مناسب بین آنتیژن و آنتیبادی صورت گیرد و پس از طی زمان انکوباسیون، سوسپانسیون 3 مرتبه با PBS (نیروی g2000 و زمان 10 دقیقه) شست و شو داده شد. پس از آخرین مرحله شست و شو، به رسوب زیرین از آنتیهیومن گلوبولین کونژوگه با FITC (محصول داکو) اضافه گردید. آنتیسرم مذکور در غلظت نهایی 30/1 با PBS رقیق شده و به لوله ± واکنش، 50 میکرولیتر اضافه گردید و به مدت 30 دقیقه در تاریکی در محیط آزمایشگاه انکوبه شد. سپس یک بار با محلول شستشو PBS ، 10دقیقه در دور g200 سانتریفیوژ گردید. مایع رویی را دور ریخته برای آنالیز به دستگاه فلوسیتومتری داده شد و تا event 10000قرائت شد(17). روش فلوسیتومتری با استفاده از دستگاهpartec-cyFlow[WU9] انجام شد و توسط نرمافزار فلومکس آنالیز گردید. در روش فلوسیتومتری در هر ران کاری یک نمونه کنترل مثبت و یک نمونه سرم منفی و کنترل ایزوتایپ هم جهت کنترل استفاده شدند. برای تنظیم نمودارها و ولتاژ دستگاه و شروع خوانش، ابتدا لوله حاوی ایزوتایپ کنترل به دستگاه فلوسیتومتری داده میشود.
بررسی آنتیبادیهای ضد انجام آزمایش(PRA) Panel Reactive antibody :
بررسی آنتیبادیهای ضد گلبولهای سفید با استفاده از آزمایش PRA به روش لنفوسایتوتوکسیسیتی با کمپلمان(CDC) مورد ارزیابی قرار گرفت. 4 میلیلیتر نمونه خون کامل در لوله ژلدار از افراد دریافت گردید و سپس با سانتریفوژ لولهها در 3000 دور به مدت 3 دقیقه، نمونه سرم جدا شده و در دمای C˚70- تا زمان انجام آزمایش نگهداری شد. به طور خلاصه ابتدا لنفوسیتهای افراد ظاهرا سالم را جدا و به تعداد cells/mL 106 × 3 سوسپانسیون نموده و سپس به حجم یک میکرولیتر به چاهکهای پلیت ترازاکی اضافه شدند. برای هر نمونه در این مطالعه سلولهای جدا شده از 40 فرد مختلف به 40 حفره پلیت ترازاکی اضافه و سپس به میزان یک میکرولیتر از سرم مورد بررسی نیز اضافه شد. 30 دقیقه در C˚37 قرار داده و سپس 5 میکرولیتر کمپلمان خرگوش (محصول شرکت مادر تخصصی پالایش و پژوهش خون) به چاهکها اضافه شد. یک ساعت و نیم در C˚ 37 قرار داده و سپس به محتویات هر چاهک 2 میکرولیتر رنگ ائوزین y اضافه و پس از یک تا دو دقیقه 10 میکرولیتر فرمالین 73% به چاهکها اضافه شد. وقوع یا عدم وقوع واکنش لیز یا سمیت سلولی با میکروسکوپ معکوس (درشت نمایی (10Xبه صورت مثبت یا منفی یادداشت شدند)دستورالعمل 99.OT.021.SOP/01 = سازمان انتقال خون ایران(. برای تفسیر نتایج مثبت برای واکنش PRA ، حداقل 10%(و بیشتر) از سلولهای مورد بررسی مبنای گزارش مثبت قرار گرفته به صورت درصد گزارش شدند(19-18). تعداد موارد مثبت در بین زنان و مردان ثبت و درصد واکنشهای مشاهده شده به عنوان شدت واکنش یادداشت گردیدند.
یافتهها
19 بیمار(8/38%) زن و31 بیمار(2/61%) مرد بودند. میانگین سنی در گروه زنان 5/24 ± 507/34 سال و در محدوده سنی 83-2 سال و در مردان 7/21 ± 01/41 سال با محدوه سنی80-4 سال بود که اختلاف معناداری نداشت. شمارش پلاکتی در زنان 3202 ± 6457 در محدوده(10000-1000)با شمارش پلاکتی در مردان 2518 ± 7283 در محدوده( 10000-3000) اختلاف معناداری نداشت(جدول 2). نتایج PRA در 19 نفر(8/38% شامل 9 مرد و 10 زن) منفی یا کمتر از 10%
جدول 2: مقایسه نتایج PRA در زنان و مردان مورد مطالعه
بود. 30 نفر(2/61% ، شامل 22 مرد و 8 زن) این آنتیبادیها را (10% PRA≥) در سرم خود داشتند. پاسخ مثبـت PRA در زنـان و مـردان با یکدیگر تفاوتی نداشت.
در بیماران گر چه بین پاسخ مثبت PRA و تعداد فرآورده پلاکتی مصرفی ارتباط معکوسی مشاهده شد، اما این ارتباط معنادار نبود. بین این دو متغیر به تفکیک
جنسیت نیز در مردان و در زنان ارتباط معناداری مشاهده نشد. به عبارتی در این مطالعه پاسـخ مثبـت PRA بـا تعـداد فـرآورده مصرفـی ارتباطـی نداشت.
بین پاسخ مثبتPRA با شمارش پلاکتی یک ساعت بعد از تزریق گر چه همبستگی ضعیف و معکوسی وجود داشت. اما این ارتباط معنادار نبود. رابطه بین پاسخ مثبت PRA با شمارش پلاکتی 24 ساعته بعد از تزریق نیز معنادار نشد. شدت فلورسنت قرائت شده در روش فلوسیتومتری برای 49 نمونه مورد بررسی در محدوده 91/16%-33/1% بود که میانگین و انحراف استاندارد برای آنها محاسبه شد. برای تعیین cut off اگر درصد قرائت شده شدت فلورسنت برای فرد از 2SD+M شدت فلورسنت(MF) قرائت شده، بزرگتر شد، نتیجه مثبت و اگر کمتر بود منفی تلقی شدند[WU10] (17). مقدار مذکور در مطالعه ما 8/10% حاصل شد. در کل 2 نفر از نظر آنتیبادی ضد HPA مثبت شدند. در یک خانم با شمارش پلاکتی یک ساعت بعد از تزریق 5000 میکرولیتر، نتیجه فلوسیتومتری(30/16%) برای آنتیبادیهای ضد HPAو نتیجه 35%PRA= مثبت برای آنتیبادیهای HLA، برای هر دو آنتیبادی مثبت قلمداد شد(نمودار 1).
بررسی قرار گرفتند.
تفسیر نتایج روش PCR :
غلظت آغازگرهای بتااکتین که به عنوان کنترل داخلی در هر واکنش لحاظ شدهاند طوری محاسبه گردیده که کمتر از آغازگرهای اصلی باشند و در هنگام تکثیر، رقابتی ایجاد نکنند و در نتیجه وجود باند کنترل داخل مؤید صحت روند آزمایش و مواد مورد استفاده میباشد. باندهای مربوط به آللها با استفاده از سایز مارکر و مقایسه آن با باند موجود در هر ردیف تشخیص داده شدند(جدول 1). نتایج قرائت شده، یادداشت گردیدند و سپس وفور موارد مشاهده شده با موارد قابل انتظار طبق قانون هاردی وینبرگ و با استفاده از آزمون آماری کایدو مقایسه گردید. در صورت عدم اختلاف یعنی موارد مشاهده شده با موارد قابل انتظار طبق قانون هاردی وینبرگ مطابقت دارد و با وارد کردن فراوانی آللی موارد هموزیگوت و هتروزیگوت در نرمافزار محاسبهگر خودکار هاردی وینبرگ(بر اساس معادله1= ab2+2b+ 2a)، وفـور آللهـای a و b بـرای آنتیژنهـای پلاکتی محاسبه
شدند[WU6] [WU7] . برای مقایسه فراوانی نسبی ژنها در جمعیتهــای
مختلف نیز از مقایسه نسبتها با آزمون کایدو و نرمافزار 19SPSS استفاده شد.
مقدار 05/0 p< بیانگر تفاوت معنادار میباشد. در صورت فقدان باند، تنها در حالتی جواب را منفی و به عنوان عدم حضور آلل تلقی میکنیم که تکثیر ژن کنترل (ژن بتا اکتین) صورت گرفته و باندی به اندازه bp 450 در الکتروفورز مشاهده شود.
بررسی آنتیبادیهای پلاکتی به روش فلوسیتومتری :
ابتدا Pooled پلاکتی از گروه خون O تهیه شد. نمونههای خون کامل که از 5 فرد سالم در لوله حاوی ضد انعقاد EDTA جمعآوری شده بود، توسط آنتیسرم گروهبندیABO(LORNE) گروهبندی گردید. این لوله با نیروی 200 گرم به مدت 15 دقیقه سانتریفیوژ شد. پس از سانتریفیوژ، خون کامل به سه قسمت تبدیل گردید. قسمت ته لوله حاوی RBC ، قسمت میانی بافیکوت و قسمت رویی حاوی پلاسما و پلاکت بود که به آن پلاسمای غنی از پلاکت(PRP ، Platelet Rich Plasma) گفته میشود. در این مرحله با سمپلر و به آرامی PRP از لوله جدا و در یک لوله مجزا ریخته شد. سپس 5/0 میلیلیتر از آن با دستگاه سل کانتر شمارش و تعداد کل پلاکت درPRP مورد نظر محاسبه گردید. زیرا جهت انجام آزمایشهای بعدی نیاز به تعداد mL 105×10پلاکت افراد با گروه خون O بود.50 میکرولیتر از Pooled PRP را در لوله فلوسیتومتری ریخته و 50 میکرولیتر ازسرم بیمار را به آن میافزاییم. در لوله کنترل فقط سوسپانسیون و بافر به جای سرم بیمار در لوله جداگانه اضافه گردید. به مدت 30 دقیقه در دمای 37 درجه[WU8] سانتیگراد انکوبه شد. تا واکنش مناسب بین آنتیژن و آنتیبادی صورت گیرد و پس از طی زمان انکوباسیون، سوسپانسیون 3 مرتبه با PBS (نیروی g2000 و زمان 10 دقیقه) شست و شو داده شد. پس از آخرین مرحله شست و شو، به رسوب زیرین از آنتیهیومن گلوبولین کونژوگه با FITC (محصول داکو) اضافه گردید. آنتیسرم مذکور در غلظت نهایی 30/1 با PBS رقیق شده و به لوله ± واکنش، 50 میکرولیتر اضافه گردید و به مدت 30 دقیقه در تاریکی در محیط آزمایشگاه انکوبه شد. سپس یک بار با محلول شستشو PBS ، 10دقیقه در دور g200 سانتریفیوژ گردید. مایع رویی را دور ریخته برای آنالیز به دستگاه فلوسیتومتری داده شد و تا event 10000قرائت شد(17). روش فلوسیتومتری با استفاده از دستگاهpartec-cyFlow[WU9] انجام شد و توسط نرمافزار فلومکس آنالیز گردید. در روش فلوسیتومتری در هر ران کاری یک نمونه کنترل مثبت و یک نمونه سرم منفی و کنترل ایزوتایپ هم جهت کنترل استفاده شدند. برای تنظیم نمودارها و ولتاژ دستگاه و شروع خوانش، ابتدا لوله حاوی ایزوتایپ کنترل به دستگاه فلوسیتومتری داده میشود.
بررسی آنتیبادیهای ضد انجام آزمایش(PRA) Panel Reactive antibody :
بررسی آنتیبادیهای ضد گلبولهای سفید با استفاده از آزمایش PRA به روش لنفوسایتوتوکسیسیتی با کمپلمان(CDC) مورد ارزیابی قرار گرفت. 4 میلیلیتر نمونه خون کامل در لوله ژلدار از افراد دریافت گردید و سپس با سانتریفوژ لولهها در 3000 دور به مدت 3 دقیقه، نمونه سرم جدا شده و در دمای C˚70- تا زمان انجام آزمایش نگهداری شد. به طور خلاصه ابتدا لنفوسیتهای افراد ظاهرا سالم را جدا و به تعداد cells/mL 106 × 3 سوسپانسیون نموده و سپس به حجم یک میکرولیتر به چاهکهای پلیت ترازاکی اضافه شدند. برای هر نمونه در این مطالعه سلولهای جدا شده از 40 فرد مختلف به 40 حفره پلیت ترازاکی اضافه و سپس به میزان یک میکرولیتر از سرم مورد بررسی نیز اضافه شد. 30 دقیقه در C˚37 قرار داده و سپس 5 میکرولیتر کمپلمان خرگوش (محصول شرکت مادر تخصصی پالایش و پژوهش خون) به چاهکها اضافه شد. یک ساعت و نیم در C˚ 37 قرار داده و سپس به محتویات هر چاهک 2 میکرولیتر رنگ ائوزین y اضافه و پس از یک تا دو دقیقه 10 میکرولیتر فرمالین 73% به چاهکها اضافه شد. وقوع یا عدم وقوع واکنش لیز یا سمیت سلولی با میکروسکوپ معکوس (درشت نمایی (10Xبه صورت مثبت یا منفی یادداشت شدند)دستورالعمل 99.OT.021.SOP/01 = سازمان انتقال خون ایران(. برای تفسیر نتایج مثبت برای واکنش PRA ، حداقل 10%(و بیشتر) از سلولهای مورد بررسی مبنای گزارش مثبت قرار گرفته به صورت درصد گزارش شدند(19-18). تعداد موارد مثبت در بین زنان و مردان ثبت و درصد واکنشهای مشاهده شده به عنوان شدت واکنش یادداشت گردیدند.
یافتهها
19 بیمار(8/38%) زن و31 بیمار(2/61%) مرد بودند. میانگین سنی در گروه زنان 5/24 ± 507/34 سال و در محدوده سنی 83-2 سال و در مردان 7/21 ± 01/41 سال با محدوه سنی80-4 سال بود که اختلاف معناداری نداشت. شمارش پلاکتی در زنان 3202 ± 6457 در محدوده(10000-1000)با شمارش پلاکتی در مردان 2518 ± 7283 در محدوده( 10000-3000) اختلاف معناداری نداشت(جدول 2). نتایج PRA در 19 نفر(8/38% شامل 9 مرد و 10 زن) منفی یا کمتر از 10%
جدول 2: مقایسه نتایج PRA در زنان و مردان مورد مطالعه
| درصد پاسخ PRA | زنان | مردان | مجموع |
| کمتر از 10% | 10 | 9 | 19 |
| 10% | 2 | 5 | 7 |
| 15% | 3 | 5 | 8 |
| 20% | 1 | 2 | 3 |
| 25% | - | 1 | 1 |
| 30% | - | 2 | 2 |
| 35% | 1 | - | 1 |
| 50% | 1 | 5 | 6 |
| 55% | - | 1 | 1 |
| 65% | - | 1 | 1 |
| مجموع | 18 | 31 | 49 |
بود. 30 نفر(2/61% ، شامل 22 مرد و 8 زن) این آنتیبادیها را (10% PRA≥) در سرم خود داشتند. پاسخ مثبـت PRA در زنـان و مـردان با یکدیگر تفاوتی نداشت.
در بیماران گر چه بین پاسخ مثبت PRA و تعداد فرآورده پلاکتی مصرفی ارتباط معکوسی مشاهده شد، اما این ارتباط معنادار نبود. بین این دو متغیر به تفکیک
جنسیت نیز در مردان و در زنان ارتباط معناداری مشاهده نشد. به عبارتی در این مطالعه پاسـخ مثبـت PRA بـا تعـداد فـرآورده مصرفـی ارتباطـی نداشت.
بین پاسخ مثبتPRA با شمارش پلاکتی یک ساعت بعد از تزریق گر چه همبستگی ضعیف و معکوسی وجود داشت. اما این ارتباط معنادار نبود. رابطه بین پاسخ مثبت PRA با شمارش پلاکتی 24 ساعته بعد از تزریق نیز معنادار نشد. شدت فلورسنت قرائت شده در روش فلوسیتومتری برای 49 نمونه مورد بررسی در محدوده 91/16%-33/1% بود که میانگین و انحراف استاندارد برای آنها محاسبه شد. برای تعیین cut off اگر درصد قرائت شده شدت فلورسنت برای فرد از 2SD+M شدت فلورسنت(MF) قرائت شده، بزرگتر شد، نتیجه مثبت و اگر کمتر بود منفی تلقی شدند[WU10] (17). مقدار مذکور در مطالعه ما 8/10% حاصل شد. در کل 2 نفر از نظر آنتیبادی ضد HPA مثبت شدند. در یک خانم با شمارش پلاکتی یک ساعت بعد از تزریق 5000 میکرولیتر، نتیجه فلوسیتومتری(30/16%) برای آنتیبادیهای ضد HPAو نتیجه 35%PRA= مثبت برای آنتیبادیهای HLA، برای هر دو آنتیبادی مثبت قلمداد شد(نمودار 1).

جدول 3: فراوانی مطلق و نسبی ژنوتیپی و فراوانی آللی(ژنی) آنتیژنهای مختلف پلاکتی در بیماران مورد مطالعه
| HPA Genotypes | تعداد | درصد | HPA Alleles |
| HPA-1a/1a | 16 | 34 | HPA-1a |
| HPA-1a/1b | 27 | 5/57 | HPA-1b |
| HPA-1b/1b | 4 | 5/8 | |
| HPA-2a/2a | 4 | 2/8 | HPA-2a |
| HPA-2a/2b | 38 | 6/77 | HPA-2b |
| HPA-2b/2b | 7 | 2/14 | |
| HPA-3a/3a | 29 | 2/59 | HPA-3a |
| HPA-3a/3b | 8 | 3/16 | HPA-3b |
| HPA-3b/3b | 12 | 5/24 | |
| HPA-4a/4a | 49 | 100 | HPA-4a |
| HPA-4a/4b | 0 | 0 | HPA-4b |
| HPA-4b/4b | 0 | 0 | |
| HPA-5a/5a | 49 | 100 | HPA-5a |
| HPA-5a/5ba | 0 | 0 | HPA-5b |
| HPA-5b/5b | 0 | 0 | |
| HPA-15a/15a | 8 | 3/16 | HPA-15a |
| HPA-15a/15b | 14 | 6/28 | HPA-15b |
| HPA-15b/15b | 27 | 1/55 |
HPA-1a/1b HPA-2a/2b HPA-3a/3b HPA-4a/4b HPA-5a/5b HPA-15a/15b S.M B-actin

شکل 1: نتایج الکتروفورز محصول PCR مربوط به ژنهای مختلف HPAs : از سمت چپ به راست: ستون اول و دوم مربوط به آللهای HPA-1a/ 1b، ستونهای سوم و چهارم مربوط به آللهای HPA-2a/2b ، ستونهای 5 و 6 مربوط به آللهای HPA-3a/3b ، ستونهای 7 و 8 مربوط به آللهای HPA-4a/4b، ستونهای 9 و 10 مربوط به آللهای HPA-5a/5b و ستونهای 11 و12 مربوط به آللهای HPA-15a/15b، ستون اول از سمت چپ مربوط به بتااکتین(کنترل داخلی) و ستون دوم از چپ سایز مارکر bp 50 میباشند.
نتیجه قرائت به شرح زیر بود:
HPA-1a+/1b-، HPA-2a-/2b+، HPA-3a-/3b+ /HPA-4a+/4b- / HPA-5a+/5b-/ HPA-15a+/15b+
ژنوتیپ وی: HPA-1a/1a ، HPA-2a/2a ، HPA-3a/3b ، HPA-4a/4a ، HPA-5a/5a و HPA-15a/15 بود. نمونه دوم مربوط به یک آقا با شمارش پلاکتی یک ساعت بعد از تزریق 5000 میکرولیتر، با نتیجه فلوسیتومتری 48/11% مثبت برای آنتیبادیهای ضد HPA و PRA منفی برای آنتیبادیهای HLA و ژنوتیپ: HPA-1a/1b، HPA-2a/2b، HPA-3a/3b، HPA-4a/4a ، HPA-5a/5a و HPA-15a/15b بود. در کل 18 بیمار علیرغم نقص در CCI یک ساعته(ابتلا به مقاومت پلاکتی ایمیون) در این طرح فاقد هر گونه آنتیبادی ضد HLA و ضد HPA به روشهای به کار رفته، بودند.
یافتههای آزمایش PCR-SSP :
در الکتروفورز ژل برای HPA-1 برای دو نمونه، نتایج مناسبی حاصل نشد و محاسبات وفور آللهای a وb آن بر مبنای 47 نفر انجام گرفت. در سایر موارد نتایج برای 49 نفر کامل شدند. در این مطالعه هیچ یک از افراد آلل b برای -5 HPA-4, نداشتند. وفور آلل a برای آنتیژنهای HPA-1, -2, -3 بیشتر از آللb به دست آمد اما وفور HPA-15b از آلل HPA-15a در این مطالعه بیشتر شد (جدول 3)(شکل 1).
بحث
این مطالعه بر روی 49 بیمار مبتلا به مقاومت پلاکتی ایمیون انجام شد. وفور آللهای آنتیژنهای پلاکتی HPA-1a و HPA-1b به ترتیب 6/0 و 4/0، HPA-2a وHPA-2b به ترتیب47/0 و 53/0، HPA-3a و HPA-3b به ترتیب 75/0 و 25/0، HPA-4a دارای فراوانی ژنی 1 (یا 100%)، HPA-5a نیز دارای فراوانی ۱ (یا 100%) و HPA-15a و HPA-15b به ترتیب 31/0 و 69/0 بود. HPA-4b و HPA-5b در هیچ یک از افراد مشاهده نشد. فراوانترین میزان هموزیگوسیتی در بین افراد مورد بررسی مربوط به HPA-5a/5a و HPA-4a/4a با 100% و سپس HPA-3a/3a با وفور 1/55% بود. کمترین میزان هموزیگوسیتی مربوط به HPA-1a/1a (با وفور 5/8%) و HPA-2a/2a (با وفور 2/8%) است. بیشترین میزان هتروزیگوسیتی مربوط HPA-2a/1b (با وفور6/77%) و HPA-1a/1b (با وفور 5/57%) و کمترین میزان هموزیگوسیتی مربوط به HPA-3a/3b (با وفور 3/16%) است.
30 نفر(2/61%) از بیماران، آنتیبادی ضد HLA داشتند و 19 نفر فاقد این آنتیبادیها بودند. دو نفر(1/4%) دارای آنتیبادی ضد HPA بودند که یک نفر از آنها دارای آنتیبادی ضد HLA نیز بود. وفور گزارش شده برای آنتیبادیهای ضد HLA و ضد HPAدر بیماران مبتلا به مقاومت پلاکت به ترتیب60%-20% و 25%-8% میباشد که در بسیاری موارد با آنتیبادیهای ضد HLA همراهند (20، 12). در مطالعهای در سال 1383 در سازمان انتقال خون ایران، در مورد آنتیبادیها در بیماران مبتلا به اختلالات خونی مانند لوسمی حاد و آنمی آپلاستیک که به درمان با پلاکت پاسخ مناسب نداده بودند، مشخص شد وفور آنتیبادی ضد آنتیژنهای HLA-Iبرابر7/53% و وفور آنتیبادی ضد آنتیژنهای پلاکتی 9/43% بود که 7/31% افراد دارای هر دو نوع آنتیبادی بودند(11). در مطالعهای در مورد بررسی و شناسایی آنتیبادیهای ضد HPA در 204 بیمار مبتلا به مقاومت پلاکتی(به روش الایزا) در آلمان و چین، مشخص شد که 114 نفر (88/55%) آنها دارای این آنتیبادیها هستند و از این 114 نفر، تعداد 110 (5/96%) نفر فقط آنتیبادی ضد HLA، 2 نفر فقط آنتیبادی ضد پلاکتی و 2 نفر هر دو آنتیبادی را داشتند(21). وفور این آنتیبادیها در بیماران این مطالعه در محدوده مطالعههای مشابه قبلی قرار میگیرند.
در سرم 18 نفر از افراد مطالعه حاضر که CCI یک ساعته آنها کمتر از pt/μL7500 بود(بیانگر ابتلا به مقاومت پلاکتی ایمن)، آنتیبادی ضد HLA دیده نشد. علت این امر این است که آنتیبادی ضد HLA در این تحقیق با روش سمیت سلولی وابسته به کمپلمان بررسی شدند. سمیت سلولی وابسته به کمپلمان از سال 1960 و تا سالها بعد به عنوان معیار استاندارد برای بررسی آنتیبادیهای ضد HLA به کار گرفته شد. اما این روش قادر به ردیابی برخی آنتیبادیهایی که از نظر بالینی مهم هستند، دارا نمیباشد(22).
هم چنین مطرح شده است گرچه سالها آنتیبادیها تنها روش حذف ایمونولوژیک پلاکتها شناخته شدند اما مطالعهها، حذف ایمونولوژیک پلاکت در غیاب آنتیبادیها را مطرح کردهاند.
تخریب پلاکتها در غیاب آنتیبادی به عوامل غیر ایمونولوژیک نسبت داده شده اما در برخی بیماران فاقد آنتیبادی، عوامل غیر ایمونولوژیک نیز در تخریب پلاکتها مطرح نیستند و در این رابطه به نقش سلولهای TCD8+ در پاکسازی پلاکتها در غیاب آنتیبادی اشاره شدهاند و مطرح گردیده این مکانیسم در بیماران مقاومت پلاکتی نیز قابل استناد است(23).
فراوانی آنتیژنهای پلاکتی در اهداکنندگان خون در کشورهای مختلف از جمله در ایران بررسی شده است. وفور ژنی یا آللی آنتیژنها در اهداکنندگان خون در کشورهای مختلف شامل انگلستان، چین، ژاپن، بحرین، اسپانیا، فنلاند، اتریش، کره، آمریکا، عربستان، تایلند و هم چنین ایران در محدودههای زیر به دست آمدهاند: 99/0-
75/0 : HPA-1a، 25/0 -01/0 : HPA-1b، 96/0-54/0 :
HPA-2a ، 46/0-04/0 : HPA-2b،95/0-48/0:HPA-3a ، 52/0-05/0: HPA-3b، 1-93/0: HPA-4a، 07/0-01/0: HPA-4b ، 99/0-79/0: HPA-5a ، 14/0-01/0 : HPA-5b، 54/0-47/0: HPA-15a، 53/047/0: HPA-15b (15).
در بررسی وفور ژنی محاسبه شده برای بیماران در مطالعه حاضر با محدودههای وفور ژنهای پلاکتی در جمعیتهای مختلف افراد ظاهراً سالم، مشخص شد که فراوانی به دست آمده برای آلل a برای ژنهای HPA-1,-2,-15 کمتر از محدوده فوق است در حالی که وفور آلل b برای همین آنتیژنها بیشتر از محدوده فوق میباشد(شاید به علت این که در مطالعه ما بیماران بررسی شدهاند) و وفور آللی سایر آللها در مطالعه ما در محدوده مطالعههای قبلی است. وفور ژنوتیپی و آللی بین این بیماران(ایرانی) با اهداکنندگان خون(ایرانی) در مطالعه مدنی و همکاران در جدول مقایسه شده است(16)(جدول 4).
جدول 4: وفور ژنوتیپی و آللی بین بیماران این مطالعه با اهداکنندگان خون(15)
| HPA Genotypes | فراوانی نسبی ژنوتیپ در مطالعه حاضر | فراوانی ژنوتیپ در اهداکنندگان خون | فراوانی ژن در مطالعه حاضر | فراوانی ژن در مطالعه مدنی(15) |
| HPA-1a/1a | 34 | 96 | 6/0 | 98/0 |
| HPA-1a/1b | 5/57 | 4 | 4/0 | 02/0 |
| HPA-1b/1b | 5/8 | 0 | ||
| HPA-2a/2a | 2/8 | 8 | 47/0 | 54/0 |
| HPA-2a/2b | 6/77 | 92 | 53/0 | 46/0 |
| HPA-2b/2b | 2/14 | 0 | ||
| HPA-3a/3a | 2/59 | 19 | 75/0 | 48/0 |
| HPA-3a/3b | 3/16 | 59 | 25/0 | 52/0 |
| HPA-3b/3b | 5/24 | 22 | ||
| HPA-4a/4a | 100 | 100 | 1 | 1 |
| HPA-4a/4b | 0 | 0 | 0 | 0 |
| HPA-4b/4b | 0 | 0 | ||
| HPA-5a/5a | 100 | 98 | 1 | 99/0 |
| HPA-5a/5ba | 0 | 0 | 0 | 01/0 |
| HPA-5b/5b | 0 | 2 | ||
| HPA-15a/15a | 3/16 | 14 | 31/0 | 47/0 |
| HPA-15a/15b | 6/28 | 19 | 69/0 | 53/0 |
| HPA-15b/15b | 1/55 | 67 |
مقایسه آماری وفور ژنوتیپی برای HPA-1b/1b ، HPA-1a/1b ، HPA-1a/1a ، HPA-2a/2b ، HPA-3a/3b و HPA-3b/3b و هم چنین وفور آللهای a وb برای آنتیژنهای HPA-1, -3 در بیماران مورد مطالعه با اهداکنندگان خون هم نژاد ایرانی تفاوت معناداری دارند(0001/0 p<)(16). در بیماران، هموزیگوسیتی برای آلل b مربوط به HPA-1,-2 مشاهده شد در حالی که اهداکنندگان فاقد آن هستند. این تفاوت وقوع احتمالی در بیماران طی دریافت پلاکت از اهداکنندگان خون هتروزیگوت ab برای این آنتیژنها را مطرح میکند. اثبات این امر احتیاج به تعیین نوع آنتیبادیهای پلاکتی در بیماران دارد. در جمعیتهای مختلف وفور آلل b برای HPA-15 در مقایسه با آلل این آنتیژن بیشتر است که در مطالعه ما نیز چنین بود(16). اما وفور ژنوتیپی و آللی برای سایر آنتیژنها تفاوت معناداری بین این دو جمعیت نشان نداد (ارزش p در محدوده 85/0-1/0). مقایسه وفور آللی و ژنوتیپی بیماران این مطالعه با تحقیقی که بر روی بیماران انکوهماتولوژیک با ترومبوسیتوپنی کمتر از 20000 میکرولیتر و مصرفکننده فرآورده متراکم پلاکتی در برزیل انجام شده نیز نشان داد که فقط در آللهای هموزیگوتa برای HPA-3, -15 و b برای HPA-1 با هم شبیهند و وفور ژنوتیپی و آللی سایر آنتیژنهای پلاکتی بین این دو گروه بیماران تفاوت معناداری ندارند که شاید به دلایل تفاوت نژادی باشد(24). در مطالعه بررسی HPAs در 150 بیمار (65 مرد و 85 زن) مبتلا به بدخیمیهای خونی همراه با ترومبوسیتوپنی در محدوده سنی 18 الی 30 سال در برزیل به روش SSP-PCR وفور آللی به شرح زیر حاصل شد:
HPA-1a: 0.837; HPA-1b: 0.163; HPA-2a: 0.830; HPA-2b: 0.170; HPA-3a: 0.700; HPA-3b: 0.300; HPA-4a: 1; HPA-4b: 0; HPA-5a: 0.887; HPA-5b: 0.113; HPA-15a: 0.457 و HPA-15b: 0.543
که با وفور آللهای HPA-4/-5/-15 در مطالعه ما شباهت وجود داشت(25).
نتیجهگیری
اطلاعات حاصل از مطالعه ما نشان داد که فراوانی آلل a برایHPA-1/ -3/ -4 /-5 و آلل b برایHPA-2/ -15 در جمعیت مورد مطالعه بیشتر بود. وفور آللی و ژنوتیپی بین گروه بیمار مورد مطالعه و جمعیت اهداکنندگان ایرانی میتواند توضیحدهنده وقوع مقاومت پلاکتی در آنها باشد. گرچه اظهار نظر دقیق در این مورد نیاز به بررسی بیشتر اهداکنندگانی دارد که فرآوردههای خون و پلاکت آنها به این گروه بیماران تزریق شده است. تعیین ژنوتیپ آنتیژنهای پلاکتی راهکار عملی مناسبی برای بررسی علت آلوایمونیزاسیون در بیماران مبتلا به مقاومت پلاکتی و سایر موارد ترومبوسیتوپنی و کمک به مدیریت درمان آنها است و امکان انتخاب اهداکننده سازگار از نظر این آنتیژنها را برای بیماران مربوطه مقدور میسازد.
تشکر و قدردانی
این مقاله بخشی از یافتههای طرح مصوب در شورای پژوهش مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ایران(796/خ مورخ 27 خرداد 1396) با تقبل پرداخت همه هزینهها توسط این مرکز میباشد که به عنوان پایاننامه کارشناسی ارشد در دانشگاه آزاد اسلامی واحد شرق ارائه شد. نویسندگان مقاله به این وسیله از خانمها: زهرا عطایی، مونا تجریشی، الهام سلطانآبادی، شیرین عبدیزاده، دکتر مهین نیکوگفتار و آقایان دکتر محمد نوروزی عقیده و مجتبی شاکرمی که در جمعآوری نمونههای مختلف برای راهاندازی و انجام آزمایشها کمک کردهاند، تشکر مینمایند.
نوع مطالعه: پژوهشي |
موضوع مقاله:
ايمونولوژي
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |



