جلد 15، شماره 2 - ( تابستان 1397 )
جلد 15 شماره 2 صفحات 132-120 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Ghasemimehr N, Yazdani Z, Farsinejad A, Mirzaee Khalilabadi R, Fatemi A. The effect of telomerase inhibitor MST-312 on apoptosis of acute lymphoblastic leukemia cell line NALM-6. bloodj 2018; 15 (2) :120-132
URL: http://bloodjournal.ir/article-1-1195-fa.html
URL: http://bloodjournal.ir/article-1-1195-fa.html
قاسمی مهر نرگس، یزدانی زینت، فارسی نژاد علیرضا، میرزایی خلیل آبادی روح الله، فاطمی احمد. اثر مهارکننده تلومراز MST-312 بر آپوپتوز رده سلولی لوسمی لنفوبلاستیک حاد (NALM-6). فصلنامه پژوهشی خون. 1397; 15 (2) :120-132
استادیار دانشکده پیراپزشکی دانشگاه علوم پزشکی کرمان
متن کامل [PDF 837 kb]
(1702 دریافت)
| چکیده (HTML) (5134 مشاهده)
مقدمه
لوسمی لنفوبلاستیک حاد(ALL) یک بدخیمی خونی ناشی از تکثیر و تجمع بیش از حد پیشسازهای لنفوسیتی در مغز استخوان و خون محیطی میباشد(1). شایعترین علائم بالینی شامل تب، کاهش وزن و خستگی است که گاها" همراه با بزرگی طحال، کبد و غدد لنفاوی و خونریزیهای زیر جلدی به صورت پتشی و پورپورا میباشد(3، 2). هم چنین رشد بیش از حد پیشسازهای بدخیم لنفوییدی باعث اشغال مغز استخوان شده و علائم مرتبط با آن شامل: کم خونی، ترمبوسیتوپنی و نوتروپنی بروز میکند(4). علیرغم این که عوامل متعدد ژنتیکی و محیطی به عنوان فاکتورهای دخیل در وقوع این بیماری معرفی شدهاند، اما هنوز اتیولوژی آن مبهم باقی مانده است (5). لوسمی لنفوبلاستیک حاد در تمام سنین رخ میدهد. هر چند در بزرگسالان کمتر از 1% از بدخیمیها را شامل میشود، اما در کودکان(با یک پیک وقوع در سنین 5-2 سال) از شیوع بالاتری برخوردار بوده و به عنوان شایعترین بدخیمی سنین کودکی مطرح میباشد، به طوری که 25% کل بدخیمیها و 80% لوسمیهای حاد کودکان را شامل میشود(9-6). هر چند درمان ALL با رژیمهای شیمی درمانی موفقیتآمیز بوده است، اما با اثرات سیتوتوکسیک بر روی بافتها و مرگ و میر مرتبط با درمان همراه است. هم چنین در 20%-15% موارد ALL کودکان و 50% موارد ALL بزرگسالان، عود رخ میدهد که در مقایسه با بیماری اولیه، موارد عود با مقاومت به درمان و بقای ضعیف همراه است. بنابراین لزوم کاربرد هدفهای درمانی جدید به منظور کاهش این مشکلات ضروری به نظر میرسد(10، 9). یکی از ویژگیهای شاخص و مشترک که در اکثر سرطانها مشاهده میشود، توانایی تکثیر نامحدود سلولهاست، که به واسطه بیان بالای آنزیمی به نام تلومراز حاصل میشود. تلومراز از طریق بازسازی توالی تلومر از مرگ سلولی ناشی از رسیدن طول تلومر به حد بحرانی جلوگیری کرده و به سلول قدرت نامیرایی و تکثیر نامحدود میدهد(11). از آن جایی که سلول طبیعی تقریباً فاقد فعالیت آنزیم تلومراز میباشد، در نتیجه استفاده از عوامل مهارکننده تلومراز نمیتواند روی این سلولها اثر ویژهای داشته باشد. این درحالی است که تلومراز در90%-85% سرطانهای انسانی دوباره فعال میشود. با توجه به نیاز سلولهای سرطانی به سطح بالای آنزیم تلومراز برای ادامه روند تکثیر، تلومراز میتواند یک هدف مناسب در درمان و مهار سرطان به حساب آید(13، 12). در لوسمی لنفوبلاستیک حاد، سطح فعالیت آنزیم تلومراز در نمونه مغز استخوان گرفته شده از بیماران به طور قابل توجهی بالاتر از نمونه افراد طبیعی است و تلومراز به عنوان یک مارکر بدخیمی در لوسمی لنفوبلاستیک حاد تلقی میشود(15، 14). از جمله مهارکنندههای تلومراز میتوان به ترکیبات مشتق از اپیگالوکاتچین گالات(EGCG)، مثل MST-312 اشاره کرد. EGCG (Epigallocatechin gallate) یک کاتچین اصلی چای سبز است که به صورت مؤثری تلومراز را مهار و رشد سلول را متوقف میکند(16). MST-312 که مهارکننده تلومراز شماره 9 نام دارد، فعالیتی وابسته به دوز داشته، به طوری که در دوزهای پایین(75/0 میکرومولار) فعالیت ضد تلومرازی دارد و در دوزهای بالا(2 میکرومولار)، سلول را به سمت مرگ سلولی سوق میدهد(17). در مطالعههای گذشته اثر MST-312 بر القای آپوپتوز به واسطه افزایش ژنهای شروعکننده آپوپتوز مانند Bax و هم چنین کاهش بیان ژنهای مهارکننده آپوپتوز مانند Bcl-2 نشان داده شده است(18). هدف مطالعه حاضر بررسی اثر مهارکننده تلومراز MST-312 بر آپوپتوز رده سلولی NALM-6 میباشد. با توجه به مطالعههای گذشته، رده سلولی NALM-6 دارای فعالیت بالای آنزیم تلومراز میباشد(20، 19). چنانچه مهار تلومراز بتواند مرگ سلولی را در رده سلولی NALM-6 القا کند، میتوان مهار تلومراز را به عنوان استراتژی درمانی سودمندی در درمان ALL معرفی نمود.
مواد و روشها
کشت سلولی:
در یک مطالعه تجربی، رده سلولی NALM-6 از بانک سلولی انستیتو پاستور ایران تهیه شد. سلولها در محیط کشت RPMI 1640 به همراه 10% سرم جنین گاوی(FBS) و 1% پنیسیلین –استرپتومایسین(U/mL 100 پنیسیلین و µg/mL 100 استرپتومایسین) در انکوباتور با رطوبت 95% و دمای 37 درجه سانتیگراد کشت داده شدند. محلول ذخیره MST-312 (سیگما آلدریچ، آمریکا) با جرم مولی 35/380 گرم بر مول تهیه شد. برای تهیه محلول ذخیره، 5 میلیگرم دارو در 1 میلیلیتر محلول دی متیل سولفوکساید (DMSO) حل شد و غلظت 14/13 میلیمولار (13140میکرومولار) به دست آمد. محلول کار با غلظت 100 میکرومولار در حجم 500 میکرولیتر تهیه و حجم مناسب برای به دست آمدن غلظتهای 2، 4 و 8 میکرومولار تعیین شد.
سنجش زندهمانی سلولی با آزمون دفع رنگ تریپانبلو:
برای بررسی درصد زندهمانی سلولی، سلولهای NALM-6 با استفاده از آزمون دفع رنگ تریپانبلو سنجش شدند. این آزمون در واقع روشی کمی برای تعیین درصد سلولهای زنده و مرده است. تریپانبلو از غشای هر دو سلول زنده و مرده عبور میکند ولی تنها سلولهای زنده به دلیل داشتن فعالیت حیاتی قادر به دفع رنگ تریپانبلو میباشند. به عبارت دیگر در این آزمون سلولهای زنده به صورت سفید و شفاف و سلولهای مرده به رنگ آبی تیره در زیر میکروسکوپ قابل مشاهدهاند. سلولها در پلیت کشت سلولی 12 خانه با تراکم 105 × 2 سلول در هر خانه کشت داده شده و با غلظتهای 0، 2، 4و 8 میکرومولار داروی MST-312 تیمار شدند. پس از پایان انکوباسیون در زمانهای 24، 48 و72 ساعت، سوسپانسیون سلولی با محلول تریپان 4/0% (سیگما، آلدریچ، آمریکا)، به نسبت 1 به 1 مخلوط شدند. پس از 1 الی 2 دقیقه انکوباسیون در دمای اتاق، مخلوط مورد نظر بر روی لام نئوبار و در زیر میکروسکوپ بررسی شد. سلولهای زنده(شفاف) و مرده(آبی) شمارش شدند و زندهمانـی سلولـی بـا استفـاده از فـرمول زیر محاسبه شد:
= درصد زندهمانی
100× (تعداد کل سلولها/تعداد سلولهای زنده)
سنجش فعالیت متابولیک سلولهای NALM-6 با روش رنگ سنجی MTT :
اثر غلظتهای مختلف MST-312 بر روی فعالیت متابولیک سلولهای NALM-6 با استفاده از روش رنگ سنجی MTT بررسی شد. MTT یک روش رنگ سنجی سریع، حساس و دقیق و بر پایه احیای نمکهای تترازولیوم زرد رنگ [3-4,5 dimethyl thiazol-2-yL-]-2-5 diphenyltetra (Zolium bromide) به وسیله فعالیتهای متابولیکـی سلـول زنـده تـوسط آنزیمهای دهیدروژناز میتوکندریایی میباشد که در نتیجه فرآیند احیا، بلورهای بنفش رنگ فورمازان تشکیل میشود.
سپس این بلورها در حلال مناسب حل شده و به وسیله روشهای اسپکتروفتومتری مقدار سنجی میشود. میزان بلور فورمازان ایجاد شده میتواند نشان دهنده درصد سلولهای زنده باشد. روش کار بدین صورت انجام گرفت که سلولهای NALM-6 (104×1 سلول در هر چاهک) با غلظتهای 0، 2، 4و 8 میکرومولار داروی MST-312 تیمار و به پلیت 96 خانه منتقل شدند. حجم نهایی هر چاهک μL 100 بود. 48 ساعت پس از تیمار، پلیتها با دور rpm2000 به مدت 10 دقیقه سانتریفوژ شدند. محیط چاهکها با وارونه کردن پلیت خارج شد. μL 100 محلول MTT (mg/mL 5/0 در PBS فیلتر شده- سیگما آلدریچ، آمریکا) به هر چاهک اضافه و تکمه سلولی به آرامی در محلول MTT حل شد. پلیت 96 خانه به مدت 4 ساعت در 37 درجه سانتیگراد انکوبه شد. پس از اتمام انکوباسیون، به منظور حل شدن بلورهای بنفش رنگ فورمازان، μL100 محلول DMSO به هر چاهک اضافه شد. پلیت با فویل آلمینیومی پوشانده و جهت ظاهر شدن رنگ به مدت 15 دقیقه بر روی شیکر مخلوط شد. میزان جذب نوری در طول موج 570 نانومتر با استفاده از دستگاه الایزا ریدر اندازهگیری شد. در پایان، میزان فعالیت متابولیک(بقای سلولی) با استفاده از فرمول زیر محاسبه شد:
= درصد فعالیت متابولیک سلولی
100× (جذب نوری کنترل / جذب نوری تست)
سنجش آپوپتوز:
اثر داروی MST-312 بر روی آپوپتوز رده سلولی NALM-6 بـه وسیلـه رنگآمیزی هم زمان با آنکسین-V و 7-AAD توسط کیت آپوپتوز FITC آنکسین V- (بیوساینس BD ، آمریکا) Detection Kit II بررسی شد. سلولهای NALM-6 در پلیت کشت سلول 12 خانه با تراکم 5 10×2 سلول در هر خانه کشت داده شدند و با غلظتهای مورد نظر(0، 2، 4و 8 میکرومولار) MST-312 به مدت 48 ساعت انکوبه شدند(حجم نهایی هر چاهک 2 میلیلیتر بود). نمونه با غلظت 0 میکرومولار مورد تیمار دارویی قرار گرفت و به عنوان کنترل منفی استفاده شد. بعد از اتمام انکوباسیون، محتویات هر چاهک به فالکونهای مجزا منتقل شد. به منظور جمعآوری سلولها، سانتریفوژ با دور rpm 2000 به مدت 5 دقیقه انجام گرفت. محیط رویی خارج و توده سلولی دو بار با PBS شستشو داده شد(هر بار با 1 میلیلیتر PBS و سانتریفوژ با دور rpm 2000 به مدت 5 دقیقه). پس از خارج کردن PBS رویی به هر توده سلولی، μL 100 بایندینگ بافر (x1)، μL 5 آنکسین- V FITC- و μL 5 محلول رنگ 7-AAD اضافه شد. پس از یک ورتکس ملایم، نمونهها به مدت 15 دقیقه در تاریکی انکوبه شدند. پس از اتمام انکوباسیون، μL 400 بایندیگ بافر (x1) به سوسپانسیون سلولی اضافه و آنالیز با فلوسیتومتری انجام شد. برای هر نمونه مشخصات 10000 سلول ضبط شد و اطلاعات خروجی دستگاه با استفاده از نرمافزار Cell Quest آنالیز گردید. سلولهایی که آنکسین مثبت و 7-AAD منفی بودند، در فاز اولیه آپوپتوز و سلولهایی که هم آنکسین و هم 7-AAD مثبت بودند به عنوان سلولهای فاز نهایی آپوپتوز در نظر گرفته شدند.
استخراج RNA و ساخت cDNA :
پس از 48 ساعت از تیمار سلولها با دوز 4 میکرو مولار MST-312، RNA سلول به صورت دستی و با استفاده از محلول جداسازی Tri-pure (رُوش-Tri-pure isolation Reagent) استخراج شد.به طور خلاصه سلولها با مقدار تقریبی 6 10 × 5 سلول به مدت 10 دقیقه با دور rpm 2000 در دمای 4 درجه سانتیگراد سانتریفوژ شدند. مایع رویی دور ریخته شد و به توده سلولی یک میلیلیتر از محلول Tripureاضافه شده و سلولها با استفاده از پیپتاژ و حرکت محکم دست لیز شدند. پس از 5 دقیقه انکوباسیون در دمای اتاق، 200 میکرولیتر از محلول کلروفرم اضافه شده و پس از بستن درب میکروتیوب به مدت 30 ثانیه با حرکت محکم دست تکان داده شد. پس از 5 دقیقه انکوباسیون در دمای اتاق، میکروتیوبها به مدت 15 دقیقه در 4 درجه سانتیگراد با دور rpm 12200 سانتریفوژ شدند. در این مرحله 3 فاز تشکیل شد، فاز رویی که شامل RNA میباشد برداشته شده و هم حجم آن ایزوپروپانول سرد اضافه شد. پس از 10 دقیقه انکوباسیون در دمای اتاق، میکروتیوبها به مدت 10 دقیقه با دور rpm 12200 در 4 درجه سانتیگراد سانتریفوژ شدند. مایع رویی خالی و به رسوب RNA، 1 میلیلیتر اتانول 75% اضافه گردید. میکروتیوبها چندین مرتبه سروته شدند و سپس 10 دقیقه انکوباسیون بر روی یخ اعمال شد. به مدت 10 دقیقه سانتریفوژ با دور rpm 7500 در 4 درجه سانتیگراد انجام شد. سپس مایع رویی تخلیه، رسوب خشک و در 20 میکرولیتر آبDEPC (DEPC Treated سیگما، آلدریچ، Water) حل شد و در پایان 10 دقیقه انکوباسیون بر روی یخ و 10 دقیقه در 60 درجه سانتیگراد همراه با حرکت ملایم انجام گرفت. کمیت RNA استخراج شده با استفاده از اسپکتروفوتومتر و به وسیله میزان جذب نمونهها در طول موج nm 260 اندازهگیری شد. از نسبت جذب نوری 260 به 280 نانومتر نیز برای بررسی میزان خلوص RNA استفاده شد که دامنه بین 1 تا 2 به عنوان بهترین خلوص در نظر گرفته میشود. برای بررسی کیفیت RNA استخراج شده، نمونه RNA بر روی ژل آگاروز 1% الکتروفورز شد. چنانچه RNA کیفیت مطلوبی داشته باشد بایستی باندهای S 28 و S 18 مربوط به RNA ریبوزومی(rRNA) مشاهده شوند. به منظور حذف آلودگی DNA از RNA از کیتDNase Treatment (فرمنتاز) استفاده شد. به طوری که به ازای هر نمونه، 1 میکروگرم از RNA به همراه 1 میکرولیتر buffer X DNase I Reaction10 و 1 میکرولیتر DNase I با آب عاری از نوکلئاز به حجم نهایی 10 میکرولیتر رسید و در دمای 37 درجه سانتیگراد به مدت 30 دقیقه انکوبـه شـد.
در نهایت، 1 میکرولیتر از محلول 50 میلیمولEDTA برای توقف واکنش افزوده شد و در دمای 65 درجه سانتیگراد برای 10 دقیقه قرار داده شد. برای ساخت cDNA از کیت ساخت DNA مکمل (RevertAid First Strand DNA complementary DNA (cDNA) Synthesis kit from Fermentas) تهیه شد. این کیت امکان ساخت DNA از روی RNA را فراهم میکند. در این مرحله به محصول واکنش DNase Treatment که حاوی 11 میکرولیتر RNA میباشد، 9 میکرولیتر از مستر تهیه شده اضافه شد و حجم نهایی به 20 میکرولیتر رسید(جدول 1). برای مطمئن شدن از ساخت cDNA ، واکنش PCR برای ژن بتااکتین انجام گرفت و سپس محصول PCR بر روی ژل آگارز ران شد. حضور باند مربوط به تکثیر بتا اکتین مشاهده شد، که دال بر حضور الگوی DNA و ساخت cDNA میباشد.
واکنش کمی Real Time PCR :
واکنش Real Time PCR به منظور بررسی بیان نسبی ژنهـای BaX وBcl2 در گروه تیمـار شده و کنترل بعد از
تیمار سلولهای NALM-6 با غلظت 4 میکرومولار MST-312 انجام شد.
مستر میکس X2 گرین(Real Q Plus 2x Master Mix آمپلیکون ـ گرین) برای انجام واکنش Real Time PCR مورد استفاده قرار گرفت(جداول 4-2).
جدول 1: مستر میکس تهیه شده برای واکنش ترانس کریپتاز معکوس Transcription
جدول 2: نحوه تهیه مسترمیکس واکنش Real Time PCR
جدول 3: برنامه مورد استفاده برای واکنش Real Time PCR
واکنش در دستگاه روتور ژن Q (کیاژن) انجام و با استفاده از نرمافزار REST ، دادههای حاصل از آن آنالیز گردید. برای تایید اختصاصی بودن محصولات تولید شده، آنالیز منحنی ذوب (melting curve) صورت گرفت. در این آنالیز محصولاتی که دارای طول و توالی یکسانی باشند دمای ذوب مشابهی داشته و منحنی ذوب آنها روی هم قرار میگیرد. از ژن بتااکتین به عنوان ژن کنترل داخلی(House keeping) جهت نرمالیزه کردن نتایج بیان ژنها استفاده شد. بیان هر ژن سه بار تکرار گردید و بیان نسبی ژنهای هدف با استفاده از روش مقایسـهای ΔΔCT طبـق فـرمول -ΔΔCT2 محاسبـه شد.
آنالیز آماری:
دادههای حاصل از آزمایشها به نرمافزار 22 SPSS وارد و توسط آزمون آماری paired-samples T Test مورد تجزیه و تحلیل آماری قرار گرفتند.
یافتهها
سنجش زندهمانی سلولهای NALM-6 بعد از تیمار با MST-312 :
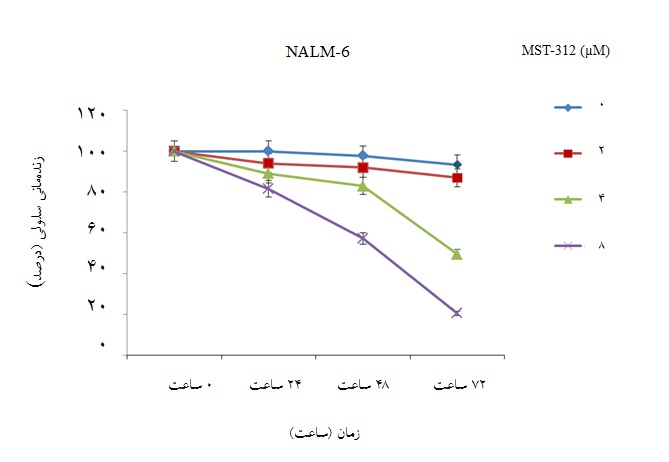
تاثیر غلظتهای مختلف MST-312 در زمانهای 24، 48 و 72 ساعت بر روی زندهمانی سلولهای رده سلولی NALM-6 با آزمون دفع رنگ تریپانبلو بررسی گردید. نتایج نشان داد که زندهمانی این سلولها به صورت وابسته به دوز و زمان به طور قابل توجهی کاهش یافت. سلولهای تیمار شده با غلظت 8 میکرومولار MST-312 ، در طول 48 ساعت، بیش از 50% کاهش زندهمانی نشان دادند(001/0 p<). از آن جایی که به دنبال مواجه سلولها با MST-312در طول 24 ساعت اثر قابل توجهی بر روی زندهمانی سلولها مشاهده نشد، هم چنین در طول 72 ساعت سلولها با کاهش شدید زندهمانی مواجهه شدند، زمان 48 ساعت به عنوان زمان مناسب برای سایر آزمایشها انتخاب شد(نمودار1).

نمودار 4: MST-312 ، بیان ژن Bcl2 را کاهش و بیان ژن Bax و نسبت Bax/Bcl2 را افزایش میدهد. پس از 48 ساعت از تیمار سلولهای NALM-6 با غلظت 4 میکرومولار MST-312، RNA سلولها استخراج و cDNA ساخت شد. نتایج Real Time PCR به روش سایبرگرین و با نشانگرهای اختصاصی نشان داده شده است. مقادیر با بیان ژن b actin نرمالیزه شدهاند(01/0 p< ** و 001/0 p< ***).
نشاندهنده تاثیر آپوپتوتیک این دارو بر سلولهای NALM-6 میباشد(نمودار 3). همان طور که در نمودار3 مشاهده میشود، غلظت 4میکرومولار که با آپوپتوز قابل توجهی همراه بود، به عنوان غلظت مورد نظر برای بررسی بیان ژن مورد استفاده قرار گرفت((01/0 p <).
بررسی سطح بیان ژن پیشآپوپتوزی Bax و ژن ضد آپوپتوزی Bcl-2 در سلولهای NALM-6 بعد از تیمار با MST-312 :
به منظور بررسی بیان ژنهای مرتبط با آپوپتوز شامل Bax و Bcl-2 ، از غلظت 4 میکرومولار MST-312 که در بررسی فلوسایتومتری با آپوپتوز قابل توجهی همراه بود استفاده شد. بعد از گذشت 48 ساعت از تیمار سلولهای NALM-6 با غلظت 4 میکرومولار MST-312 ، افزایش 11/2 برابری بیان ژن Bax و کاهش 61/0 برابری بیان ژن Bcl2 در گروه تیمار شده نسبت به گروه کنترل مشاهده شد(01/0 p<). هم چنین نسبت Bax/Bcl-2 افزایش 45/3 برابری(001/0 p<)(نمودار 4). نسبت به گروه کنترل نشان داد که تاییدی بر آپوپتوز القا شده توسط MST-312 در این سلولها است(001/0 p<).
بحث
نتایج مطالعه حاضر نشان داد تیمار 48 ساعته با MST-312 باعث کاهش زندهمانی، کاهش فعالیت متابولیک سلولی و افزایش آپوپتوز سلولی در رده سلولی NALM-6 میشود. در حال حاضر انتخاب یک ویژگی مشخص در سلولهای سرطانی که بتواند به عنوان شاخصی برای درمان هدفمند سرطان مورد استفاده قرار گیرد، از اهمیت به سزایی برخوردار است. یکی از ویژگیهای اختصاصی در اکثر سرطانها، بیان بالای آنزیم تلومراز است که با بازسازی توالی تلومر به سلول قدرت نامیرایی و تکثیر نامحدود میدهد(11). از آن جایی که سلول طبیعی تقریباً فاقد فعالیت آنزیم تلومراز است، در نتیجه استفاده از عوامل مهار کننده تلومراز نمیتواند روی این سلولها اثر ویژهای داشته باشد، در حالی که تلومراز در90%-85% سرطانهای انسانی دوباره فعال میشود و با توجه به نیاز سلولهای سرطانی به سطح بالای آنزیم تلومراز برای ادامه روند تکثیر و نقش به سزای آن در روند تومورزایی، تلومراز میتواند یک هدف مناسب در درمان و مهار سرطان به حساب آید(12). ازجمله در لوسمی لنفوبلاستیک حاد(ALL)، سطح فعالیت آنزیم تلومراز در نمونه مغز استخوان گرفته شده از بیماران در زمان تشخیص یا در زمان عود مجدد، به طور قابل توجهی بالاتر از نمونه افراد طبیعی است و تلومراز به عنوان یک مارکر بدخیمی در لوسمی لنفوبلاستیک حاد تلقی میشود(15، 14). در حال حاضر انواع مهارکنندههای تلومراز به تنهایی یا در ترکیب با داروهای دیگر در فازهای I و II کارآزماییهای بالینی جهت درمان انواع سرطان مورد استفاده قرار میگیرند(23-21). MST-312 که مهارکننده تلومراز شماره 9 نام دارد، یک ترکیب مشتق شده از چای سبز است که به صورت وابسته به دوز باعث مهار آنزیم تلومراز شده و سلول را به سمت مرگ سوق میدهد(17). در مطالعههای پیشین بر روی تومورهای مغزی و ریه، دو اثر متفاوت وابسته به زمان از MST-312 نشان داده شده است. یک اثر کوتاه مدت که به دنبال مواجه کوتاه مدت(برای مثال 72 ساعته) رخ میدهد و همراه با آسیب به DNA ، توقف چرخه سلولی در مراحل G2/M و کاهش زندهمانی سلولی است. این اثر به دلیل تخریب کمپلکس تلومراز و برداشته شدن اثر پوششی تلومراز از روی DNA تلومر و درنتیجه شناسایی تلومر به عنوان یک دورشته آزاد توسط مسیر کینازی ATM ایجاد میشود. اثر طولانی مدت(بیش از 5/1 ماه) به دنبال مواجه طولانی مدت و در اثر عدم جبران طول تلومر توسط تلومراز و کوتاه شدن تلومر رخ میدهد (26-24).
به علاوه مطالعههای قبلی ما در مواجه کوتاه مدت سلولها با MST-312، بیانگر اثر آپوپتوتیک وابسته به دوز و زمان MST-312 بر روی ردههای سلولی میلوم مالتیپل (U266) و لوسمی پرومیلوسیتیک حاد (NB4 و HL60) بود. هم چنین نتیجه بررسی آنالیز چرخه سلولی در سلولهای تیمار شده با MST-312 تاییدکننده توقف چرخه سلولی در مرحله G2/M در ردههای سلولی لوسمی پرومیلوسیتیک حاد بود. علاوه بر این هیچ گونه اثر سایتوتوکسیک و آپوپتوزی از این مهارکننده بر روی جمعیت سلولهای تک هستهای خون محیطی فرد سالم (PBMC) در مواجهه مشابه از نظر غلظت و زمان مشاهده نشد. ایـن موضـوع نشـاندهنـده اثـر اختصاصـی تـومور
MST-312 میباشد(18).
هم چنین بررسی اثر MST-312 بر روی رده سلولی سرطان کولورکتال توسط S سیونگ و همکارانش نشان داد MST-312 باعث کاهش فعالیت متابولیک، کاهش قابل توجه جمعیت سلولهای سرطانی و آپوپتوز سلولی میشود. اثر MST-312 در ترکیب با داروی مورین باعث افزایش قابل توجه تاثیر این دارو بر رده سلولی سرطان کولورکتال شد(27). در مطالعه دیگری که توسط گورانگ و همکارانش انجام شد، MST-312 باعث کاهش قابل توجه فعالیت تلومراز و توقف رشد در سلولهای سرطان سینه شد(28). سیمیا و همکارانش نشان دادند MST-312 باعث کوتاه شدن طول تلومر و مهار رشد سلولهای سرطانی و به عنوان کاندیدی قابل اعتماد برای هدف قرار دادن تلومراز معرفی گردید(29).
در مطالعه حاضر به منظور بررسی اثر مهارکننده تلومراز MST-312 بر روی رده سلولی لوسمی لنفوبلاستیک حاد (NALM-6)، که در مطالعههای گذشته بیان بالایی از آنزیم تلومراز در این رده سلولی گزارش شده است، سلولهای NALM-6 تحت تیمار کوتاه مدت(24، 48 و 72 ساعته) با غلظتهای مختلف MST-312 قرار گرفتند و زندهمانی سلولی در زمانهای معین سنجیده شد(20، 19). با توجه به این که در زمان 24 ساعت اثر قابل توجهی بر روی زندهمانی سلولها مشاهده نشد، هم چنین در زمان 72 ساعت میزان زندهمانی سلولی به صورت چشمگیری کاهش داشت، زمان 48 ساعت به منظور بررسیهای بیشتر انتخاب شد. نتایج ما نشان داد که تیمار کوتاه مدت با MST-312 موجب کاهش زندهمانی سلولها به صورت وابسته به دوز و زمان میشود. هم چنین بررسی فعالیت متابولیک سلولی به دنبال تیمار 48 ساعته با MST-312، به صورت قابل توجهی کاهش مییابد. از طرفی MST-312 باعث القای آپوپتوز در این سلولها شده که این آپوپتوز در سطح ژن با افزایش ژن آپوپتوزی Bax و ژن ضد آپوپتوزی Bcl-2 نیز تایید شد. با توجه به نتایج حاصل از این مطالعه و مطالعههای مشابه در تحت تاثیر قرار دادن سلولهای سرطانی به صورت اختصاصی به واسطه مهارکنندههای تلومراز و از جمله MST-312 و هم چنین با توجه به نقش موثر تلومراز در روند بدخیمیها از جمله لوسمی لنفوبلاستیک حاد، MST-312 میتواند به عنوان کاندیدی در درمان ALL پیشنهاد شود.
نتیجهگیری
تیمار کوتاه مدت سلولهــای سرطانـی NALM-6 بـا
MST-312 باعث کاهش زندهمانی، فعالیت متابولیک و افزایش آپوپتوز سلولی میشود. با توجه به نتایج این مطالعه، MST-312 با مهار تلومراز و القای آپوپتوز در سلولهای NALM-6 میتواند به عنوان کاندیدی در درمان
ALL پیشنهاد شود.
متن کامل: (2579 مشاهده)
اثر مهارکننده تلومراز MST-312 بر آپوپتوز رده سلولی لوسمی لنفوبلاستیک حاد
(NALM-6)
نرگس قاسمیمهر1، زینت یزدانی1، علیرضا فارسی نژاد2، روحاله میرزایی خلیل آبادی2، احمد فاطمی3
چکیده
سابقه و هدف
در حالی که تلومراز در 90%-85% سرطانها از جمله در لوسمی لنفوبلاستیک حاد بیان میشود، در سلولهای طبیعی بیان ناچیزی داشته و مهار آن میتواند یک رویکرد درمانی هدفمند برای درمان سرطان باشد. هدف از این مطالعه، بررسی اثر مهارکننده تلومراز MST-312 بر آپوپتوز سلولهای NALM-6 بود.
مواد و روشها
در این مطالعه تجربی، سلولهای NALM-6 با غلظتهای مختلف MST-312 تیمار شدند. سپس در زمانهای مختلف زنده مانی سلولی با آزمون تریپانبلو، فعالیت متابولیک سلولی با روش رنگ سنجی MTT ، آپوپتوز سلولی به روش فلوسیتومتری با استفاده از اتصال به آنکسین 7AAD/V- و آپوپتوز در سطح ژن با بررسی بیان ژنهای Bax و Bcl-2 مورد بررسی قرار گرفت.
یافتهها
بیش از 50% کاهش در زندهمانی سلولهای تیمار شده با غلظت 8 میکرومولار MST-312به مدت 48 ساعت مشاهده شد. مقادیر میانگین و انحراف معیار درصد زندهمانی در زمانهای صفر و 72 ساعت به ترتیب 100% و 5/2% ± 5/93% به دست آمد. فعالیت متابولیک سلولی پس از تیمار 48 ساعته در غلظتهای 2، 4 و 8 میکرومولار به ترتیب 6%، 69/19% و 9/56% کاهش یافت. مواجهه 48 ساعته سلولهای NALM-6 با غلظت 4 میکرومولار MST-312 ، منجر به افزایش20% در آپوپتوز سلولی، افزایش 11/2 برابری بیان ژن Bax و کاهش61/0 برابری بیان ژن Bcl-2 گردید.
نتیجه گیری
MST-312 با مهار تلومراز و القای آپوپتوز در رده سلولی لوسمی لنفوبلاستیک حاد NALM-6، میتواند به عنوان کاندیدی جدید برای درمان لوسمی لنفوبلاستیک حاد پیشنهاد شود.
کلمات کلیدی: تلومراز، آپوپتوز، لوسمی لنفوبلاستیک حاد
تاریخ دریافت: 19/1/97
تاریخ پذیرش: 19/2/97
1- کارشناس ارشد خونشناسی آزمایشگاهی و بانک خون ـ دانشکده پیراپزشکی دانشگاه علوم پزشکی کرمان ـ کرمان ـ ایران
2- PhD خونشناسی آزمایشگاهی و بانک خون ـ استادیار دانشکده پیراپزشکی دانشگاه علوم پزشکی کرمان ـ کرمان ـ ایران
3- مؤلف مسئول: PhD خونشناسی آزمایشگاهی و بانک خون ـ استادیار دانشکده پیراپزشکی دانشگاه علوم پزشکی کرمان ـ میدان پژوهش ـ کرمان ـ ایران ـ کدپستی: 9916964407
(NALM-6)
نرگس قاسمیمهر1، زینت یزدانی1، علیرضا فارسی نژاد2، روحاله میرزایی خلیل آبادی2، احمد فاطمی3
چکیده
سابقه و هدف
در حالی که تلومراز در 90%-85% سرطانها از جمله در لوسمی لنفوبلاستیک حاد بیان میشود، در سلولهای طبیعی بیان ناچیزی داشته و مهار آن میتواند یک رویکرد درمانی هدفمند برای درمان سرطان باشد. هدف از این مطالعه، بررسی اثر مهارکننده تلومراز MST-312 بر آپوپتوز سلولهای NALM-6 بود.
مواد و روشها
در این مطالعه تجربی، سلولهای NALM-6 با غلظتهای مختلف MST-312 تیمار شدند. سپس در زمانهای مختلف زنده مانی سلولی با آزمون تریپانبلو، فعالیت متابولیک سلولی با روش رنگ سنجی MTT ، آپوپتوز سلولی به روش فلوسیتومتری با استفاده از اتصال به آنکسین 7AAD/V- و آپوپتوز در سطح ژن با بررسی بیان ژنهای Bax و Bcl-2 مورد بررسی قرار گرفت.
یافتهها
بیش از 50% کاهش در زندهمانی سلولهای تیمار شده با غلظت 8 میکرومولار MST-312به مدت 48 ساعت مشاهده شد. مقادیر میانگین و انحراف معیار درصد زندهمانی در زمانهای صفر و 72 ساعت به ترتیب 100% و 5/2% ± 5/93% به دست آمد. فعالیت متابولیک سلولی پس از تیمار 48 ساعته در غلظتهای 2، 4 و 8 میکرومولار به ترتیب 6%، 69/19% و 9/56% کاهش یافت. مواجهه 48 ساعته سلولهای NALM-6 با غلظت 4 میکرومولار MST-312 ، منجر به افزایش20% در آپوپتوز سلولی، افزایش 11/2 برابری بیان ژن Bax و کاهش61/0 برابری بیان ژن Bcl-2 گردید.
نتیجه گیری
MST-312 با مهار تلومراز و القای آپوپتوز در رده سلولی لوسمی لنفوبلاستیک حاد NALM-6، میتواند به عنوان کاندیدی جدید برای درمان لوسمی لنفوبلاستیک حاد پیشنهاد شود.
کلمات کلیدی: تلومراز، آپوپتوز، لوسمی لنفوبلاستیک حاد
تاریخ دریافت: 19/1/97
تاریخ پذیرش: 19/2/97
1- کارشناس ارشد خونشناسی آزمایشگاهی و بانک خون ـ دانشکده پیراپزشکی دانشگاه علوم پزشکی کرمان ـ کرمان ـ ایران
2- PhD خونشناسی آزمایشگاهی و بانک خون ـ استادیار دانشکده پیراپزشکی دانشگاه علوم پزشکی کرمان ـ کرمان ـ ایران
3- مؤلف مسئول: PhD خونشناسی آزمایشگاهی و بانک خون ـ استادیار دانشکده پیراپزشکی دانشگاه علوم پزشکی کرمان ـ میدان پژوهش ـ کرمان ـ ایران ـ کدپستی: 9916964407
مقدمه
لوسمی لنفوبلاستیک حاد(ALL) یک بدخیمی خونی ناشی از تکثیر و تجمع بیش از حد پیشسازهای لنفوسیتی در مغز استخوان و خون محیطی میباشد(1). شایعترین علائم بالینی شامل تب، کاهش وزن و خستگی است که گاها" همراه با بزرگی طحال، کبد و غدد لنفاوی و خونریزیهای زیر جلدی به صورت پتشی و پورپورا میباشد(3، 2). هم چنین رشد بیش از حد پیشسازهای بدخیم لنفوییدی باعث اشغال مغز استخوان شده و علائم مرتبط با آن شامل: کم خونی، ترمبوسیتوپنی و نوتروپنی بروز میکند(4). علیرغم این که عوامل متعدد ژنتیکی و محیطی به عنوان فاکتورهای دخیل در وقوع این بیماری معرفی شدهاند، اما هنوز اتیولوژی آن مبهم باقی مانده است (5). لوسمی لنفوبلاستیک حاد در تمام سنین رخ میدهد. هر چند در بزرگسالان کمتر از 1% از بدخیمیها را شامل میشود، اما در کودکان(با یک پیک وقوع در سنین 5-2 سال) از شیوع بالاتری برخوردار بوده و به عنوان شایعترین بدخیمی سنین کودکی مطرح میباشد، به طوری که 25% کل بدخیمیها و 80% لوسمیهای حاد کودکان را شامل میشود(9-6). هر چند درمان ALL با رژیمهای شیمی درمانی موفقیتآمیز بوده است، اما با اثرات سیتوتوکسیک بر روی بافتها و مرگ و میر مرتبط با درمان همراه است. هم چنین در 20%-15% موارد ALL کودکان و 50% موارد ALL بزرگسالان، عود رخ میدهد که در مقایسه با بیماری اولیه، موارد عود با مقاومت به درمان و بقای ضعیف همراه است. بنابراین لزوم کاربرد هدفهای درمانی جدید به منظور کاهش این مشکلات ضروری به نظر میرسد(10، 9). یکی از ویژگیهای شاخص و مشترک که در اکثر سرطانها مشاهده میشود، توانایی تکثیر نامحدود سلولهاست، که به واسطه بیان بالای آنزیمی به نام تلومراز حاصل میشود. تلومراز از طریق بازسازی توالی تلومر از مرگ سلولی ناشی از رسیدن طول تلومر به حد بحرانی جلوگیری کرده و به سلول قدرت نامیرایی و تکثیر نامحدود میدهد(11). از آن جایی که سلول طبیعی تقریباً فاقد فعالیت آنزیم تلومراز میباشد، در نتیجه استفاده از عوامل مهارکننده تلومراز نمیتواند روی این سلولها اثر ویژهای داشته باشد. این درحالی است که تلومراز در90%-85% سرطانهای انسانی دوباره فعال میشود. با توجه به نیاز سلولهای سرطانی به سطح بالای آنزیم تلومراز برای ادامه روند تکثیر، تلومراز میتواند یک هدف مناسب در درمان و مهار سرطان به حساب آید(13، 12). در لوسمی لنفوبلاستیک حاد، سطح فعالیت آنزیم تلومراز در نمونه مغز استخوان گرفته شده از بیماران به طور قابل توجهی بالاتر از نمونه افراد طبیعی است و تلومراز به عنوان یک مارکر بدخیمی در لوسمی لنفوبلاستیک حاد تلقی میشود(15، 14). از جمله مهارکنندههای تلومراز میتوان به ترکیبات مشتق از اپیگالوکاتچین گالات(EGCG)، مثل MST-312 اشاره کرد. EGCG (Epigallocatechin gallate) یک کاتچین اصلی چای سبز است که به صورت مؤثری تلومراز را مهار و رشد سلول را متوقف میکند(16). MST-312 که مهارکننده تلومراز شماره 9 نام دارد، فعالیتی وابسته به دوز داشته، به طوری که در دوزهای پایین(75/0 میکرومولار) فعالیت ضد تلومرازی دارد و در دوزهای بالا(2 میکرومولار)، سلول را به سمت مرگ سلولی سوق میدهد(17). در مطالعههای گذشته اثر MST-312 بر القای آپوپتوز به واسطه افزایش ژنهای شروعکننده آپوپتوز مانند Bax و هم چنین کاهش بیان ژنهای مهارکننده آپوپتوز مانند Bcl-2 نشان داده شده است(18). هدف مطالعه حاضر بررسی اثر مهارکننده تلومراز MST-312 بر آپوپتوز رده سلولی NALM-6 میباشد. با توجه به مطالعههای گذشته، رده سلولی NALM-6 دارای فعالیت بالای آنزیم تلومراز میباشد(20، 19). چنانچه مهار تلومراز بتواند مرگ سلولی را در رده سلولی NALM-6 القا کند، میتوان مهار تلومراز را به عنوان استراتژی درمانی سودمندی در درمان ALL معرفی نمود.
مواد و روشها
کشت سلولی:
در یک مطالعه تجربی، رده سلولی NALM-6 از بانک سلولی انستیتو پاستور ایران تهیه شد. سلولها در محیط کشت RPMI 1640 به همراه 10% سرم جنین گاوی(FBS) و 1% پنیسیلین –استرپتومایسین(U/mL 100 پنیسیلین و µg/mL 100 استرپتومایسین) در انکوباتور با رطوبت 95% و دمای 37 درجه سانتیگراد کشت داده شدند. محلول ذخیره MST-312 (سیگما آلدریچ، آمریکا) با جرم مولی 35/380 گرم بر مول تهیه شد. برای تهیه محلول ذخیره، 5 میلیگرم دارو در 1 میلیلیتر محلول دی متیل سولفوکساید (DMSO) حل شد و غلظت 14/13 میلیمولار (13140میکرومولار) به دست آمد. محلول کار با غلظت 100 میکرومولار در حجم 500 میکرولیتر تهیه و حجم مناسب برای به دست آمدن غلظتهای 2، 4 و 8 میکرومولار تعیین شد.
سنجش زندهمانی سلولی با آزمون دفع رنگ تریپانبلو:
برای بررسی درصد زندهمانی سلولی، سلولهای NALM-6 با استفاده از آزمون دفع رنگ تریپانبلو سنجش شدند. این آزمون در واقع روشی کمی برای تعیین درصد سلولهای زنده و مرده است. تریپانبلو از غشای هر دو سلول زنده و مرده عبور میکند ولی تنها سلولهای زنده به دلیل داشتن فعالیت حیاتی قادر به دفع رنگ تریپانبلو میباشند. به عبارت دیگر در این آزمون سلولهای زنده به صورت سفید و شفاف و سلولهای مرده به رنگ آبی تیره در زیر میکروسکوپ قابل مشاهدهاند. سلولها در پلیت کشت سلولی 12 خانه با تراکم 105 × 2 سلول در هر خانه کشت داده شده و با غلظتهای 0، 2، 4و 8 میکرومولار داروی MST-312 تیمار شدند. پس از پایان انکوباسیون در زمانهای 24، 48 و72 ساعت، سوسپانسیون سلولی با محلول تریپان 4/0% (سیگما، آلدریچ، آمریکا)، به نسبت 1 به 1 مخلوط شدند. پس از 1 الی 2 دقیقه انکوباسیون در دمای اتاق، مخلوط مورد نظر بر روی لام نئوبار و در زیر میکروسکوپ بررسی شد. سلولهای زنده(شفاف) و مرده(آبی) شمارش شدند و زندهمانـی سلولـی بـا استفـاده از فـرمول زیر محاسبه شد:
= درصد زندهمانی
100× (تعداد کل سلولها/تعداد سلولهای زنده)
سنجش فعالیت متابولیک سلولهای NALM-6 با روش رنگ سنجی MTT :
اثر غلظتهای مختلف MST-312 بر روی فعالیت متابولیک سلولهای NALM-6 با استفاده از روش رنگ سنجی MTT بررسی شد. MTT یک روش رنگ سنجی سریع، حساس و دقیق و بر پایه احیای نمکهای تترازولیوم زرد رنگ [3-4,5 dimethyl thiazol-2-yL-]-2-5 diphenyltetra (Zolium bromide) به وسیله فعالیتهای متابولیکـی سلـول زنـده تـوسط آنزیمهای دهیدروژناز میتوکندریایی میباشد که در نتیجه فرآیند احیا، بلورهای بنفش رنگ فورمازان تشکیل میشود.
سپس این بلورها در حلال مناسب حل شده و به وسیله روشهای اسپکتروفتومتری مقدار سنجی میشود. میزان بلور فورمازان ایجاد شده میتواند نشان دهنده درصد سلولهای زنده باشد. روش کار بدین صورت انجام گرفت که سلولهای NALM-6 (104×1 سلول در هر چاهک) با غلظتهای 0، 2، 4و 8 میکرومولار داروی MST-312 تیمار و به پلیت 96 خانه منتقل شدند. حجم نهایی هر چاهک μL 100 بود. 48 ساعت پس از تیمار، پلیتها با دور rpm2000 به مدت 10 دقیقه سانتریفوژ شدند. محیط چاهکها با وارونه کردن پلیت خارج شد. μL 100 محلول MTT (mg/mL 5/0 در PBS فیلتر شده- سیگما آلدریچ، آمریکا) به هر چاهک اضافه و تکمه سلولی به آرامی در محلول MTT حل شد. پلیت 96 خانه به مدت 4 ساعت در 37 درجه سانتیگراد انکوبه شد. پس از اتمام انکوباسیون، به منظور حل شدن بلورهای بنفش رنگ فورمازان، μL100 محلول DMSO به هر چاهک اضافه شد. پلیت با فویل آلمینیومی پوشانده و جهت ظاهر شدن رنگ به مدت 15 دقیقه بر روی شیکر مخلوط شد. میزان جذب نوری در طول موج 570 نانومتر با استفاده از دستگاه الایزا ریدر اندازهگیری شد. در پایان، میزان فعالیت متابولیک(بقای سلولی) با استفاده از فرمول زیر محاسبه شد:
= درصد فعالیت متابولیک سلولی
100× (جذب نوری کنترل / جذب نوری تست)
سنجش آپوپتوز:
اثر داروی MST-312 بر روی آپوپتوز رده سلولی NALM-6 بـه وسیلـه رنگآمیزی هم زمان با آنکسین-V و 7-AAD توسط کیت آپوپتوز FITC آنکسین V- (بیوساینس BD ، آمریکا) Detection Kit II بررسی شد. سلولهای NALM-6 در پلیت کشت سلول 12 خانه با تراکم 5 10×2 سلول در هر خانه کشت داده شدند و با غلظتهای مورد نظر(0، 2، 4و 8 میکرومولار) MST-312 به مدت 48 ساعت انکوبه شدند(حجم نهایی هر چاهک 2 میلیلیتر بود). نمونه با غلظت 0 میکرومولار مورد تیمار دارویی قرار گرفت و به عنوان کنترل منفی استفاده شد. بعد از اتمام انکوباسیون، محتویات هر چاهک به فالکونهای مجزا منتقل شد. به منظور جمعآوری سلولها، سانتریفوژ با دور rpm 2000 به مدت 5 دقیقه انجام گرفت. محیط رویی خارج و توده سلولی دو بار با PBS شستشو داده شد(هر بار با 1 میلیلیتر PBS و سانتریفوژ با دور rpm 2000 به مدت 5 دقیقه). پس از خارج کردن PBS رویی به هر توده سلولی، μL 100 بایندینگ بافر (x1)، μL 5 آنکسین- V FITC- و μL 5 محلول رنگ 7-AAD اضافه شد. پس از یک ورتکس ملایم، نمونهها به مدت 15 دقیقه در تاریکی انکوبه شدند. پس از اتمام انکوباسیون، μL 400 بایندیگ بافر (x1) به سوسپانسیون سلولی اضافه و آنالیز با فلوسیتومتری انجام شد. برای هر نمونه مشخصات 10000 سلول ضبط شد و اطلاعات خروجی دستگاه با استفاده از نرمافزار Cell Quest آنالیز گردید. سلولهایی که آنکسین مثبت و 7-AAD منفی بودند، در فاز اولیه آپوپتوز و سلولهایی که هم آنکسین و هم 7-AAD مثبت بودند به عنوان سلولهای فاز نهایی آپوپتوز در نظر گرفته شدند.
استخراج RNA و ساخت cDNA :
پس از 48 ساعت از تیمار سلولها با دوز 4 میکرو مولار MST-312، RNA سلول به صورت دستی و با استفاده از محلول جداسازی Tri-pure (رُوش-Tri-pure isolation Reagent) استخراج شد.به طور خلاصه سلولها با مقدار تقریبی 6 10 × 5 سلول به مدت 10 دقیقه با دور rpm 2000 در دمای 4 درجه سانتیگراد سانتریفوژ شدند. مایع رویی دور ریخته شد و به توده سلولی یک میلیلیتر از محلول Tripureاضافه شده و سلولها با استفاده از پیپتاژ و حرکت محکم دست لیز شدند. پس از 5 دقیقه انکوباسیون در دمای اتاق، 200 میکرولیتر از محلول کلروفرم اضافه شده و پس از بستن درب میکروتیوب به مدت 30 ثانیه با حرکت محکم دست تکان داده شد. پس از 5 دقیقه انکوباسیون در دمای اتاق، میکروتیوبها به مدت 15 دقیقه در 4 درجه سانتیگراد با دور rpm 12200 سانتریفوژ شدند. در این مرحله 3 فاز تشکیل شد، فاز رویی که شامل RNA میباشد برداشته شده و هم حجم آن ایزوپروپانول سرد اضافه شد. پس از 10 دقیقه انکوباسیون در دمای اتاق، میکروتیوبها به مدت 10 دقیقه با دور rpm 12200 در 4 درجه سانتیگراد سانتریفوژ شدند. مایع رویی خالی و به رسوب RNA، 1 میلیلیتر اتانول 75% اضافه گردید. میکروتیوبها چندین مرتبه سروته شدند و سپس 10 دقیقه انکوباسیون بر روی یخ اعمال شد. به مدت 10 دقیقه سانتریفوژ با دور rpm 7500 در 4 درجه سانتیگراد انجام شد. سپس مایع رویی تخلیه، رسوب خشک و در 20 میکرولیتر آبDEPC (DEPC Treated سیگما، آلدریچ، Water) حل شد و در پایان 10 دقیقه انکوباسیون بر روی یخ و 10 دقیقه در 60 درجه سانتیگراد همراه با حرکت ملایم انجام گرفت. کمیت RNA استخراج شده با استفاده از اسپکتروفوتومتر و به وسیله میزان جذب نمونهها در طول موج nm 260 اندازهگیری شد. از نسبت جذب نوری 260 به 280 نانومتر نیز برای بررسی میزان خلوص RNA استفاده شد که دامنه بین 1 تا 2 به عنوان بهترین خلوص در نظر گرفته میشود. برای بررسی کیفیت RNA استخراج شده، نمونه RNA بر روی ژل آگاروز 1% الکتروفورز شد. چنانچه RNA کیفیت مطلوبی داشته باشد بایستی باندهای S 28 و S 18 مربوط به RNA ریبوزومی(rRNA) مشاهده شوند. به منظور حذف آلودگی DNA از RNA از کیتDNase Treatment (فرمنتاز) استفاده شد. به طوری که به ازای هر نمونه، 1 میکروگرم از RNA به همراه 1 میکرولیتر buffer X DNase I Reaction10 و 1 میکرولیتر DNase I با آب عاری از نوکلئاز به حجم نهایی 10 میکرولیتر رسید و در دمای 37 درجه سانتیگراد به مدت 30 دقیقه انکوبـه شـد.
در نهایت، 1 میکرولیتر از محلول 50 میلیمولEDTA برای توقف واکنش افزوده شد و در دمای 65 درجه سانتیگراد برای 10 دقیقه قرار داده شد. برای ساخت cDNA از کیت ساخت DNA مکمل (RevertAid First Strand DNA complementary DNA (cDNA) Synthesis kit from Fermentas) تهیه شد. این کیت امکان ساخت DNA از روی RNA را فراهم میکند. در این مرحله به محصول واکنش DNase Treatment که حاوی 11 میکرولیتر RNA میباشد، 9 میکرولیتر از مستر تهیه شده اضافه شد و حجم نهایی به 20 میکرولیتر رسید(جدول 1). برای مطمئن شدن از ساخت cDNA ، واکنش PCR برای ژن بتااکتین انجام گرفت و سپس محصول PCR بر روی ژل آگارز ران شد. حضور باند مربوط به تکثیر بتا اکتین مشاهده شد، که دال بر حضور الگوی DNA و ساخت cDNA میباشد.
واکنش کمی Real Time PCR :
واکنش Real Time PCR به منظور بررسی بیان نسبی ژنهـای BaX وBcl2 در گروه تیمـار شده و کنترل بعد از
تیمار سلولهای NALM-6 با غلظت 4 میکرومولار MST-312 انجام شد.
مستر میکس X2 گرین(Real Q Plus 2x Master Mix آمپلیکون ـ گرین) برای انجام واکنش Real Time PCR مورد استفاده قرار گرفت(جداول 4-2).
جدول 1: مستر میکس تهیه شده برای واکنش ترانس کریپتاز معکوس Transcription
| حجم مورد نیاز (میکرولیتر) | ماده مورد استفاده |
| 4 | X 5 Reaction Buffer |
| 1 | (µM 100) mers 6 Random |
| 2 | (mM 10) dNTP |
| 1 | (U/µL 20) 1 Ribolock Rnase Inhibitor |
| 1 | (U/µL 200) RevertAid M-Mul V |
دما و زمان واکنش در ترموسایکلر بر اساس کیت:
|
|
جدول 2: نحوه تهیه مسترمیکس واکنش Real Time PCR
| ماده مورد استفاده | حجم مورد نیاز (میکرولیتر) |
| مستر میکس گرین X 2 (آمپلیکون) | 5 |
| آغازگر جلوبرنده | 5/0 |
| آغازگر معکوس | 5/0 |
| cDNA | 5/0 |
| آب تهی از نوکلئاز | 5/3 |
جدول 3: برنامه مورد استفاده برای واکنش Real Time PCR
| مرحله واکنش | دما درجه سانتیگراد | زمان(ثانیه) | تعداد چرخه |
| فعالسازی اولیه | 95 | 900 | 1 چرخه |
| فعالسازی اولیه | 95 | 15 | 40 چرخه |
| طویلسازی | 65 | 60 |
جدول 4: توالی آغازگرهای معکوس و جلوبرنده ژنهای Bax ، Bcl-2 و b actin
| نام ژن | توالی آغازگر جلوبرنده | توالی آغازگر معکوس |
| b actin | CCAACCGCGAGAAGATGA | TCCATCACGATGCCAGTG |
| Bax | AGGATCGAGCAGGGCGAATG | TCAGCTTCTTGGTGGACGCA |
| Bcl-2 | ATCGCCCTGTGGATGACTGAG | CAGCCAGGAGAAATCAAACAGAG |
واکنش در دستگاه روتور ژن Q (کیاژن) انجام و با استفاده از نرمافزار REST ، دادههای حاصل از آن آنالیز گردید. برای تایید اختصاصی بودن محصولات تولید شده، آنالیز منحنی ذوب (melting curve) صورت گرفت. در این آنالیز محصولاتی که دارای طول و توالی یکسانی باشند دمای ذوب مشابهی داشته و منحنی ذوب آنها روی هم قرار میگیرد. از ژن بتااکتین به عنوان ژن کنترل داخلی(House keeping) جهت نرمالیزه کردن نتایج بیان ژنها استفاده شد. بیان هر ژن سه بار تکرار گردید و بیان نسبی ژنهای هدف با استفاده از روش مقایسـهای ΔΔCT طبـق فـرمول -ΔΔCT2 محاسبـه شد.
آنالیز آماری:
دادههای حاصل از آزمایشها به نرمافزار 22 SPSS وارد و توسط آزمون آماری paired-samples T Test مورد تجزیه و تحلیل آماری قرار گرفتند.
یافتهها
سنجش زندهمانی سلولهای NALM-6 بعد از تیمار با MST-312 :
تاثیر غلظتهای مختلف MST-312 در زمانهای 24، 48 و 72 ساعت بر روی زندهمانی سلولهای رده سلولی NALM-6 با آزمون دفع رنگ تریپانبلو بررسی گردید. نتایج نشان داد که زندهمانی این سلولها به صورت وابسته به دوز و زمان به طور قابل توجهی کاهش یافت. سلولهای تیمار شده با غلظت 8 میکرومولار MST-312 ، در طول 48 ساعت، بیش از 50% کاهش زندهمانی نشان دادند(001/0 p<). از آن جایی که به دنبال مواجه سلولها با MST-312در طول 24 ساعت اثر قابل توجهی بر روی زندهمانی سلولها مشاهده نشد، هم چنین در طول 72 ساعت سلولها با کاهش شدید زندهمانی مواجهه شدند، زمان 48 ساعت به عنوان زمان مناسب برای سایر آزمایشها انتخاب شد(نمودار1).

نمودار 1:MST-312 باعث کاهش درصد زندهمانی سلولهای NALM-6 میشود. سلولهای NALM-6 با غلظتهای مختلف MST-312 مواجه شدند و در زمانهای 24، 48 و 72 ساعت پس از مواجهه، زندهمانی سلولی با آزمون دفع رنگ تریپانبلو، بررسی شد. زندهمانی سلولهای NALM-6، پس از تیمار کوتاه مدت با MST-312 به صورت وابسته به دوز و زمان کاهش یافت.

نمودار 2: MST-312 باعث کاهش فعالیت متابولیک سلولهای NALM-6 میشود. سلولهای NALM-6 با غلظتهای مختلف MST-312 تیمار شدند و بعد از 48 ساعت فعالیت متابولیک سلولی با آزمون رنگسنجی MTT بررسی شد. فعالیت متابولیک سلولهای NALM-6 مواجهه شده با MST-312 به طور قابل توجهی به صورت وابسته به دوز کاهش یافت(05/0 p< * و 001/0 p< ***).
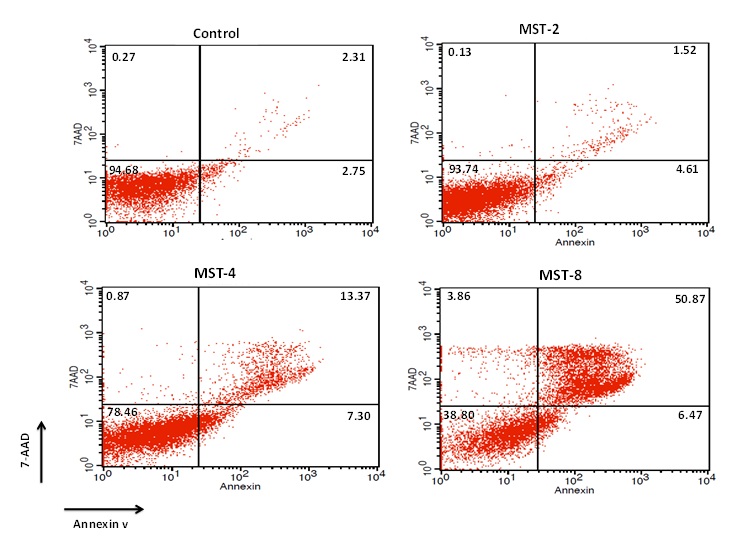
شکل 1: سلولهای NALM-6 پس از تیمار 48 ساعته با غلظت 4 میکرومولار MST-312 ، از نظر اتصال به آنکسین-V/ 7AAD مورد بررسی قرار گرفتند. سلولهای آنکسین منفی/7AAD منفی به عنوان سلولهای زنده، سلولهای آنکسین مثبت/ 7AADمنفی به عنوان سلولهای مراحل اولیه آپوپتوز، سلولهای آنکسین مثبت/ 7AAD مثبت به عنوان سلولهای مراحل انتهایی آپوپتوز و سلولهای آنکسین منفی/ 7AAD مثبت به عنوان سلولهای نکروتیک تلقی شدند.
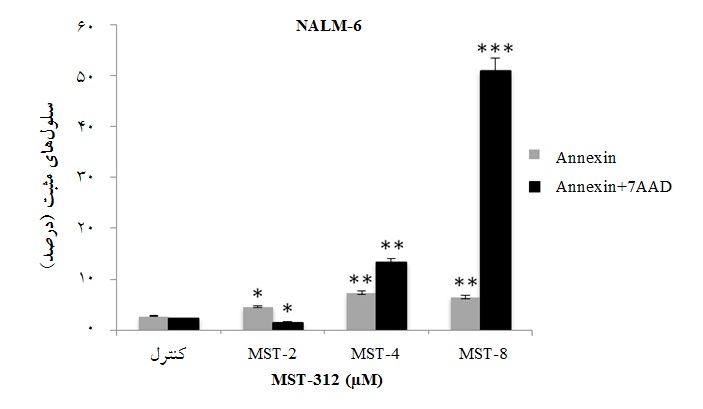
نمودار 3: اثر آپوپتوزی وابسته به دوز MST-312 بر رده سلولی NALM-6 مشاهده شد. MST-312 بر آپوپتوز رده سلولی NALM-6. سلولهای NALM-6 به مدت 48 ساعت با دوزهای مختلف MST-312 تیمار شدند. سپس این سلولها از نظر اتصال به آنکسین-v/7AAD مورد بررسی قرار گرفتند. سلولهای آنکسین منفی/7AAD منفی به عنوان سلولهای زنده، سلولهای آنکسین مثبت/ 7AADمنفی به عنوان سلولهای مراحل اولیه آپوپتوز، سلولهای آنکسین مثبت/ 7AAD مثبت به عنوان سلولهای مراحل انتهایی آپوپتوز و سلولهای آنکسین منفی/7AAD مثبت به عنوان سلولهای نکروتیک تلقی شدند. تقریباً 20% آپوپتوز در مواجهه 48 ساعته با غلظت 4 میکرومولار مشاهده شد. نتیجه از سه مرتبه تکرار نشان داده شده است (05/0 p< * ، 01/0 p< ** و 001/0 p< *** ).

نمودار 2: MST-312 باعث کاهش فعالیت متابولیک سلولهای NALM-6 میشود. سلولهای NALM-6 با غلظتهای مختلف MST-312 تیمار شدند و بعد از 48 ساعت فعالیت متابولیک سلولی با آزمون رنگسنجی MTT بررسی شد. فعالیت متابولیک سلولهای NALM-6 مواجهه شده با MST-312 به طور قابل توجهی به صورت وابسته به دوز کاهش یافت(05/0 p< * و 001/0 p< ***).

شکل 1: سلولهای NALM-6 پس از تیمار 48 ساعته با غلظت 4 میکرومولار MST-312 ، از نظر اتصال به آنکسین-V/ 7AAD مورد بررسی قرار گرفتند. سلولهای آنکسین منفی/7AAD منفی به عنوان سلولهای زنده، سلولهای آنکسین مثبت/ 7AADمنفی به عنوان سلولهای مراحل اولیه آپوپتوز، سلولهای آنکسین مثبت/ 7AAD مثبت به عنوان سلولهای مراحل انتهایی آپوپتوز و سلولهای آنکسین منفی/ 7AAD مثبت به عنوان سلولهای نکروتیک تلقی شدند.

نمودار 3: اثر آپوپتوزی وابسته به دوز MST-312 بر رده سلولی NALM-6 مشاهده شد. MST-312 بر آپوپتوز رده سلولی NALM-6. سلولهای NALM-6 به مدت 48 ساعت با دوزهای مختلف MST-312 تیمار شدند. سپس این سلولها از نظر اتصال به آنکسین-v/7AAD مورد بررسی قرار گرفتند. سلولهای آنکسین منفی/7AAD منفی به عنوان سلولهای زنده، سلولهای آنکسین مثبت/ 7AADمنفی به عنوان سلولهای مراحل اولیه آپوپتوز، سلولهای آنکسین مثبت/ 7AAD مثبت به عنوان سلولهای مراحل انتهایی آپوپتوز و سلولهای آنکسین منفی/7AAD مثبت به عنوان سلولهای نکروتیک تلقی شدند. تقریباً 20% آپوپتوز در مواجهه 48 ساعته با غلظت 4 میکرومولار مشاهده شد. نتیجه از سه مرتبه تکرار نشان داده شده است (05/0 p< * ، 01/0 p< ** و 001/0 p< *** ).
سنجش فعالیت متابولیک سلولهای NALM-6 بعد از تیمار با MST-312 :
به منظور بررسی اثر دوزهای مختلف MST-312 بر روی فعالیت متابولیک سلولهای NALM-6 ، از روش رنگ سنجی MTT استفاده شد(نمودار 2). همان طور که در نمودار 2 مشاهده میشود، فعالیت متابولیک سلولها که نشاندهنده میزان سلولهای زنده است، به طور قابل توجهی در سلولهای تیمار شده با غلظتهای مختلف MST-312 در طول 48 ساعت کاهش یافت که نشاندهنده اثر کشندگی وابسته به دوز MST-312 بر روی این سلولها میباشد. به طوری که در غلظتهای 2، 4 و 8 میکرومولار، میزان فعالیت متابولیک سلولی به ترتیب 6، 69/19 و 9/56 درصد کاهش پیدا کرد که این کاهش در دوزهای 4 و 8 به صورت معناداری نسبت به گروه کنترل کاهش داشت (مقادیر 05/0 p< و 001/0 p< به ترتیب برای دوزهای 4 و 8 میکرومولار MST-312).
سنجش میزان آپوپتوز سلولهای NALM-6 بعد از تیمار با MST-312 :
بعد از تیمار سلولهای NALM-6 با غلظتهای 2، 4 و 8 میکرومولار، از کیت FITC Annexin V Apoptosis Detection Kit II به منظور بررسی اثر MST-312 بر روی آپوپتوز سلولهای NALM-6استفاده شد. سلولهایی که آنکسین و 7-AAD منفی بودند به عنوان سلولهای زنده، سلولهایی که آنکسین مثبت و 7-AAD منفی بودند به عنوان سلولهای مرحله اولیه آپوپتوز، سلولهایی که برای آنکسین و 7-AAD مثبت بودند به عنوان سلولهای مراحل نهایی آپوپتوز و سلولهای آنکسین منفی و 7-AAD مثبت به عنوان سلولهای نکروتیک در نظر گرفته شدند(شکل1).
انکوباسیون کوتاه مدت با MST-312به طور مشخص سلولهای آنکسین مثبت/7AAD منفی و سلولهای آنکسیـن مثبـت/7AAD مثبـت را افـزایش مـیدهد کـــه
به منظور بررسی اثر دوزهای مختلف MST-312 بر روی فعالیت متابولیک سلولهای NALM-6 ، از روش رنگ سنجی MTT استفاده شد(نمودار 2). همان طور که در نمودار 2 مشاهده میشود، فعالیت متابولیک سلولها که نشاندهنده میزان سلولهای زنده است، به طور قابل توجهی در سلولهای تیمار شده با غلظتهای مختلف MST-312 در طول 48 ساعت کاهش یافت که نشاندهنده اثر کشندگی وابسته به دوز MST-312 بر روی این سلولها میباشد. به طوری که در غلظتهای 2، 4 و 8 میکرومولار، میزان فعالیت متابولیک سلولی به ترتیب 6، 69/19 و 9/56 درصد کاهش پیدا کرد که این کاهش در دوزهای 4 و 8 به صورت معناداری نسبت به گروه کنترل کاهش داشت (مقادیر 05/0 p< و 001/0 p< به ترتیب برای دوزهای 4 و 8 میکرومولار MST-312).
سنجش میزان آپوپتوز سلولهای NALM-6 بعد از تیمار با MST-312 :
بعد از تیمار سلولهای NALM-6 با غلظتهای 2، 4 و 8 میکرومولار، از کیت FITC Annexin V Apoptosis Detection Kit II به منظور بررسی اثر MST-312 بر روی آپوپتوز سلولهای NALM-6استفاده شد. سلولهایی که آنکسین و 7-AAD منفی بودند به عنوان سلولهای زنده، سلولهایی که آنکسین مثبت و 7-AAD منفی بودند به عنوان سلولهای مرحله اولیه آپوپتوز، سلولهایی که برای آنکسین و 7-AAD مثبت بودند به عنوان سلولهای مراحل نهایی آپوپتوز و سلولهای آنکسین منفی و 7-AAD مثبت به عنوان سلولهای نکروتیک در نظر گرفته شدند(شکل1).
انکوباسیون کوتاه مدت با MST-312به طور مشخص سلولهای آنکسین مثبت/7AAD منفی و سلولهای آنکسیـن مثبـت/7AAD مثبـت را افـزایش مـیدهد کـــه

نمودار 4: MST-312 ، بیان ژن Bcl2 را کاهش و بیان ژن Bax و نسبت Bax/Bcl2 را افزایش میدهد. پس از 48 ساعت از تیمار سلولهای NALM-6 با غلظت 4 میکرومولار MST-312، RNA سلولها استخراج و cDNA ساخت شد. نتایج Real Time PCR به روش سایبرگرین و با نشانگرهای اختصاصی نشان داده شده است. مقادیر با بیان ژن b actin نرمالیزه شدهاند(01/0 p< ** و 001/0 p< ***).
نشاندهنده تاثیر آپوپتوتیک این دارو بر سلولهای NALM-6 میباشد(نمودار 3). همان طور که در نمودار3 مشاهده میشود، غلظت 4میکرومولار که با آپوپتوز قابل توجهی همراه بود، به عنوان غلظت مورد نظر برای بررسی بیان ژن مورد استفاده قرار گرفت((01/0 p <).
بررسی سطح بیان ژن پیشآپوپتوزی Bax و ژن ضد آپوپتوزی Bcl-2 در سلولهای NALM-6 بعد از تیمار با MST-312 :
به منظور بررسی بیان ژنهای مرتبط با آپوپتوز شامل Bax و Bcl-2 ، از غلظت 4 میکرومولار MST-312 که در بررسی فلوسایتومتری با آپوپتوز قابل توجهی همراه بود استفاده شد. بعد از گذشت 48 ساعت از تیمار سلولهای NALM-6 با غلظت 4 میکرومولار MST-312 ، افزایش 11/2 برابری بیان ژن Bax و کاهش 61/0 برابری بیان ژن Bcl2 در گروه تیمار شده نسبت به گروه کنترل مشاهده شد(01/0 p<). هم چنین نسبت Bax/Bcl-2 افزایش 45/3 برابری(001/0 p<)(نمودار 4). نسبت به گروه کنترل نشان داد که تاییدی بر آپوپتوز القا شده توسط MST-312 در این سلولها است(001/0 p<).
بحث
نتایج مطالعه حاضر نشان داد تیمار 48 ساعته با MST-312 باعث کاهش زندهمانی، کاهش فعالیت متابولیک سلولی و افزایش آپوپتوز سلولی در رده سلولی NALM-6 میشود. در حال حاضر انتخاب یک ویژگی مشخص در سلولهای سرطانی که بتواند به عنوان شاخصی برای درمان هدفمند سرطان مورد استفاده قرار گیرد، از اهمیت به سزایی برخوردار است. یکی از ویژگیهای اختصاصی در اکثر سرطانها، بیان بالای آنزیم تلومراز است که با بازسازی توالی تلومر به سلول قدرت نامیرایی و تکثیر نامحدود میدهد(11). از آن جایی که سلول طبیعی تقریباً فاقد فعالیت آنزیم تلومراز است، در نتیجه استفاده از عوامل مهار کننده تلومراز نمیتواند روی این سلولها اثر ویژهای داشته باشد، در حالی که تلومراز در90%-85% سرطانهای انسانی دوباره فعال میشود و با توجه به نیاز سلولهای سرطانی به سطح بالای آنزیم تلومراز برای ادامه روند تکثیر و نقش به سزای آن در روند تومورزایی، تلومراز میتواند یک هدف مناسب در درمان و مهار سرطان به حساب آید(12). ازجمله در لوسمی لنفوبلاستیک حاد(ALL)، سطح فعالیت آنزیم تلومراز در نمونه مغز استخوان گرفته شده از بیماران در زمان تشخیص یا در زمان عود مجدد، به طور قابل توجهی بالاتر از نمونه افراد طبیعی است و تلومراز به عنوان یک مارکر بدخیمی در لوسمی لنفوبلاستیک حاد تلقی میشود(15، 14). در حال حاضر انواع مهارکنندههای تلومراز به تنهایی یا در ترکیب با داروهای دیگر در فازهای I و II کارآزماییهای بالینی جهت درمان انواع سرطان مورد استفاده قرار میگیرند(23-21). MST-312 که مهارکننده تلومراز شماره 9 نام دارد، یک ترکیب مشتق شده از چای سبز است که به صورت وابسته به دوز باعث مهار آنزیم تلومراز شده و سلول را به سمت مرگ سوق میدهد(17). در مطالعههای پیشین بر روی تومورهای مغزی و ریه، دو اثر متفاوت وابسته به زمان از MST-312 نشان داده شده است. یک اثر کوتاه مدت که به دنبال مواجه کوتاه مدت(برای مثال 72 ساعته) رخ میدهد و همراه با آسیب به DNA ، توقف چرخه سلولی در مراحل G2/M و کاهش زندهمانی سلولی است. این اثر به دلیل تخریب کمپلکس تلومراز و برداشته شدن اثر پوششی تلومراز از روی DNA تلومر و درنتیجه شناسایی تلومر به عنوان یک دورشته آزاد توسط مسیر کینازی ATM ایجاد میشود. اثر طولانی مدت(بیش از 5/1 ماه) به دنبال مواجه طولانی مدت و در اثر عدم جبران طول تلومر توسط تلومراز و کوتاه شدن تلومر رخ میدهد (26-24).
به علاوه مطالعههای قبلی ما در مواجه کوتاه مدت سلولها با MST-312، بیانگر اثر آپوپتوتیک وابسته به دوز و زمان MST-312 بر روی ردههای سلولی میلوم مالتیپل (U266) و لوسمی پرومیلوسیتیک حاد (NB4 و HL60) بود. هم چنین نتیجه بررسی آنالیز چرخه سلولی در سلولهای تیمار شده با MST-312 تاییدکننده توقف چرخه سلولی در مرحله G2/M در ردههای سلولی لوسمی پرومیلوسیتیک حاد بود. علاوه بر این هیچ گونه اثر سایتوتوکسیک و آپوپتوزی از این مهارکننده بر روی جمعیت سلولهای تک هستهای خون محیطی فرد سالم (PBMC) در مواجهه مشابه از نظر غلظت و زمان مشاهده نشد. ایـن موضـوع نشـاندهنـده اثـر اختصاصـی تـومور
MST-312 میباشد(18).
هم چنین بررسی اثر MST-312 بر روی رده سلولی سرطان کولورکتال توسط S سیونگ و همکارانش نشان داد MST-312 باعث کاهش فعالیت متابولیک، کاهش قابل توجه جمعیت سلولهای سرطانی و آپوپتوز سلولی میشود. اثر MST-312 در ترکیب با داروی مورین باعث افزایش قابل توجه تاثیر این دارو بر رده سلولی سرطان کولورکتال شد(27). در مطالعه دیگری که توسط گورانگ و همکارانش انجام شد، MST-312 باعث کاهش قابل توجه فعالیت تلومراز و توقف رشد در سلولهای سرطان سینه شد(28). سیمیا و همکارانش نشان دادند MST-312 باعث کوتاه شدن طول تلومر و مهار رشد سلولهای سرطانی و به عنوان کاندیدی قابل اعتماد برای هدف قرار دادن تلومراز معرفی گردید(29).
در مطالعه حاضر به منظور بررسی اثر مهارکننده تلومراز MST-312 بر روی رده سلولی لوسمی لنفوبلاستیک حاد (NALM-6)، که در مطالعههای گذشته بیان بالایی از آنزیم تلومراز در این رده سلولی گزارش شده است، سلولهای NALM-6 تحت تیمار کوتاه مدت(24، 48 و 72 ساعته) با غلظتهای مختلف MST-312 قرار گرفتند و زندهمانی سلولی در زمانهای معین سنجیده شد(20، 19). با توجه به این که در زمان 24 ساعت اثر قابل توجهی بر روی زندهمانی سلولها مشاهده نشد، هم چنین در زمان 72 ساعت میزان زندهمانی سلولی به صورت چشمگیری کاهش داشت، زمان 48 ساعت به منظور بررسیهای بیشتر انتخاب شد. نتایج ما نشان داد که تیمار کوتاه مدت با MST-312 موجب کاهش زندهمانی سلولها به صورت وابسته به دوز و زمان میشود. هم چنین بررسی فعالیت متابولیک سلولی به دنبال تیمار 48 ساعته با MST-312، به صورت قابل توجهی کاهش مییابد. از طرفی MST-312 باعث القای آپوپتوز در این سلولها شده که این آپوپتوز در سطح ژن با افزایش ژن آپوپتوزی Bax و ژن ضد آپوپتوزی Bcl-2 نیز تایید شد. با توجه به نتایج حاصل از این مطالعه و مطالعههای مشابه در تحت تاثیر قرار دادن سلولهای سرطانی به صورت اختصاصی به واسطه مهارکنندههای تلومراز و از جمله MST-312 و هم چنین با توجه به نقش موثر تلومراز در روند بدخیمیها از جمله لوسمی لنفوبلاستیک حاد، MST-312 میتواند به عنوان کاندیدی در درمان ALL پیشنهاد شود.
نتیجهگیری
تیمار کوتاه مدت سلولهــای سرطانـی NALM-6 بـا
MST-312 باعث کاهش زندهمانی، فعالیت متابولیک و افزایش آپوپتوز سلولی میشود. با توجه به نتایج این مطالعه، MST-312 با مهار تلومراز و القای آپوپتوز در سلولهای NALM-6 میتواند به عنوان کاندیدی در درمان
ALL پیشنهاد شود.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |






