جلد 15، شماره 2 - ( تابستان 1397 )
جلد 15 شماره 2 صفحات 143-133 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Dehghan Nayeri N, Eshghi P, Goudarzi pour K, Darvishi M, Gharehbaghian َ. The Significance of Ubiquitin-Proteasome Pathway in Glucocorticoid Resistance Development in Acute Lymphoblastic Leukemia. bloodj 2018; 15 (2) :133-143
URL: http://bloodjournal.ir/article-1-1179-fa.html
URL: http://bloodjournal.ir/article-1-1179-fa.html
دهقان نیری نسرین، عشقی پیمان، گودرزی پور کوروش، درویشی مینا، قره باغیان احمد. اهمیت مسیر پروتئازوم ـ یوبی کوئیتین در ایجاد مقاومت به گلوکوکورتیکوئیدها در لوسمی لنفوبلاستیک حاد. فصلنامه پژوهشی خون. 1397; 15 (2) :133-143
استاد دانشکده پیراپزشکی دانشگاه علوم پزشکی شهید بهشتی ـ مرکز تحقیقات بیماری های خونی مادرزادی کودکان دانشگاه علوم پزشکی شهید بهشتی
واژههای کلیدی: کلمات کلیدی: لوسمی لنفوبلاستیک حاد، مقاومت دارویی، گلوکوکورتیکوئیدها، نشانگرهای زیستی
متن کامل [PDF 1112 kb]
(3345 دریافت)
| چکیده (HTML) (5821 مشاهده)
مقدمه
علیرغم این که امروزه میزان بقاء در مبتلایان به لوسمی لنفوبلاستیک حاد به بیش از حدود 80% رسیده است، اما هنوز 20%-15% از بیماران با دستورالعملهای درمانی فعلی به درمان پاسخگو نیستند(2، 1). درمان در بیماران تازه تشخیص داده شده معمولاً توسط رژیمهای شیمیدرمانی ترکیبی شامل گلوکوکورتیکوئیدها انجام میگیرد.
گلوکوکورتیکوئیدها به طور گستردهای برای درمان انواع بیماریها مورد استفاده قرار میگیرند و چندین دهه است که در انکولوژی بالینی با ارزش و مورد استفاده هستند(3). گلوکوکورتیکوئیدها باعث اختلال در چرخه سلولی شده و سبب القاء مرگ سلولی در سلولهای خونی از طریق فعالسازی ژنهای القاء کننده آپوپتوز و مهار رونویسی ژنهای بقا میگردند، از این رو آنها به بخش جدایی ناپذیر رژیمهای شیمیدرمانی برای سرطانهای لنفوئیدی به ویژه ALL تبدیل شدهاند(5، 4). پردنیزولون و دگزامتازون معمولترین آنالوگهای مصنوعی گلوکوکورتیکوئیدها هستند و در مراحل مختلف درمان ALL مورد استفاده قرار میگیرند(6). پاسخ به گلـوکوکورتیکوئید، یکی از فاکتورهای مهم برای پیشبینـی نتیجه درمان و عوارض جانبی بلند مدت ناشی از شیمی درمانی در ALL دوران کودکی محسوب میشود(7). تا به امروز، مکانیسم دقیق این که پردنیزولون چگونه سلولهای ایمنی و یا سلولهای لوسمی را هدف قرار میدهد، کاملاً مشخص نشده است. اثبات شده است که پردنیزولون میتواند به دلیل ساختار چربی دوست خود به طور غیر فعال از غشای سلولی عبور کند و به گیرنده گلوکوکورتیکوئیدی سیتوزولی(GR/NR3C1 = nuclear receptor subfamily 3 group C member 1) متصل شود. گلوکوکورتیکوئیدها عملکردشان را از طریق اتصال به گیرندههای گلوکوکورتیکوئیدی معروف به GR (Glucocorticoid receptor) یاNR3C1 اعمال میکنند. مطالعهها نشان داده است که بیان غیرطبیعی ایزوفرمهای GR و ژنهای پاسخ به گلوکوکورتیکوئید و هم چنین پلیمورفیسمهای ژنتیکی و یا مسیر سیگنالینگ پایین دست NR3C1 میتوانند در مقاومت به درمان درگیر باشند(8).
با توجه به اهمیت پاسخ به گلوکوکورتیکوئیدها در تعیین پیشآگهی بیماران، شناسایی پنل نشانگرهای زیستی پیشبینی کننده حساسیت یا مقاومت به درمان با گلوکوکورتیکوئیدها در روز تشخیص بیماری، میتواند آزمایشی ارزشمند در کنار سایر آزمایشهای تعیینکننده فاکتورهای خطر باشد(9). علاوه بر این، استفاده از شبکه برهمکنش پروتئین- پروتئین و آنالیز ویژگیهای ساختاری و عملکردی پروتئینها میتواند به فهم بهتر بیولوژی بیماری، درک بهتر مکانیسمهای مولکولی درگیر و هم چنین معرفی نشانگرهای زیستی کمک کند. از اینرو در این مطالعه به شناسایی نشانگرهای پروتئینی پیشآگهیدهنده مقاومت درمانی به گلوکوکورتیکوئیدها در لوسمی لنفوبلاستیک حاد پرداخته شده است. در این پژوهش، از روش پروتئومیکی و بیوانفورماتیکی به منظور کشف مکانیسمهای دخیل در مقاومت و بررسی تعامل پروتئینهای تغییر بیان یافته استفاده شده است.
مواد و روشها
کشت سلولی:
در مطالعههای قبلی تکمیل کننده مطالعه حاضر، طی یک مطالعه مداخلهای، از رده سلولی Nalm-6 به عنوان رده سلولی حساس به گلوکوکورتیکوئیدها و Reh به عنوان رده سلولی مقاوم به گلوکوکورتیکوئیدها استفاده شده بود. در این مطالعه تجربی، سلولها از بانک سلولی انستیتو پاستور ایران (تهران، ایران) تهیه شدند. هر یک از ردههای سلولی به تعداد 300000 سلول در هر میلی لیتر محیط کشت RPMI-1640 (جیبکو، آمریکا) و در فلاسکهای 175 میلیلیتری با دوز 1 میکرومولار پردنیزولون و 200 نانومولار دگزامتازون (آمریکا، سیگما، 4902 D) به مدت 48 ساعت تیمار شدند. سپس سلولهای تیمار شده مورد آنالیز پروتئومیکی قرار گرفتند(10، 9).
آنالیز پروتئومیکی:
پس از استخراج مخلوط پروتئینی از سلولها، جداسازی پروتئینها با استفاده از روش الکتروفورز دو بعدی بر اساس نقطه ایزوالکتریک صورت گرفت. سپس با استفاده از نرم افزار Image Master، پروتئینهای دارای تغییر بیان قابل توجه قبل و بعد از تیمار با دارو با استفاده از روش ژل الکتروفورز دو بعدی جداسازی شدند. لکههای پروتئینی از ژل خارج شده و مورد هضم آنزیمی با تریپسین قرار گرفتند.
سپس مخلوط پپتیدی حاصل به وسیله طیف سنجی جرمی بررسی شد. جرم پپتیدهای حاصل از هضم آنزیمی با جرم تئوریکی پپتیدهای حاصل از هضم فرضی پروتئین های موجود در بانک اطلاعات مقایسه شد. اگر تعداد کافی از پپتیدهای موجود در طیف واقعی با پپتیدهای حاصل از هضم تئوریکی از نظر جرمی هم پوشانی داشته باشند، مـیتوان پـروتئین را با قطعیت شناسایی کرد(10، 9).
آنالیز شبکه پروتئینی:
در این مطالعه پروتئینهای شناسایی شده در مطالعههای
پیشین که توسط همین گروه انجام شده، استخراج شد و سپس شبکه برهمکنش پروتئینی مورد ارزیابی و تحلیل قرار گرفت. برای این منظور از روش شبکه ژنی و ابزار جستجوی بازیابی تعامل ژنها و پروتئینها و از پایگاه داده آنلاین STRING نسخه 5/10 که یک پایگاه داده از اثرات متقابل پروتئینی شناخته و پیشبینی شده است، استفاده شد. اطلاعات به دست آمده از این پژوهش در قالب شبکه برهمکنش پروتئین- پروتئین ارائه شد.
یافتهها
آنالیز پروتئومیکی:
پروتئینهای شناسایی شده، پروتئینهایی هستند که طی تیمار سلولهای لوسمی لنفوبلاستیک حاد (Reh و Nalm-6) با دو داروی گلوکوکورتیکوئید(پردنیزولون و دگزامتازون) تغییر بیان داشتند(جدول 1).
جدول 1: پروتئینهای شناسایی شده در سلولهای Reh و Nalm-6 تیمار شده با داروهای پردنیزلون و دگزامتازون به روش طیف سنجی جرمی
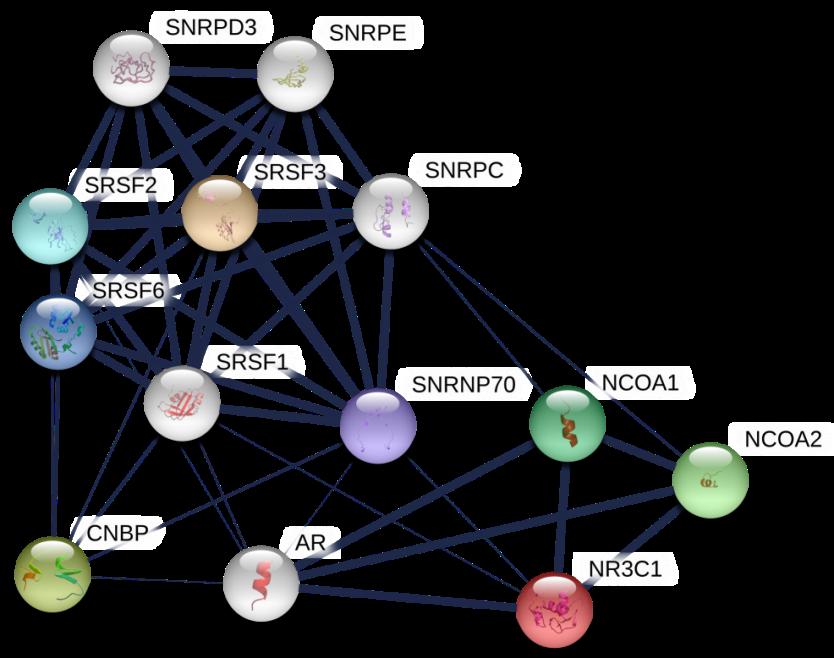
شکل 1: شبکه برهمکنش پروتئینی SRSF3 و CNBP با NR3C1. سطح بیان هر دو پروتئین در سلولهای Reh تیمار شده با پردنیزلون در مقایسه با نمونههای کنترل کاهش بیان داشته است. SRSF3 در کنترل سیکل سلولی، پیرایش RNA و بیان ژن نقش دارد. CNBP نیز دارای فعالیت چاپرونی است. با توجه به نقش این پروتئینها به نظر میرسد سطح آستانهای از این پروتئینها برای حفظ تعادل تکثیر و آپوپتوز لازم است. با توجه به ارتباط این دو پروتئین با NR3C1 به عنوان گیرنده GR، نقش احتمالی این پروتئینها و فرآیند پیرایش RNA در مقاومت به GR در سلول Reh نیز مطرح است.

شکل 2: A) شبکه برهمکنش پروتئینی VDAC1/NR3C1. کاهش بیان VDAC1 بعد از تیمار سلول Reh با دگزامتازون و در نتیجه کاهش برهمکنش این پروتئین با BCL2 باعث مقاومت این سلول به آپوپتوز شده است. B) شبکه برهمکنش پروتئینی SNX3/NR3C1. SNX3 در فرآیند اندوسیتوز و نقل و انتقال پروتئینها دخالت دارد. اختلال عملکرد SNX3 میتواند منجر به تغییر رسپتورهای سطح سلولی و اختلال در سیگنالینگ و تومورژنز شود. در این مطالعه کاهش بیان SNX3 بعد از تیمار سلول Reh با دگزامتازون مشاهده شد. با توجه به ارتباط ایـن پروتئین با NR3C1 ، نقش احتمالی SNX3 در مقاومت دارویی نیز مطرح می باشد.C ) شبکه برهم کنش پروتئینی PFDN6/NR3C1. PFDN6 در عملکرد توبولینها حین میتوز و تنظیم چرخه سلولی نقش دارد. با توجه به کاهش بیان PFDN6 بعد از تیمار سلول Reh با دگزامتازون و ارتباط آن با NR3C1 به عنوان گیرنده GR احتمال ارتباط آن با مقاومت دارویی نیز مطرح است.
در این مطالعه با توجه به اهمیت مسیرهای سیگنالینگ گیرنده GR در القای مقاومت، به بررسی اینتراکشنهای پروتئینی گیرنده GR (NR3C1) با سایر تارگتهای دارویی پردنیزولون و دگزامتازون پرداخته شده است(4).
شبکه اینتراکشن پروتئینی تارگتهای دارویی پردنیزولون در رده سلولی Reh و NR3C1 :
در این بخش از پژوهش حاضر، نتایج پروتئومیکی بر اساس تغییرات در سطوح بیان پروتئینها در سلول Reh ، به عنوان یک مدل از بیمارانی که پاسخ ضعیف به پردنیزولون میدهند(بیماران با خطر بالا)، قبل و بعد از تیمار با پردنیزولون گزارش شد. از ترکیب دادههای حاصل از آنالیز پروتئوم با اطلاعات بر همکنش پروتئینـ پروتئین،
جهت تشخیص مسیر سیگنالینگ دخیل در مقاومت پردنیزولون بهره گرفته شد(شکل 1).
شبکه اینتراکشن پروتئینی تارگتهای دارویی دگزامتازون در رده سلولی Reh و NR3C1 :
در این بخش از پژوهش حاضر، نتایج پروتئومیکی بر اساس تغییرات در سطوح بیان پروتئینها در سلول Reh، به عنوان یک مدل از بیمارانی که پاسخ ضعیف به دگزامتازون نشان میدهند(بیماران با خطر بالا)، قبل و بعد از تیمار با دگزامتازون گزارش شده است. از ترکیب دادههای حاصل از آنالیز پروتئوم با اطلاعات پروتئین ـ پروتئین اینتراکشن، جهت تشخیص مسیر سیگنالینگ دخیل در مقاومت دگزامتازون بهره گرفته شد(شکل 2).

شکل 3: A) شبکه برهم کنش پروتئینی PSMB2/NR3C1. بیان PSMB2 در سلولهای Nalm-6 تیمار شده با پردنیزلون در مقایسه با نمونه کنترل کاهش داشته است. PSMB2 جزئی از پروتئوزوم بوده و این سیستم به عنوان یک تنظیم کننده مسیر های متابولیکی و چرخه سلولی است. ارتباط این پروتئین با گیرنده GR، NR3C1 در تصویر فوق نشان داده شده است. B) شبکه برهم کنش پروتئینی STMN1/NR3C1. بیان STMN1 در سلول های Nalm-6 تیمار شده با پردنیزولون در مقایسه با نمونه کنترل کاهش داشته است. STMN1 تنظیمکننده میکروتوبولها حین تقسیم سلولی و تحرک است. ارتباط این پروتئین با گیرنده GR، NR3C1 در تصویر فوق نشان داده شده است. C) شبکه برهمکنش پروتئینی DUT/NR3C1. بیان DUT در سلولهای Nalm-6 تیمار شده با پردنیزولون در مقایسه با نمونه کنترل افزایش داشته است. DUT آنزیم ضروری در متابولیسم نوکلئوتیدهاست. افزایش بیان آن نیز به عنوان یک مکانیسم مقاومت دارویی شناخته شده است. D) شبکه برهمکنش پروتئینی PPP4R4/NR3C1. بیان PPP4R4 در سلولهای Nalm-6 تیمار شده با پردنیزولون در مقایسه با نمونه کنترل افزایش داشته است. PPP4R4 نیز در فرآیند آپوپتوز و سازماندهی میکروتوبولها نقش دارد. هم چنین در تنظیم سیگنالینگ سایتوکاینها و بقای لنفوسیت نیز دخیل است. دادههای این مطالعه نشان میدهد پروتئین PPP4R4 با NR3C1 به عنوان گیرنده GR مرتبط است.

شکل 4: A) شبکه برهم کنش پروتئینی CAPZB/CAPZA1/NR3C1. بیان این دو پروتئین در سلول های Nalm-6 تیمار شده با دگزامتازون در مقایسه با نمونه کنترل کاهش داشته است. CAP ها برای ایجاد ساختار اسکلت سلولی پایدار لازم اند. در تصویر فوق ارتباط این پروتئین با NR3C1 نشان داده شده است. B) شبکه برهم کنش پروتئینی CLIC1/NR3C1. بیان CLIC1 در سلول های Nalm-6 تیمار شده با دگزامتازون در مقایسه با نمونه کنترل کاهش داشته است. CLIC1 نقش مهمی در تنظیم پتانسیل غشا، چرخه سلولی و تکثیر و تمایز آن ایفا می کند. ارتباط این پروتئین با NR3C1 با استفاده از پایگاه داده STRING در تصویر فوق نشان داده شده است. C) شبکه برهم کنش پروتئینی PNP/NR3C1. بیان PNP در سلول های Nalm-6 تیمار شده با دگزامتازون در مقایسه با نمونه کنترل کاهش داشته است. PNP در فسفریلاسیون نوکلئوزید های پورین نقش دارد. اختلال در این آنزیم بر بقا و عملکرد سلول تاثیر می گذارد. ارتباط این پروتئین با NR3C1 در تصویر فوق نشان داده شده است. D) شبکه برهم کنش پروتئینی PSME1/NR3C1. بیان PSME1 در سلول های Nalm-6 تیمار شده با دگزامتازون در مقایسه با نمونه کنترل کاهش داشته است. PSME1 نیز از اجزای پروتئازوم بوده و اختلال در بیان آن بر بقای سلول اثر دارد. افزایش بیان آن مارکر مهم مقاومت دارویی است. در تصویر فوق ارتباط این پروتئین با NR3C1 نشان داده شده است.

شکل 5: شبکه بر هم کنش 14 پروتئین شناسایی شده در اثر تیمار سلولهای لوسمی لنفوبلاستیک حاد (Reh و Nalm-6) با گلوکوکورتیکوئیدها. گلوکوکورتیکوئیدها ترکیباتی با اهداف چندگانه هستند که اثرات ضد سرطانی آنها به مسیر پروتئازوم- یوبی کوئیتین مرتبط است. نتایج آنالیز شبکه بر هم کنش پروتئینی هم چنین بیانگر این ادعاست که احتمالاً یوبی کوئیتینه شدن، مکانسیم مولکولی دخیل در تعیین پاسخ به درمان در ALL است.
شبکه اینتراکشن پروتئینی تارگتهای دارویی پردنیزولون در رده سلولی Nalm-6 و NR3C1 :
در این بخش از پژوهش حاضر، نتایج پروتئومیکی بر اساس تغییرات در سطوح بیان پروتئینها در سلولهای Nalm-6 ، به عنوان یک مدل از بیمارانی که نه حساسیت و نه مقاومت مطلق به پردنیزولون را نشان دادند، (بیماران با خطر متوسط)، قبل و بعد از تیمار با پردنیزولون گزارش شد. از ترکیب دادههای حاصل از آنالیز پروتئوم با اطلاعات بر همکنش پروتئین - پروتئین، جهت تشخیص مسیر سیگنالینگ دخیل در مقاومت پردنیزولون بهره گرفته شد (شکل 3).
شبکه اینتراکشن پروتئینی تارگتهای دارویی دگزامتازون در رده سلولی Nalm-6 و NR3C1 :
در این بخش از پژوهش حاضر، نتایج پروتئومیکی بر
اساس تغییرات در سطوح بیان پروتئینها در سلولهای Nalm-6، به عنوان یک مدل از بیمارانی که حساسیت به پردنیزولون را نشان دادند(بیماران با خطر پایین)، قبل و بعد از تیمار با دگزامتازون گزارش شد. از ترکیب دادههای حاصل از آنالیز پروتئوم با اطلاعات بر همکنش پروتئین ـ پروتئین، جهت تشخیص مسیر سیگنالینگ دخیل در مقاومت دگزامتازون بهره گرفته شد(شکل 4).
در مجموع مطالعه شبکه برهمکنش پروتئینی نشان داد که این 14 پروتئین میتوانند از طریق پروتئین ubiquitin-conjugating enzyme (UBC) با NR3C1 به عنوان گیرنده گلوکوکورتیکوئیدی(GR)، برهمکنش داشته باشند. این موضوع نشاندهنده نقش این پروتئین در مسیر پروتئازوم ـ یوبی کوئیتین است که احتمالاً میتواند نقش مهمی در مکانیسم مقاومت به GC در ALL ایفا کند(شکل 5).
بحث
یافتهها نشان داده است که 14 پروتئین تغییر بیان یافته که در مطالعههای قبلی در زمینه مقاومت سلولهای لوسمی لنفوبلاستیک حاد به GC شناسایی شدند، در مسیرهای بیولوژیکی مهمی از جمله مسیر پروتئازوم - یوبیکوئیتین نقش ایفا میکنند. در طی سالهای اخیر، تحقیقـات بسیـاری بـرای روشـن شدن و تعدیل مقاومت گلوکوکورتیکوئیدی صورت گرفته است. اولین مطالعهها بر روی کلیرنس پردنیزولون و یا بیان ناقص گیرنده گلوکوکورتیکوئیدی معطوف شد. سطح بیان واریانتهای مختلف هم در سطح پایه و هم بعد از هشت ساعت قرارگیری در معرض پردنیزولون اندازهگیری شد. نتایج نشان داد این مقدار با مقاومت پردنیزولون در شرایط in vitro در نمونههای کودکان مبتلا به ALL ارتباط نداشت(11). علاوه بر این، مشخص شد پلیمورفیسمها و یا جهشها در ژن GR، از مشارکتکنندگان اصلی مقاومت گلوکوکورتیکوئیدی در کودکان مبتلا به ALL نمیباشند(12). مطالعهها نشان داده است که مسیرهای سیگنالینگ درگیر در مسیرهای پایین دست یا بالادست گیرنده گلوکوکورتیکوئیدی در ایجاد مقاومت به گلوکوکورتیکوئیدها نقش مهمی دارند. به طور کلی این اطلاعات نشان میدهد که مقاومت به گلوکوکورتیکوئیدها میتواند ناشی از مکانیسمهای مؤثر بر مسیر سیگنالینگ درونسلولی گیرنده GR باشد(14، 13، 4). لذا با یافتن مارکرهای مقاومت یا حساسیت به پردنیزولون و دگزامتازون و ارتباط آنها با NR3C1 به عنوان گیرنده GR، میتوان مسیرهای سیگنالینگ درون سلولی پاییندست را شناسایی نمود. ابزارهای پروتئومیکی دریچهای جدید را در شناسایی نشانگرهای زیستی مقاومت دارویی با هدف بهبود درمان فراهم میکنند. از این رو در مطالعههای پیشین گروه حاضر، به ارزیابی اهداف دارویی گلوکوکورتیکوئیدها شامل پردنیزولون و دگزامتازون در ALL به روش پروتئومیکی پرداخته شد(10، 9).
بررسی پروتئومیکی سلولهای تیمار شده با گلوکوکورتیکوئیدها در مقایسه با کنترل نشان از تغییر بیان 28 لکه پروتئینی داشت، که از این تعداد تنها 14 پروتئین به روش طیفسنجی جرمی مورد شناسایی قرار گرفتند(جدول 1). پروتئینهای شناسایی شده، در مسیرها و فرآیندهای پیرایش جایگزین ( SRSF3 = Serine/Argenin-Rich Splicing Factor 3 و CNBP = CCHC-type zinc finger nucleic acid binding protein)، مسیر پروتئازوم (PSMB2 = Proteasome subunit beta 2 ، PSME1 = Proteasome activator complex subunit 1 و STMN1 = Stathmin 1)، مسیر سازماندهی اسکلت سلولی (CAPZA1 = F-actin-capping protein subunit alpha-1، CAPZB ، PPP4C ، STMN و PFDN6)، ترانسپورترها(VDAC1، CLIC1 و SNX3) و متابولیسم نوکلئوتیدها(DUT و PNP) مشارکت داشتند(25-15). در این مطالعه با توجه به اهمیت مسیرهای سیگنالینگ گیرنده GR در القای مقاومت، به بررسی اینتراکشنهای پروتئینی گیرنده GR (NR3C1) با سایر تارگتهای دارویی پردنیزولون و دگزامتازون پرداخته شد.
سطح بیان دو پروتئین SRSF3 و CNBP در سلول Reh تیمارشده با پردنیزولون کاهش داشته است(جدول 1). نتایج حاصل از بررسی برهمکنش پروتئین - پروتئین هر دو پروتئین فوق با NR3C1 به عنوان گیرنده هدف پردنیزلون، نقش مسیر سیگنالینگ اسپلایزوم را آشکار نمود(شکل 1). به عبارتی پیرایش جایگزین در تنظیم GR ها از جمله NR3C1 اهمیت زیادی دارد و از طرفی SRSF3 و CNBP در پیرایش جایگزین نقش کلیدی دارند. اختلال در پیرایش، واریانتهایی را تولید میکند که در ابعاد مختلف متابولیسم سرطان، متاستاز، آنژیوژنز و مقاومت دارویی دخیل هستند(26). از طرفی داروهای شیمیدرمانی نیز میتوانند فرآیندهای پیرایش جایگزین را تغییر دهند(27).
سطح بیان سه پروتئین VDAC1، SNX3و PFDN6 در سلول Reh تیمارشده با دگزامتازون کاهش معنادار داشته است(جدول 1). به علاوه نتایج حاصل از بررسی برهمکنش پروتئین - پروتئین، برهمکنش BCL2-VDAC1-UBC-NR3C1 را نشان داده است. به عبارتی VDAC1 با پروتئینهای تنظیمکننده آپوپتوز و هم چنین گیرنده هدف داروی دگزامتازون، NR3C1، ارتباط دارد(شکل A2). این یافتهها پیشنهاد میدهد که القای افزایش بیان VDAC1 میتواند به عنوان یک مکانیسم القای آپوپتوز در تحقیقات مرتبط با مقاومت به داروی دگزامتازون استفاده شود. هم چنین بررسیها نشان داد که NR3C1 احتمالاً توسط عملکرد مرتبسازی(sorting function) SNX3 تنظیم میشود، بنابراین این پروتئین میتواند به عنوان کاندید بالقوه ایجاد مقاومت در این مسیر محسوب شود (شکل B2). آنالیز STRING نشان داد که اهداف پاییندست مسیر وابسته به PFDN6 شامل PFDN6-PFDN5-UBC-HSP90-NR3C1 ممکن است به دلیل اختلال عملکرد در پرفولدین (Prefoldin) در ایجاد ALL دخالت داشته باشند (شکل C2). پرفولدین دارای عملکردهایی همچون تاخوردگی پروتئین، بازسازی اسکلت سلولی و تنظیم چرخه سلولی میباشد(20).
هم چنین سطح بیان پروتئینهای PSMB2 و STMN1 در سلول Nalm-6 تیمار شده با پردنیزلون نسبت به کنترل کاهش داشته است و در مقابل دو پروتئین PPP4R4 و DUT افزایش بیان نشان دادند(جدول 1). PSMB2 جزئی از پروتئوزوم بوده و این سیستم به عنوان یک تنظیمکننده مسیرهای متابولیکی و چرخه سلولی است. STMN1 نیز تنظیمکننده میکروتوبولها حین تقسیم سلولی و تحرک است(18، 17). شبکه برهمکنش این پروتئینها و ارتباط آنها در مسیرهای پیامرسانی القاکننده مقاومت به GR مورد بررسی قرار گرفت. بین PSMB2 و STMN1 با NR3C1 نیز ارتباط معناداری برقرار است که در شکل 3 نشان داده شده است. DUT آنزیم ضروری در متابولیسم نوکلئوتیدها است. افزایش بیان آن نیز به عنوان یک مکانیسم مقاومت دارویی شناخته شده است(25). PPP4R4 نیز در فرآیند آپوپتوز و سازماندهی میکروتوبولها نقش دارد. هم چنین در تنظیم سیگنالینگ سایتوکاینها و بقای لنفوسیت نیز دخیل است(20). بررسی شبکه برهمکنش پروتئین DUT نیز ارتباط بین DUT/UBC/NR3C1 را نشان داد (شکل C3). علاوه بر این، ارتباط بین PPP4R4-PPP4C-JUN-NR3C1 هم نشاندهنده بر همکنش پروتئین PPP4R4 با NR3C1 میباشد(شکل D3).
سطح بیان پنج پروتئین به نامهای CAPZA1، CAPZB، PNP، CLIC1و PSME1 در سلول Nalm-6 تیمار شده با دگزامتازون نسبت به کنترل کاهش داشته است(جدول 1). CAP ها برای ایجاد ساختار اسکلت سلولی پایدار لازماند (19). CLIC1 نقش مهمی در تنظیم پتانسیل غشا، چرخه سلولی و تکثیر و تمایز آن ایفا میکند(21). PNP در فسفریلاسیون نوکلئوزیدهای پورین نقش دارد. اختلال در این آنزیم بر بقا و عملکرد سلول تاثیر میگذارد(24). PSME1 نیز از اجزای پروتئازوم بوده و اختلال در بیان آن بر بقای سلول اثر دارد. افزایش بیان آن به عنوان مارکر مهم مقاومت دارویی مطرح است(18). نتایج حاصل از بررسی برهمکنش پروتئین - پروتئین، ارتباط بین CAPZA1 و CAPZB با NR3C1 را نشان داد(شکل A4). هم چنین برهمکنش پروتئینهای CLIC1، PNP و PSME1 با NR3C1 نیز در شکل 4 نشان داده شده است.
در مجموع به نظر میرسد GC ها ترکیباتی با اهداف متعدد هستند که اثرات ضدسرطانی آنها با مسیر پروتئازوم- یوبیکوئیتین مرتبط است. مطالعههای پیشین حاکی از این است که یوبیکوئیتیناسیون انکوژنها و ژنهای سرکوبگر تومور از ویژگیهای مهم تنظیم در سلولهای انسانی طبیعی و بدخیم است. UBC در برخی سرطانها مثل سرطان تخمدان به عنوان تارگت مقاومت دارویی معرفی شده است(28). به طور کلی شناخت بیشتر
اجزای مسیر پیامرسانی وابسته و نقش آنها در ادامه تکثیر سلولهای سرطانی در حضور GC ضروری است. هم چنین کشف عامل یا عوامل دخیل در افزایش بیان و افزایش فعالیت این اجزا در طی کسب مقاومت به GC، راهگشای ما در مسیر توسعه راهکارهای درمانی اثر بخشتر خواهد شد.
نتیجهگیری
یافتههای این مطالعه نشان میدهد که 14 پروتئین تغییر بیان یافته که در مطالعههای پیشین در زمینه مقاومت سلولهای لوسمی لنفوبلاستیک حاد به GC شناسایی شدند، در مسیرهای بیولوژیکی مهمی از جمله مسیر پروتئازوم- یوبیکوئیتین نقش مشترک دارند. لازم است مطالعههای بیشتری به منظور بررسی بیان پروتئینهای دخیل در مسیر پروتئازوم-یوبیکوئیتین و نقش بیان یا عدم بیان آنها بر مقاومت به GC و یا به عنوان اهداف بالقوه نشاندهنده پیشآگهی و درمان ALL صورت پذیرد.
متن کامل: (8430 مشاهده)
اهمیت مسیر پروتئازوم ـ یوبی کوئیتین در ایجاد مقاومت به گلوکوکورتیکوئیدها
در لوسمی لنفوبلاستیک حاد
نسرین دهقان نیری1، پیمان عشقی2، کوروش گودرزیپور3، مینا درویشی4، احمد قرهباغیان5
چکیده
سابقه و هدف
لوسمی لنفوبلاستیک حاد(ALL)، شایعترین سرطان در سنین کودکی محسوب میشود. حدود 20% کودکان مبتلا، به داروهای موجود مقاومت نشان میدهند. یکی از عوامل اصلی پیشآگهی ضعیف در بیمارانی که دچار عود شدند، مقاومت به گلوکوکورتیکوئیدها میباشد. لذا شناسایی نشانگرهای مقاومت یا حساسیت به گلوکوکورتیکوئیدها و بررسی چگونگی تعامل این پروتئینها میتواند ابزاری مفید به منظور بهبود استراتژیهای تعیین پیشآگهی بیماری باشد.
مواد و روشها
در یک مطالعه تجربی، شبکه تعامل پروتئینی بین 14 پروتئین شناسایی شده در پروتئوم سلولهای ALL تیمار شده با گلوکوکورتیکوئیدها بررسی شدند. برای این منظور از روش شبکه ژنی و پایگاه داده آنلاینSTRING ، به عنوان ابزار جستجوی بازیابی تعامل ژنها و پروتئینها، استفاده گردید.
یافتهها
بـا استفـاده از روشهای پروتئومیکی، 14 پروتئین تغییر بیان یافته به نامهای SRSF3، CNBP،VDAC1 ، SNX3 ، PFDN6،PSMB2 ،STMN1 ، PPP4R4،DUT ،CAPZA1 ،CAPZB ، PNP،CLIC1 و PSME1 بعد از تیمار با پردنیزلون و دگزامتازون در دو رده سلولی حساس(Nalm-6) و مقاوم(Reh) به گلوکوکورتیکوئیدها شناسایی شدند. ارتباط بین پروتئینهای مذکور در پایگاه داده STRING مورد تجزیه و تحلیل قرار گرفت.
نتیجه گیری
به طور کلی یافتهها نشان میدهد که مسیر پروتئازوم- یوبیکوئیتین نقش عملکردی در القاء مکانیسم مقاومت به گلوکوکورتیکوئید در ALL ایفا میکند. لذا بررسی پروتئینهای کلیدی کنترلکننده مسیر مذکور میتواند نقش مهمی در روشنسازی مکانیسم القاء مقاومت به گلوکوکورتیکوئیدها و به تبع آن پیشآگهی بیماری داشته باشد.
کلمات کلیدی: لوسمی لنفوبلاستیک حاد، مقاومت دارویی، گلوکوکورتیکوئیدها، نشانگرهای زیستی
تاریخ دریافت: 15/11/96
تاریخ پذیرش : 19/2 /97
1- PhD پروتئومیکس ـ دانشکده پیراپزشکی دانشگاه علوم پزشکی شهید بهشتی ـ تهران ـ ایران
2- فوق تخصص هماتولوژی و انکولوژی کودکان ـ استاد مرکز تحقیقات بیماریهای خونی مادرزادی کودکان ـ بیمارستان کودکان مفید ـ دانشگاه علوم پزشکی شهید بهشتی ـ تهران ـ ایران
3- فوق تخصص هماتولوژی و انکولوژی کودکان ـ استادیار مرکز تحقیقات بیماریهای خونی مادرزادی کودکان ـ بیمارستان کودکان مفید ـ دانشگاه علوم پزشکی شهید بهشتی ـ تهران ـ ایران
4- کارشناس ارشد خونشناسی آزمایشگاهی و بانک خون ـ دانشکده پیراپزشکی دانشگاه علوم پزشکی شهید بهشتی ـ تهران ـ ایران
5- مؤلف مسئول: PhD ایمونوهماتولوژی بالینی ـ استاد دانشکده پیراپزشکی دانشگاه علوم پزشکی شهید بهشتی ـ مرکز تحقیقات بیماریهای خونی مادرزادی کودکان دانشگاه علوم پزشکی شهید بهشتی ـ تهران ـ ایران ـ کد پستی: 49941-49158
در لوسمی لنفوبلاستیک حاد
نسرین دهقان نیری1، پیمان عشقی2، کوروش گودرزیپور3، مینا درویشی4، احمد قرهباغیان5
چکیده
سابقه و هدف
لوسمی لنفوبلاستیک حاد(ALL)، شایعترین سرطان در سنین کودکی محسوب میشود. حدود 20% کودکان مبتلا، به داروهای موجود مقاومت نشان میدهند. یکی از عوامل اصلی پیشآگهی ضعیف در بیمارانی که دچار عود شدند، مقاومت به گلوکوکورتیکوئیدها میباشد. لذا شناسایی نشانگرهای مقاومت یا حساسیت به گلوکوکورتیکوئیدها و بررسی چگونگی تعامل این پروتئینها میتواند ابزاری مفید به منظور بهبود استراتژیهای تعیین پیشآگهی بیماری باشد.
مواد و روشها
در یک مطالعه تجربی، شبکه تعامل پروتئینی بین 14 پروتئین شناسایی شده در پروتئوم سلولهای ALL تیمار شده با گلوکوکورتیکوئیدها بررسی شدند. برای این منظور از روش شبکه ژنی و پایگاه داده آنلاینSTRING ، به عنوان ابزار جستجوی بازیابی تعامل ژنها و پروتئینها، استفاده گردید.
یافتهها
بـا استفـاده از روشهای پروتئومیکی، 14 پروتئین تغییر بیان یافته به نامهای SRSF3، CNBP،VDAC1 ، SNX3 ، PFDN6،PSMB2 ،STMN1 ، PPP4R4،DUT ،CAPZA1 ،CAPZB ، PNP،CLIC1 و PSME1 بعد از تیمار با پردنیزلون و دگزامتازون در دو رده سلولی حساس(Nalm-6) و مقاوم(Reh) به گلوکوکورتیکوئیدها شناسایی شدند. ارتباط بین پروتئینهای مذکور در پایگاه داده STRING مورد تجزیه و تحلیل قرار گرفت.
نتیجه گیری
به طور کلی یافتهها نشان میدهد که مسیر پروتئازوم- یوبیکوئیتین نقش عملکردی در القاء مکانیسم مقاومت به گلوکوکورتیکوئید در ALL ایفا میکند. لذا بررسی پروتئینهای کلیدی کنترلکننده مسیر مذکور میتواند نقش مهمی در روشنسازی مکانیسم القاء مقاومت به گلوکوکورتیکوئیدها و به تبع آن پیشآگهی بیماری داشته باشد.
کلمات کلیدی: لوسمی لنفوبلاستیک حاد، مقاومت دارویی، گلوکوکورتیکوئیدها، نشانگرهای زیستی
تاریخ دریافت: 15/11/96
تاریخ پذیرش : 19/2 /97
1- PhD پروتئومیکس ـ دانشکده پیراپزشکی دانشگاه علوم پزشکی شهید بهشتی ـ تهران ـ ایران
2- فوق تخصص هماتولوژی و انکولوژی کودکان ـ استاد مرکز تحقیقات بیماریهای خونی مادرزادی کودکان ـ بیمارستان کودکان مفید ـ دانشگاه علوم پزشکی شهید بهشتی ـ تهران ـ ایران
3- فوق تخصص هماتولوژی و انکولوژی کودکان ـ استادیار مرکز تحقیقات بیماریهای خونی مادرزادی کودکان ـ بیمارستان کودکان مفید ـ دانشگاه علوم پزشکی شهید بهشتی ـ تهران ـ ایران
4- کارشناس ارشد خونشناسی آزمایشگاهی و بانک خون ـ دانشکده پیراپزشکی دانشگاه علوم پزشکی شهید بهشتی ـ تهران ـ ایران
5- مؤلف مسئول: PhD ایمونوهماتولوژی بالینی ـ استاد دانشکده پیراپزشکی دانشگاه علوم پزشکی شهید بهشتی ـ مرکز تحقیقات بیماریهای خونی مادرزادی کودکان دانشگاه علوم پزشکی شهید بهشتی ـ تهران ـ ایران ـ کد پستی: 49941-49158
مقدمه
علیرغم این که امروزه میزان بقاء در مبتلایان به لوسمی لنفوبلاستیک حاد به بیش از حدود 80% رسیده است، اما هنوز 20%-15% از بیماران با دستورالعملهای درمانی فعلی به درمان پاسخگو نیستند(2، 1). درمان در بیماران تازه تشخیص داده شده معمولاً توسط رژیمهای شیمیدرمانی ترکیبی شامل گلوکوکورتیکوئیدها انجام میگیرد.
گلوکوکورتیکوئیدها به طور گستردهای برای درمان انواع بیماریها مورد استفاده قرار میگیرند و چندین دهه است که در انکولوژی بالینی با ارزش و مورد استفاده هستند(3). گلوکوکورتیکوئیدها باعث اختلال در چرخه سلولی شده و سبب القاء مرگ سلولی در سلولهای خونی از طریق فعالسازی ژنهای القاء کننده آپوپتوز و مهار رونویسی ژنهای بقا میگردند، از این رو آنها به بخش جدایی ناپذیر رژیمهای شیمیدرمانی برای سرطانهای لنفوئیدی به ویژه ALL تبدیل شدهاند(5، 4). پردنیزولون و دگزامتازون معمولترین آنالوگهای مصنوعی گلوکوکورتیکوئیدها هستند و در مراحل مختلف درمان ALL مورد استفاده قرار میگیرند(6). پاسخ به گلـوکوکورتیکوئید، یکی از فاکتورهای مهم برای پیشبینـی نتیجه درمان و عوارض جانبی بلند مدت ناشی از شیمی درمانی در ALL دوران کودکی محسوب میشود(7). تا به امروز، مکانیسم دقیق این که پردنیزولون چگونه سلولهای ایمنی و یا سلولهای لوسمی را هدف قرار میدهد، کاملاً مشخص نشده است. اثبات شده است که پردنیزولون میتواند به دلیل ساختار چربی دوست خود به طور غیر فعال از غشای سلولی عبور کند و به گیرنده گلوکوکورتیکوئیدی سیتوزولی(GR/NR3C1 = nuclear receptor subfamily 3 group C member 1) متصل شود. گلوکوکورتیکوئیدها عملکردشان را از طریق اتصال به گیرندههای گلوکوکورتیکوئیدی معروف به GR (Glucocorticoid receptor) یاNR3C1 اعمال میکنند. مطالعهها نشان داده است که بیان غیرطبیعی ایزوفرمهای GR و ژنهای پاسخ به گلوکوکورتیکوئید و هم چنین پلیمورفیسمهای ژنتیکی و یا مسیر سیگنالینگ پایین دست NR3C1 میتوانند در مقاومت به درمان درگیر باشند(8).
با توجه به اهمیت پاسخ به گلوکوکورتیکوئیدها در تعیین پیشآگهی بیماران، شناسایی پنل نشانگرهای زیستی پیشبینی کننده حساسیت یا مقاومت به درمان با گلوکوکورتیکوئیدها در روز تشخیص بیماری، میتواند آزمایشی ارزشمند در کنار سایر آزمایشهای تعیینکننده فاکتورهای خطر باشد(9). علاوه بر این، استفاده از شبکه برهمکنش پروتئین- پروتئین و آنالیز ویژگیهای ساختاری و عملکردی پروتئینها میتواند به فهم بهتر بیولوژی بیماری، درک بهتر مکانیسمهای مولکولی درگیر و هم چنین معرفی نشانگرهای زیستی کمک کند. از اینرو در این مطالعه به شناسایی نشانگرهای پروتئینی پیشآگهیدهنده مقاومت درمانی به گلوکوکورتیکوئیدها در لوسمی لنفوبلاستیک حاد پرداخته شده است. در این پژوهش، از روش پروتئومیکی و بیوانفورماتیکی به منظور کشف مکانیسمهای دخیل در مقاومت و بررسی تعامل پروتئینهای تغییر بیان یافته استفاده شده است.
مواد و روشها
کشت سلولی:
در مطالعههای قبلی تکمیل کننده مطالعه حاضر، طی یک مطالعه مداخلهای، از رده سلولی Nalm-6 به عنوان رده سلولی حساس به گلوکوکورتیکوئیدها و Reh به عنوان رده سلولی مقاوم به گلوکوکورتیکوئیدها استفاده شده بود. در این مطالعه تجربی، سلولها از بانک سلولی انستیتو پاستور ایران (تهران، ایران) تهیه شدند. هر یک از ردههای سلولی به تعداد 300000 سلول در هر میلی لیتر محیط کشت RPMI-1640 (جیبکو، آمریکا) و در فلاسکهای 175 میلیلیتری با دوز 1 میکرومولار پردنیزولون و 200 نانومولار دگزامتازون (آمریکا، سیگما، 4902 D) به مدت 48 ساعت تیمار شدند. سپس سلولهای تیمار شده مورد آنالیز پروتئومیکی قرار گرفتند(10، 9).
آنالیز پروتئومیکی:
پس از استخراج مخلوط پروتئینی از سلولها، جداسازی پروتئینها با استفاده از روش الکتروفورز دو بعدی بر اساس نقطه ایزوالکتریک صورت گرفت. سپس با استفاده از نرم افزار Image Master، پروتئینهای دارای تغییر بیان قابل توجه قبل و بعد از تیمار با دارو با استفاده از روش ژل الکتروفورز دو بعدی جداسازی شدند. لکههای پروتئینی از ژل خارج شده و مورد هضم آنزیمی با تریپسین قرار گرفتند.
سپس مخلوط پپتیدی حاصل به وسیله طیف سنجی جرمی بررسی شد. جرم پپتیدهای حاصل از هضم آنزیمی با جرم تئوریکی پپتیدهای حاصل از هضم فرضی پروتئین های موجود در بانک اطلاعات مقایسه شد. اگر تعداد کافی از پپتیدهای موجود در طیف واقعی با پپتیدهای حاصل از هضم تئوریکی از نظر جرمی هم پوشانی داشته باشند، مـیتوان پـروتئین را با قطعیت شناسایی کرد(10، 9).
آنالیز شبکه پروتئینی:
در این مطالعه پروتئینهای شناسایی شده در مطالعههای
پیشین که توسط همین گروه انجام شده، استخراج شد و سپس شبکه برهمکنش پروتئینی مورد ارزیابی و تحلیل قرار گرفت. برای این منظور از روش شبکه ژنی و ابزار جستجوی بازیابی تعامل ژنها و پروتئینها و از پایگاه داده آنلاین STRING نسخه 5/10 که یک پایگاه داده از اثرات متقابل پروتئینی شناخته و پیشبینی شده است، استفاده شد. اطلاعات به دست آمده از این پژوهش در قالب شبکه برهمکنش پروتئین- پروتئین ارائه شد.
یافتهها
آنالیز پروتئومیکی:
پروتئینهای شناسایی شده، پروتئینهایی هستند که طی تیمار سلولهای لوسمی لنفوبلاستیک حاد (Reh و Nalm-6) با دو داروی گلوکوکورتیکوئید(پردنیزولون و دگزامتازون) تغییر بیان داشتند(جدول 1).
جدول 1: پروتئینهای شناسایی شده در سلولهای Reh و Nalm-6 تیمار شده با داروهای پردنیزلون و دگزامتازون به روش طیف سنجی جرمی
| شماره لکه | نام پروتئین | Uniprot code | Mascot score | تنظیم بیان | Fold change |
| پروتئینهای شناسایی شده در سلول Reh تیمار شده با پردنیزولون | |||||
| 1 | SRSF3 | P84103 | 140 | کاهش | 2/2- |
| 2 | CNBP | P62633 | 62 | کاهش | 2- |
| پروتئینهای شناسایی شده در سلول Reh تیمار شده با دگزامتازون | |||||
| 1 | VDAC1 | P21796 | 398 | کاهش | 3/2- |
| 2 | SNX3 | O60493 | 99 | کاهش | 5/3- |
| 3 | PFDN6 | O15212 | 175 | کاهش | 7/3- |
| پروتئینهای شناسایی شده در سلول Nalm-6 تیمار شده با پردنیزولون | |||||
| 1 | PSMB2 | P49721 | 70 | کاهش | 1/2- |
| 2 | PPP4R4 | Q6NUP7 | 37 | افزایش | 6/3+ |
| 3 | DUT | P33316 | 146 | افزایش | 4+ |
| 4 | STMN1 | P16949 | 50 | کاهش | 6/2- |
| پروتئینهای شناسایی شده در سلول Nalm-6 تیمار شده با دگزامتازون | |||||
| 1 | CAPZA1 | P49721 | 188 | کاهش | 3/2- |
| 2 | CAPZB | Q6NUP7 | 44 | کاهش | 8/3- |
| 3 | PNP | P33316 | 131 | کاهش | 8/2- |
| 4 | CLIC1 | P33316 | 130 | کاهش | 2/2- |
| 5 | PSME1 | P16949 | 159 | کاهش | 8/2- |

شکل 1: شبکه برهمکنش پروتئینی SRSF3 و CNBP با NR3C1. سطح بیان هر دو پروتئین در سلولهای Reh تیمار شده با پردنیزلون در مقایسه با نمونههای کنترل کاهش بیان داشته است. SRSF3 در کنترل سیکل سلولی، پیرایش RNA و بیان ژن نقش دارد. CNBP نیز دارای فعالیت چاپرونی است. با توجه به نقش این پروتئینها به نظر میرسد سطح آستانهای از این پروتئینها برای حفظ تعادل تکثیر و آپوپتوز لازم است. با توجه به ارتباط این دو پروتئین با NR3C1 به عنوان گیرنده GR، نقش احتمالی این پروتئینها و فرآیند پیرایش RNA در مقاومت به GR در سلول Reh نیز مطرح است.

شکل 2: A) شبکه برهمکنش پروتئینی VDAC1/NR3C1. کاهش بیان VDAC1 بعد از تیمار سلول Reh با دگزامتازون و در نتیجه کاهش برهمکنش این پروتئین با BCL2 باعث مقاومت این سلول به آپوپتوز شده است. B) شبکه برهمکنش پروتئینی SNX3/NR3C1. SNX3 در فرآیند اندوسیتوز و نقل و انتقال پروتئینها دخالت دارد. اختلال عملکرد SNX3 میتواند منجر به تغییر رسپتورهای سطح سلولی و اختلال در سیگنالینگ و تومورژنز شود. در این مطالعه کاهش بیان SNX3 بعد از تیمار سلول Reh با دگزامتازون مشاهده شد. با توجه به ارتباط ایـن پروتئین با NR3C1 ، نقش احتمالی SNX3 در مقاومت دارویی نیز مطرح می باشد.C ) شبکه برهم کنش پروتئینی PFDN6/NR3C1. PFDN6 در عملکرد توبولینها حین میتوز و تنظیم چرخه سلولی نقش دارد. با توجه به کاهش بیان PFDN6 بعد از تیمار سلول Reh با دگزامتازون و ارتباط آن با NR3C1 به عنوان گیرنده GR احتمال ارتباط آن با مقاومت دارویی نیز مطرح است.
در این مطالعه با توجه به اهمیت مسیرهای سیگنالینگ گیرنده GR در القای مقاومت، به بررسی اینتراکشنهای پروتئینی گیرنده GR (NR3C1) با سایر تارگتهای دارویی پردنیزولون و دگزامتازون پرداخته شده است(4).
شبکه اینتراکشن پروتئینی تارگتهای دارویی پردنیزولون در رده سلولی Reh و NR3C1 :
در این بخش از پژوهش حاضر، نتایج پروتئومیکی بر اساس تغییرات در سطوح بیان پروتئینها در سلول Reh ، به عنوان یک مدل از بیمارانی که پاسخ ضعیف به پردنیزولون میدهند(بیماران با خطر بالا)، قبل و بعد از تیمار با پردنیزولون گزارش شد. از ترکیب دادههای حاصل از آنالیز پروتئوم با اطلاعات بر همکنش پروتئینـ پروتئین،
جهت تشخیص مسیر سیگنالینگ دخیل در مقاومت پردنیزولون بهره گرفته شد(شکل 1).
شبکه اینتراکشن پروتئینی تارگتهای دارویی دگزامتازون در رده سلولی Reh و NR3C1 :
در این بخش از پژوهش حاضر، نتایج پروتئومیکی بر اساس تغییرات در سطوح بیان پروتئینها در سلول Reh، به عنوان یک مدل از بیمارانی که پاسخ ضعیف به دگزامتازون نشان میدهند(بیماران با خطر بالا)، قبل و بعد از تیمار با دگزامتازون گزارش شده است. از ترکیب دادههای حاصل از آنالیز پروتئوم با اطلاعات پروتئین ـ پروتئین اینتراکشن، جهت تشخیص مسیر سیگنالینگ دخیل در مقاومت دگزامتازون بهره گرفته شد(شکل 2).

شکل 3: A) شبکه برهم کنش پروتئینی PSMB2/NR3C1. بیان PSMB2 در سلولهای Nalm-6 تیمار شده با پردنیزلون در مقایسه با نمونه کنترل کاهش داشته است. PSMB2 جزئی از پروتئوزوم بوده و این سیستم به عنوان یک تنظیم کننده مسیر های متابولیکی و چرخه سلولی است. ارتباط این پروتئین با گیرنده GR، NR3C1 در تصویر فوق نشان داده شده است. B) شبکه برهم کنش پروتئینی STMN1/NR3C1. بیان STMN1 در سلول های Nalm-6 تیمار شده با پردنیزولون در مقایسه با نمونه کنترل کاهش داشته است. STMN1 تنظیمکننده میکروتوبولها حین تقسیم سلولی و تحرک است. ارتباط این پروتئین با گیرنده GR، NR3C1 در تصویر فوق نشان داده شده است. C) شبکه برهمکنش پروتئینی DUT/NR3C1. بیان DUT در سلولهای Nalm-6 تیمار شده با پردنیزولون در مقایسه با نمونه کنترل افزایش داشته است. DUT آنزیم ضروری در متابولیسم نوکلئوتیدهاست. افزایش بیان آن نیز به عنوان یک مکانیسم مقاومت دارویی شناخته شده است. D) شبکه برهمکنش پروتئینی PPP4R4/NR3C1. بیان PPP4R4 در سلولهای Nalm-6 تیمار شده با پردنیزولون در مقایسه با نمونه کنترل افزایش داشته است. PPP4R4 نیز در فرآیند آپوپتوز و سازماندهی میکروتوبولها نقش دارد. هم چنین در تنظیم سیگنالینگ سایتوکاینها و بقای لنفوسیت نیز دخیل است. دادههای این مطالعه نشان میدهد پروتئین PPP4R4 با NR3C1 به عنوان گیرنده GR مرتبط است.

شکل 4: A) شبکه برهم کنش پروتئینی CAPZB/CAPZA1/NR3C1. بیان این دو پروتئین در سلول های Nalm-6 تیمار شده با دگزامتازون در مقایسه با نمونه کنترل کاهش داشته است. CAP ها برای ایجاد ساختار اسکلت سلولی پایدار لازم اند. در تصویر فوق ارتباط این پروتئین با NR3C1 نشان داده شده است. B) شبکه برهم کنش پروتئینی CLIC1/NR3C1. بیان CLIC1 در سلول های Nalm-6 تیمار شده با دگزامتازون در مقایسه با نمونه کنترل کاهش داشته است. CLIC1 نقش مهمی در تنظیم پتانسیل غشا، چرخه سلولی و تکثیر و تمایز آن ایفا می کند. ارتباط این پروتئین با NR3C1 با استفاده از پایگاه داده STRING در تصویر فوق نشان داده شده است. C) شبکه برهم کنش پروتئینی PNP/NR3C1. بیان PNP در سلول های Nalm-6 تیمار شده با دگزامتازون در مقایسه با نمونه کنترل کاهش داشته است. PNP در فسفریلاسیون نوکلئوزید های پورین نقش دارد. اختلال در این آنزیم بر بقا و عملکرد سلول تاثیر می گذارد. ارتباط این پروتئین با NR3C1 در تصویر فوق نشان داده شده است. D) شبکه برهم کنش پروتئینی PSME1/NR3C1. بیان PSME1 در سلول های Nalm-6 تیمار شده با دگزامتازون در مقایسه با نمونه کنترل کاهش داشته است. PSME1 نیز از اجزای پروتئازوم بوده و اختلال در بیان آن بر بقای سلول اثر دارد. افزایش بیان آن مارکر مهم مقاومت دارویی است. در تصویر فوق ارتباط این پروتئین با NR3C1 نشان داده شده است.

شکل 5: شبکه بر هم کنش 14 پروتئین شناسایی شده در اثر تیمار سلولهای لوسمی لنفوبلاستیک حاد (Reh و Nalm-6) با گلوکوکورتیکوئیدها. گلوکوکورتیکوئیدها ترکیباتی با اهداف چندگانه هستند که اثرات ضد سرطانی آنها به مسیر پروتئازوم- یوبی کوئیتین مرتبط است. نتایج آنالیز شبکه بر هم کنش پروتئینی هم چنین بیانگر این ادعاست که احتمالاً یوبی کوئیتینه شدن، مکانسیم مولکولی دخیل در تعیین پاسخ به درمان در ALL است.
شبکه اینتراکشن پروتئینی تارگتهای دارویی پردنیزولون در رده سلولی Nalm-6 و NR3C1 :
در این بخش از پژوهش حاضر، نتایج پروتئومیکی بر اساس تغییرات در سطوح بیان پروتئینها در سلولهای Nalm-6 ، به عنوان یک مدل از بیمارانی که نه حساسیت و نه مقاومت مطلق به پردنیزولون را نشان دادند، (بیماران با خطر متوسط)، قبل و بعد از تیمار با پردنیزولون گزارش شد. از ترکیب دادههای حاصل از آنالیز پروتئوم با اطلاعات بر همکنش پروتئین - پروتئین، جهت تشخیص مسیر سیگنالینگ دخیل در مقاومت پردنیزولون بهره گرفته شد (شکل 3).
شبکه اینتراکشن پروتئینی تارگتهای دارویی دگزامتازون در رده سلولی Nalm-6 و NR3C1 :
در این بخش از پژوهش حاضر، نتایج پروتئومیکی بر
اساس تغییرات در سطوح بیان پروتئینها در سلولهای Nalm-6، به عنوان یک مدل از بیمارانی که حساسیت به پردنیزولون را نشان دادند(بیماران با خطر پایین)، قبل و بعد از تیمار با دگزامتازون گزارش شد. از ترکیب دادههای حاصل از آنالیز پروتئوم با اطلاعات بر همکنش پروتئین ـ پروتئین، جهت تشخیص مسیر سیگنالینگ دخیل در مقاومت دگزامتازون بهره گرفته شد(شکل 4).
در مجموع مطالعه شبکه برهمکنش پروتئینی نشان داد که این 14 پروتئین میتوانند از طریق پروتئین ubiquitin-conjugating enzyme (UBC) با NR3C1 به عنوان گیرنده گلوکوکورتیکوئیدی(GR)، برهمکنش داشته باشند. این موضوع نشاندهنده نقش این پروتئین در مسیر پروتئازوم ـ یوبی کوئیتین است که احتمالاً میتواند نقش مهمی در مکانیسم مقاومت به GC در ALL ایفا کند(شکل 5).
بحث
یافتهها نشان داده است که 14 پروتئین تغییر بیان یافته که در مطالعههای قبلی در زمینه مقاومت سلولهای لوسمی لنفوبلاستیک حاد به GC شناسایی شدند، در مسیرهای بیولوژیکی مهمی از جمله مسیر پروتئازوم - یوبیکوئیتین نقش ایفا میکنند. در طی سالهای اخیر، تحقیقـات بسیـاری بـرای روشـن شدن و تعدیل مقاومت گلوکوکورتیکوئیدی صورت گرفته است. اولین مطالعهها بر روی کلیرنس پردنیزولون و یا بیان ناقص گیرنده گلوکوکورتیکوئیدی معطوف شد. سطح بیان واریانتهای مختلف هم در سطح پایه و هم بعد از هشت ساعت قرارگیری در معرض پردنیزولون اندازهگیری شد. نتایج نشان داد این مقدار با مقاومت پردنیزولون در شرایط in vitro در نمونههای کودکان مبتلا به ALL ارتباط نداشت(11). علاوه بر این، مشخص شد پلیمورفیسمها و یا جهشها در ژن GR، از مشارکتکنندگان اصلی مقاومت گلوکوکورتیکوئیدی در کودکان مبتلا به ALL نمیباشند(12). مطالعهها نشان داده است که مسیرهای سیگنالینگ درگیر در مسیرهای پایین دست یا بالادست گیرنده گلوکوکورتیکوئیدی در ایجاد مقاومت به گلوکوکورتیکوئیدها نقش مهمی دارند. به طور کلی این اطلاعات نشان میدهد که مقاومت به گلوکوکورتیکوئیدها میتواند ناشی از مکانیسمهای مؤثر بر مسیر سیگنالینگ درونسلولی گیرنده GR باشد(14، 13، 4). لذا با یافتن مارکرهای مقاومت یا حساسیت به پردنیزولون و دگزامتازون و ارتباط آنها با NR3C1 به عنوان گیرنده GR، میتوان مسیرهای سیگنالینگ درون سلولی پاییندست را شناسایی نمود. ابزارهای پروتئومیکی دریچهای جدید را در شناسایی نشانگرهای زیستی مقاومت دارویی با هدف بهبود درمان فراهم میکنند. از این رو در مطالعههای پیشین گروه حاضر، به ارزیابی اهداف دارویی گلوکوکورتیکوئیدها شامل پردنیزولون و دگزامتازون در ALL به روش پروتئومیکی پرداخته شد(10، 9).
بررسی پروتئومیکی سلولهای تیمار شده با گلوکوکورتیکوئیدها در مقایسه با کنترل نشان از تغییر بیان 28 لکه پروتئینی داشت، که از این تعداد تنها 14 پروتئین به روش طیفسنجی جرمی مورد شناسایی قرار گرفتند(جدول 1). پروتئینهای شناسایی شده، در مسیرها و فرآیندهای پیرایش جایگزین ( SRSF3 = Serine/Argenin-Rich Splicing Factor 3 و CNBP = CCHC-type zinc finger nucleic acid binding protein)، مسیر پروتئازوم (PSMB2 = Proteasome subunit beta 2 ، PSME1 = Proteasome activator complex subunit 1 و STMN1 = Stathmin 1)، مسیر سازماندهی اسکلت سلولی (CAPZA1 = F-actin-capping protein subunit alpha-1، CAPZB ، PPP4C ، STMN و PFDN6)، ترانسپورترها(VDAC1، CLIC1 و SNX3) و متابولیسم نوکلئوتیدها(DUT و PNP) مشارکت داشتند(25-15). در این مطالعه با توجه به اهمیت مسیرهای سیگنالینگ گیرنده GR در القای مقاومت، به بررسی اینتراکشنهای پروتئینی گیرنده GR (NR3C1) با سایر تارگتهای دارویی پردنیزولون و دگزامتازون پرداخته شد.
سطح بیان دو پروتئین SRSF3 و CNBP در سلول Reh تیمارشده با پردنیزولون کاهش داشته است(جدول 1). نتایج حاصل از بررسی برهمکنش پروتئین - پروتئین هر دو پروتئین فوق با NR3C1 به عنوان گیرنده هدف پردنیزلون، نقش مسیر سیگنالینگ اسپلایزوم را آشکار نمود(شکل 1). به عبارتی پیرایش جایگزین در تنظیم GR ها از جمله NR3C1 اهمیت زیادی دارد و از طرفی SRSF3 و CNBP در پیرایش جایگزین نقش کلیدی دارند. اختلال در پیرایش، واریانتهایی را تولید میکند که در ابعاد مختلف متابولیسم سرطان، متاستاز، آنژیوژنز و مقاومت دارویی دخیل هستند(26). از طرفی داروهای شیمیدرمانی نیز میتوانند فرآیندهای پیرایش جایگزین را تغییر دهند(27).
سطح بیان سه پروتئین VDAC1، SNX3و PFDN6 در سلول Reh تیمارشده با دگزامتازون کاهش معنادار داشته است(جدول 1). به علاوه نتایج حاصل از بررسی برهمکنش پروتئین - پروتئین، برهمکنش BCL2-VDAC1-UBC-NR3C1 را نشان داده است. به عبارتی VDAC1 با پروتئینهای تنظیمکننده آپوپتوز و هم چنین گیرنده هدف داروی دگزامتازون، NR3C1، ارتباط دارد(شکل A2). این یافتهها پیشنهاد میدهد که القای افزایش بیان VDAC1 میتواند به عنوان یک مکانیسم القای آپوپتوز در تحقیقات مرتبط با مقاومت به داروی دگزامتازون استفاده شود. هم چنین بررسیها نشان داد که NR3C1 احتمالاً توسط عملکرد مرتبسازی(sorting function) SNX3 تنظیم میشود، بنابراین این پروتئین میتواند به عنوان کاندید بالقوه ایجاد مقاومت در این مسیر محسوب شود (شکل B2). آنالیز STRING نشان داد که اهداف پاییندست مسیر وابسته به PFDN6 شامل PFDN6-PFDN5-UBC-HSP90-NR3C1 ممکن است به دلیل اختلال عملکرد در پرفولدین (Prefoldin) در ایجاد ALL دخالت داشته باشند (شکل C2). پرفولدین دارای عملکردهایی همچون تاخوردگی پروتئین، بازسازی اسکلت سلولی و تنظیم چرخه سلولی میباشد(20).
هم چنین سطح بیان پروتئینهای PSMB2 و STMN1 در سلول Nalm-6 تیمار شده با پردنیزلون نسبت به کنترل کاهش داشته است و در مقابل دو پروتئین PPP4R4 و DUT افزایش بیان نشان دادند(جدول 1). PSMB2 جزئی از پروتئوزوم بوده و این سیستم به عنوان یک تنظیمکننده مسیرهای متابولیکی و چرخه سلولی است. STMN1 نیز تنظیمکننده میکروتوبولها حین تقسیم سلولی و تحرک است(18، 17). شبکه برهمکنش این پروتئینها و ارتباط آنها در مسیرهای پیامرسانی القاکننده مقاومت به GR مورد بررسی قرار گرفت. بین PSMB2 و STMN1 با NR3C1 نیز ارتباط معناداری برقرار است که در شکل 3 نشان داده شده است. DUT آنزیم ضروری در متابولیسم نوکلئوتیدها است. افزایش بیان آن نیز به عنوان یک مکانیسم مقاومت دارویی شناخته شده است(25). PPP4R4 نیز در فرآیند آپوپتوز و سازماندهی میکروتوبولها نقش دارد. هم چنین در تنظیم سیگنالینگ سایتوکاینها و بقای لنفوسیت نیز دخیل است(20). بررسی شبکه برهمکنش پروتئین DUT نیز ارتباط بین DUT/UBC/NR3C1 را نشان داد (شکل C3). علاوه بر این، ارتباط بین PPP4R4-PPP4C-JUN-NR3C1 هم نشاندهنده بر همکنش پروتئین PPP4R4 با NR3C1 میباشد(شکل D3).
سطح بیان پنج پروتئین به نامهای CAPZA1، CAPZB، PNP، CLIC1و PSME1 در سلول Nalm-6 تیمار شده با دگزامتازون نسبت به کنترل کاهش داشته است(جدول 1). CAP ها برای ایجاد ساختار اسکلت سلولی پایدار لازماند (19). CLIC1 نقش مهمی در تنظیم پتانسیل غشا، چرخه سلولی و تکثیر و تمایز آن ایفا میکند(21). PNP در فسفریلاسیون نوکلئوزیدهای پورین نقش دارد. اختلال در این آنزیم بر بقا و عملکرد سلول تاثیر میگذارد(24). PSME1 نیز از اجزای پروتئازوم بوده و اختلال در بیان آن بر بقای سلول اثر دارد. افزایش بیان آن به عنوان مارکر مهم مقاومت دارویی مطرح است(18). نتایج حاصل از بررسی برهمکنش پروتئین - پروتئین، ارتباط بین CAPZA1 و CAPZB با NR3C1 را نشان داد(شکل A4). هم چنین برهمکنش پروتئینهای CLIC1، PNP و PSME1 با NR3C1 نیز در شکل 4 نشان داده شده است.
در مجموع به نظر میرسد GC ها ترکیباتی با اهداف متعدد هستند که اثرات ضدسرطانی آنها با مسیر پروتئازوم- یوبیکوئیتین مرتبط است. مطالعههای پیشین حاکی از این است که یوبیکوئیتیناسیون انکوژنها و ژنهای سرکوبگر تومور از ویژگیهای مهم تنظیم در سلولهای انسانی طبیعی و بدخیم است. UBC در برخی سرطانها مثل سرطان تخمدان به عنوان تارگت مقاومت دارویی معرفی شده است(28). به طور کلی شناخت بیشتر
اجزای مسیر پیامرسانی وابسته و نقش آنها در ادامه تکثیر سلولهای سرطانی در حضور GC ضروری است. هم چنین کشف عامل یا عوامل دخیل در افزایش بیان و افزایش فعالیت این اجزا در طی کسب مقاومت به GC، راهگشای ما در مسیر توسعه راهکارهای درمانی اثر بخشتر خواهد شد.
نتیجهگیری
یافتههای این مطالعه نشان میدهد که 14 پروتئین تغییر بیان یافته که در مطالعههای پیشین در زمینه مقاومت سلولهای لوسمی لنفوبلاستیک حاد به GC شناسایی شدند، در مسیرهای بیولوژیکی مهمی از جمله مسیر پروتئازوم- یوبیکوئیتین نقش مشترک دارند. لازم است مطالعههای بیشتری به منظور بررسی بیان پروتئینهای دخیل در مسیر پروتئازوم-یوبیکوئیتین و نقش بیان یا عدم بیان آنها بر مقاومت به GC و یا به عنوان اهداف بالقوه نشاندهنده پیشآگهی و درمان ALL صورت پذیرد.
نوع مطالعه: پژوهشي |
موضوع مقاله:
خون و انكولوژي
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |





