جلد 15، شماره 2 - ( تابستان 1397 )
جلد 15 شماره 2 صفحات 104-95 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Daneshvar Z, Amirizadeh N, Oodi A, Goudarzi S. Frequency of Weak D alleles in Blood Donorsby Molecular methods. bloodj 2018; 15 (2) :95-104
URL: http://bloodjournal.ir/article-1-1170-fa.html
URL: http://bloodjournal.ir/article-1-1170-fa.html
دانشور زهرا، امیری زاده ناصر، اودی آرزو، گودرزی سمیرا. فراوانی آللهای D ضعیف در اهداکنندگان خون با روشهای مولکولی. فصلنامه پژوهشی خون. 1397; 15 (2) :95-104
دانشیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون
متن کامل [PDF 739 kb]
(1461 دریافت)
| چکیده (HTML) (5071 مشاهده)
مقدمه
آنتیژن D به دلیل خاصیت ایمنی زایی بالا یکی از مهمترین آنتیژنهای گروه خونی Rh از نظر اهمیت کلینیکی است که در ایجاد بیماری همولیتیک نوزادان HDFN (Hemolytic Disease of Fetus and New born) و واکنشهای ناشی از انتقال خون HTR (Hemolytic Transfusion Reaction) نقش به سزائی دارد(6-1). HTR در اثر دریافت خون Rh مثبت توسط فرد Rh منفی و تولید آنتیبادی در بدن فرد Rh منفی، به دنبال آلوایمیونیزاسیون در مواجهه بعدی با خون Rh مثبت باعث همولیز در بدن گیرنده میشود. HDFN در نوزاد مادر Rh منفی که همسر Rh مثبت دارد، ممکن است دیده شود(5). هر چند تقریباً 90%-85% افراد جامعه Rh مثبت و حدود 15%-10% به طور مشخص Rh منفی هستند ولی در آزمایشگاههای سرولوژی مواردی دیده میشوند که تحت عنوان D ضعیف طبقهبندی میگردید(7). از نظر سرولوژیکی در Dضعیف، واکنش RBC با معرف آنتی D در مرحله اول منفی، کمتر یا مساوی 2+ میباشد ولی با استفاده از آنتی هیومن گلوبولین (AHG) ایجـاد آگلوتیناسیـون متوسط یا شدید میکند (12-8). بروز تغییرات ژنتیکی و موتاسیون باعث تغییرات کمی یا کیفی در بیان سرولوژیکی آنتیژن D میشوند که حاصل آن، انواع آللهای D واریانت است و در سه گروه اصلی D ناقص(partial D)، D ضعیف (weak D) و Del طبقهبندی میشوند(10، 7). در نوع D ضعیف، تغییر کمی در بیان آنتیژن D صورت گرفته یعنی فقط تعداد آنتیژن D بر سطح RBC کاهش یافته ولی ساختارش تغییر نکرده در حالی که در نوع D ناقص تغییر کیفی در آنتیژن D ایجاد شده است، لذا این افراد در مواجهه با RBC دارای آنتیژن D، تولید آنتیبادی میکنند( 7,10).
تا به امروز 147 نوع D ضعیف شناسایی شده است که برخی انواع دارای زیر گروه هستند(10، 6). میزان این فنوتیپ در نژادها و اقوام مختلف متفاوت است به عنوان مثال در قفقازیها میزان شیوع آن 2/0% تا 1% است و اکثریت با نوع 1، 2 و 3 میباشد(15-13، 7). مطالعهها نشان میدهد گیرندگان خون دارای D ضعیف نوع 1، 2 و 3 چه به صورت هموزیگوت و چه هتروزیگوت وقتی RBC های RhD مثبت دریافت میکنند، در معرض خطر تولید آلوآنتی D نیستند و فقط در افراد دارای انواع 2/4 ، 11 ، 15 ، 21 و 57 در صورت دریافت خون Rh مثبت تولید آنتیD دیده شده است(20-16) .از آن جایی که روشهای سرولوژیک قادر به تعیین نوع D ضعیف نمیباشند، لذا با تعیین ژنوتیپ و اثبات نوع D ضعیف میتوان در مصرف بیجای خون RhD منفی صرفه جویی کرد و نیز در مادران دارای فنوتیپ D ضعیف که نوزاد RhD مثبت به دنیا آوردهاند یا دارای جنین RhDمثبت هستند، نیاز به تزریق روگام(که یک فرآورده مشتق از پلاسما و دارای خطرات بالقوه انتقال بیماریها میباشد) نیست و در مصرف آن نیز صرفهجویی میشود(10، 7).
D ضعیف شایعترین نوع D واریانت در امریکا و اروپاست که در یک برآورد 3% از افراد RhD منفی را تشکیل میدهد. از این میزان 80% از نوع 1 ، 2 و3 هستند ولی تاکنون آماری درباره فراوانی آللهای Dضعیف در ایران گزارش نشده است(7). در این مطالعه فراوانی انواع آللهای D ضعیف در نمونههای اهداکنندگان خون با بیان ضعیف آنتیژنD با روشهای مولکولی PCR-SSP ، PCR-RFLP و تعیین توالی DNA مشخص شد.
مواد و روشها
جمعآوری نمونهها:
در یک مطالعه توصیفی، تعداد 105 نمونه از اهداکنندگان خون دارای فنوتیپ D ضعیف که به انتقال خون استان تهران (63 نمونه) و 11 استان دیگر شامل استانهای آذربایجان غربی (7 نمونه)، مرکزی (1 نمونه)، قزوین (4 نمونه)، یزد (8 نمونه)، اردبیل (2 نمونه)، قم (4 نمونه)، خوزستان (1 نمونه)، اصفهان (5 نمونه)، خراسان جنوبی (7 نمونه)، سیستان و بلوچستان (2 نمونه) و هرمزگان (1 نمونه) مراجعه کرده بودند، انتخاب گردید. از اهداکنندگان خون دارای فنوتیپ D ضعیف مقدار 5 میلیلیتر نمونه خون کامل EDTA دار جمعآوری شد.
تعیین فنوتیپ:
ابتـدا سـوسپـانسیـون 5%-3% (در سـرم فیـزیـولوژی)
جدول 1: توالی آغازگرهای D ضعیف نوع 1 تا 5 (حروف کوچک نواحی داخل اینترون را نشان میدهد)

شکل 1 : نتایج PCR-SSP، 4 نمونه D ضعیف انواع 1، 3، 4و5 را نشان می دهد. اولین چاهک از سمت راست bp ladder 100 میباشد وبعد از آن به ترتیب نتایج مربوط به PCR-SSP با آغازگرهای D ضعیف انواع 1، 2، 3 ، 4 و 5، هورمون رشد(Hgh) و آخرین چاهک کنترل منفی می باشد. شکل A: D ضعیف نوع 1 ، شکل B: D ضعیف نوع 3 ، شکل C: D ضعیف نوع 4، شکل D: D ضعیف نوع 5.

نمودار 1: فراوانی انواع D ضعیف در بین اهداکنندگان خون استان تهران و سایر استانها
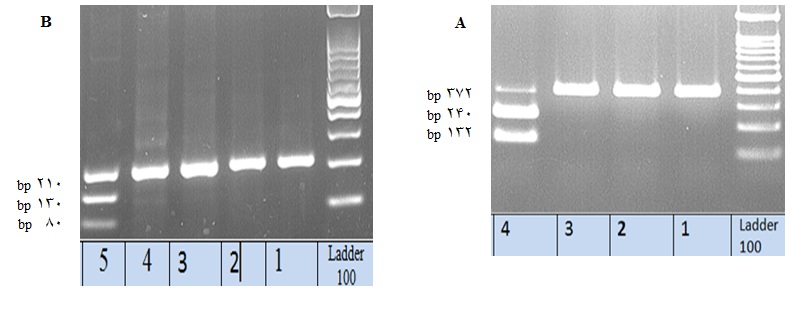
شکل 2: نتایج مربوط به PCR- RFLP نمونههای D ضعیف 5 و 15 . شکل A : نتایج PCR-RFLP مربوط به D ضعیف نوع 15. ردیفهای 1، 2 و 3 مربوط به سه نمونه D ضعیف نوع 15، قطعه bp 372 که جایگاه برش آنزیم KpnI را ندارد. - ردیف 4 مربوط به نمونه Rh مثبت دارای دو قطعه bp 132 وbp 240 پس از برش با آنزیم KpnI. شکل B : نتایج PCR-RFLP مربوط به Dضعیف نوع 5 – ردیفهای 1 ، 2، 3 و 4 مربوط به 4 نمونه Dضعیف نوع 5: قطعه bp 210 که جایگاه برش آنزیم AluI را ندارد. - ردیف 5 مربوط به نمونه Rh مثبت دارای دو قطعه bp 80 وbp 130 پس از برش با آنزیم AluI.
بحث
نتایج این مطالعه نشان داد که از بین 105 نمونه دارای فنوتیپ D ضعیف، فقط 13 نمونه(4/12%) D ضعیف نوع 1 و نوع 3 بودند و هیچ نمونه D ضعیف نوع 2 در بین این افراد مشاهده نشد. این در حالی است که مطالعههای متعدد انجام شده در کشورهای اروپایی و آمریکایی فراوانی بین 90%-67% را برای D ضعیف نوع 1، 2و 3 (با خطر آلوایمیونیزاسیون همراه نمیباشند) گـزارش نمـودهاند که اختلاف زیادی با نتایج به دست آمده در مطالعه ما دارد(23، 22، 14، 13، 7). هم چنین نتایج این تحقیق نشان داد هر 13 نمونه D ضعیف نوع 1و 3 دارای آنتی ژن C میباشند، که فرانس وگنر در مطالعه خود در سال 1999 نیز به این یافته اشاره نموده است(13).
در مطالعه حاضر شایعترین نوع D ضعیف مربوط به D ضعیف نوع 15 (845 G>A) با فراوانی 38% بود. این در حالی است که در مطالعههایی که در جمعیتهای سفید پوست انجام شده است، فراوانی این نوع D ضعیف کمتر از 2% گزارش شده است(24-13). فقط در مطالعهای که توسط آگنیزکا ارزینسکا و همکاران در سال 2013 در کشور لهستان انجام شده بود، فراوانی D ضعیـف نوع 15 در بین اهداکنندگان خون دارای ژن RHD ، 19% گزارش شده است(25). فراوانی D ضعیف نوع 15 در بین کشورهای آسیایی بالاتر از کشورهای اروپایی میباشد، به طور مثال فراوانی D ضعیف نوع 15 در کشور چین بسیار متغیر و بین 56%-9/7% گزارش شده است. در افراد دارای آلل D ضعیف نوع 15 (Asp 282Gly) به دلیل تعداد کم آنتیژن D بر روی گلبول قرمز، در صورت دریافت خون +Rh آلوایمیونیزاسیون دیده میشود(18، 16).
از لحاظ فراوانی سایر آنتیژنهای سیستم Rh ، نتایج این مطالعه نشان داد از بین 40 نمونه D ضعیف نوع 15، به جز یک نمونه بقیه همه دارای آنتیژن E بودند. این یافته، یافتهای است که در مطالعهای در سال 1999 که برای اولین بار اساس مولکولی انواع فنوتیپهای D ضعیف را شرح داده است، به آن اشاره شده است(13). ارزینسکا و همکاران در سال 2013 در مطالعهای که در کشور لهستان انجام دادند، به همراهی آنتیژن E با آلل مربوط به D ضعیف نوع 15 اشاره داشتهاند(25). هم چنین سان جیدی و همکاران در سال 2006 گزارش نمودند که 89% افراد دارای آلل مربوط به D ضعیف نوع 15 آنتیژن E را دارا میباشند(26).
در مطالعهای که توسط اُرزینسکا و همکاران در سال 2013 در کشور لهستان انجام شده بود فراوانی D ضعیف نوع 15 در بین اهداکنندگان خون دارای ژن RHD ، 19% گزارش شده است(25). فراوانی D ضعیف نوع 15 در بین کشورهای آسیایی بالاتر از کشورهای اروپایی میباشد، به طور مثال فراوانی D ضعیف نوع 15 در کشور چین بسیار متغیر و بین 56%-9/7% گزارش شده است. در افراد دارای آلل D ضعیف نوع 15 (Asp 282Gly) به دلیل تعداد کم آنتیژن D بر روی گلبول قرمز، در صورت دریافت خون Rh+ آلوایمیونیزاسیون دیده میشود (18، 16).
از لحاظ فراوانی سایر آنتیژنهای سیستم Rh ، نتایج این مطالعه نشان داد از بین 40 نمونه D ضعیف نوع 15، به جز یک نمونه بقیه همه دارای آنتیژن E بودند. این یافته، یافتهای است که در مطالعه وگنر در سال 1999 که برای اولین بار اساس مولکولی انواع فنوتیپهای D ضعیف را شرح داده است، به آن اشاره شده است(13). اُرزینسکا و همکاران در سال 2013 در مطالعهای که در کشور لهستان انجام دادند، به همراهی آنتیژن E با آلل مربوط به D ضعیف نوع 15 اشاره داشتهاند(25). هم چنین سانجیدی و همکاران در سال 2006 گزارش نمودند که 89% افراد دارای آلل مربوط به D ضعیف نوع 15، آنتیژن E را دارا میباشند(26).
شیهویه و همکاران در سال 2014 نیز گزارش نمودند به جز دو مورد از 64 مورد D ضعیف نوع 15، همه موارد دارای آنتیژن E میباشند (27). نتایج این مطالعه نشان داد بعد از D ضعیف نوع 15 و 1 ، سومین واریانت شایع مربوط به D ناقصDLO با فراوانی 57/8% میباشد(D ناقص C>T 851). DLO با فراوانی کمتر از یک درصد در جمعیت سفید پوست، اولین بار توسط انصارت ـ پیرن و همکاران در سال 2004 در کشور فرانسه گزارش شد. افراد دارای این واریانت قادر به تولید آلوآنتی D میباشند(22). نکته قابل توجه این است که 50% موارد D ناقص DLOدر مطالعـه حاضـر مـربوط بـه استـان خراسان جنوبی بود. هم چنین همه 10 نمونه گزارش شده دارای آنتیژن C بودند که این یافته نیز با مطالعه پیـرن هماهنگی داشت(22).
در ایـن مطالعـه D ضعیـف نوع 5 (446 C>A) فراوانی
62/7% را نشان داد که با فراوانی گزارش شده (کمتر از یک درصد) توسط فرانس وگنر در سال 1999 در جمعیت سفید پوست اروپایی دارای فنوتیپ D ضعیف اختلاف زیادی دارد(13). مونا اکاری و همکاران در سال 2015 فراوانی 7/2% را برای D ضعیف نوع 5 در بین اهداکنندگان تونس، دارای فنوتیپ D ضعیف گزارش نمود (28).
همه 8 نمونه D ضعیف نوع 5 گزارش شده دارای آنتیژن E بودند که این یافته نیز با دو مطالعه فوق هماهنگی داشت(28، 13). شایان ذکر است از این 8 نمونه، 7 نمونه مربوط به اهداکنندگان استان تهران بودند.
فراوانی D ضعیف نوع 4 با دو نوع موتاسیون(602 C>G) و(667T>G ) در این مطالعه 76/4% به دست آمد. فرانس وگنر در سال 1999 در جمعیت سفید پوست اروپایی دارای فنوتیپ D ضعیف، فراوانی D ضعیف نوع 4 با دو نوع موتاسیون (602C>G) و (667 T>G) را 3/1% گزارش نموده است(13).
ایمان حسین و همکاران در سال 2013 فراوانی انواع D ضعیف نوع 4 را در کشور مصر جمعاً 48% گزارش نمود در حالی که بیشترین فراوانی در این کشور مربوط به انواع D ناقص میباشد. نتایج این مطالعه با فراوانی به دست آمده در مطالعه ما اختلاف زیادی را نشان میدهد (29). هم چنین مونا اکاری و همکاران در سال 2015 شایعترین نوع D ضعیف در بین اهداکنندگان خون کشور تونس را D ضعیف نوع 4 (91/73%) با انواع مختلف موتاسیونها گزارش نمودند(28). همکر و همکارانش در سال 1999 گزارش نمودند که این موتاسیونها در بین سیاهپوستان آفریقایی بعد از انواع D ناقص بیشترین فراوانی را دارد(30). کارین پریسکو آرنونی و همکاران در سال 2014 نیز فراوانی انواع Dضعیف نوع 4 را بیش از 50% در بین سیاهپوستان کشور برزیل گزارش نمودند(31).
مونا اکاری و همکاران در تحقیق دیگری که در سال 2017 انجام دادند، فراوانی انواع D ضعیف نوع 4 را در تونس 90% اعلام کردند که 88% آن، D ضعیف نوع 0/4 بود و توصیه کردند افراد دارای D ضعیف نوع 0/4 میتوانند بدون خطر آلوایمیونیزاسیون، خون Rh مثبت دریافت کنند(32). نتایج این مطالعهها در مقایسه با جمعیت مورد مطالعه ما تفاوت چشمگیری را برای فراوانی انواع D ضعیف نوع 4 نشان میدهد.
نتیجهگیری
تفاوت چشمگیری بین فراوانی واریانتهای D ضعیف در بین اهداکنندگان خون کشور ما در مقایسه با جمعیتهای سفید پوست اروپایی و آمریکایی با فراوانی بالای انواع D ضعیف(1، 2 و 3) جمعیت آفریقایی با فراوانی بالای انواع D ناقص و D ضعیف نوع 4 و هم چنین جمعیت آسیایی با فراوانی بالای Del وجود دارد(10).
تشکر و قدردانی
از زحمات همکاران بخش اتوماسیون و سرولوژی اختصاصی انتقال خون استان تهران، بخش ایمونوهماتولوژی ستاد مرکزی سازمان انتقال خون و همکاران بخش اتوماسیون و سرولوژی اختصاصی در مراکز انتقال خون استانهای آذربایجان غربی، مرکزی، قزوین، یزد، اردبیل، قم، خوزستان، اصفهان، خراسان جنوبی، سیستان و بلوچستان و هرمزگان که با ارسال نمونه ما را یاری کردند، صمیمانه سپاسگزاریم. این طرح در کمیته دانشگاهی اخلاق در پژوهشهای زیست پزشکی مؤسسه عالی آموزشی و پژوهشی طب انتقال خون با کد IR.TMI.REC.1395.023 مجوز گرفته است.
متن کامل: (3528 مشاهده)
فراوانی آللهای D ضعیف در اهداکنندگان خون با روشهای مولکولی
زهرا دانشور1، ناصر امیریزاده2، آرزو اودی3، سمیرا گودرزی4
چکیده
سابقه و هدف
از آن جایی که شناسایی آنتیژنهای D ضعیف میتواند از مصرف بی جای خون RhD منفی و تزریق نا به جای رگام در مادران جلوگیری نماید، تعیین فراوانی انواع آلل های D ضعیف در کشور ما ضروری به نظر میرسد. در این مطالعه فراوانی این آللها در بین اهداکنندگان خون 21 استان ایران در سال 1395 از طریق آنالیز مولکولی بررسی گردید.
مواد و روشها
مطالعه انجام شده از نوع توصیفی بود. تعداد 105 نمونه خون دارای بیان ضعیف آنتیژن D از اهداکنندگان خون جمعآوری و فنوتیپ نمونهها از نظر آنتیژنهای D, C, c, E, e به وسیله روشهای سرولوژیک تعیین گردید و سپس وجود آللهای مختلف مسئول ایجاد فنوتیپ D ضعیف به وسیله روشهای مولکولی RFLP ، PCR-SSP و تعیین توالیDNA ارزیابی شدند.
یافتهها
بیشترین فراوانی مربوط به D ضعیف نوع 15 (1/38%) بود. نوع 1 (48/10%)، نوع 5 (62/7%)، نوع 4 (76/4%)، نوع 80 (8/3%)، نوع 3 (9/1%) و نوع 11 ، 8 ، 100 هر کدام(95/0%) بود. D ناقص با فراوانی DLO (57/8%) و Va/DAU (95/0%) دیده شد. نتایج این مطالعه هم چنین همراهی D ضعیف نوع 15 را با آنتیژن E و همراهی D ضعیف نوع 1 و D ناقص DLO را با آنتیژن C نشان داد.
نتیجه گیری
در این مطالعه تفاوت چشمگیری بین فراوانی واریانتهای D ضعیف در بین اهداکنندگان خون کشور ما در مقایسه با جمعیتهای سفید پوست اروپایی، آمریکایی و آفریقایی و هم چنین جمعیت آسیایی وجود دارد.
کلمات کلیدی: اهداکنندگان خون، ژنوتیپ، آللها
تاریخ دریافت: 10/10/96
تاریخ پذیرش: 10/11/96
1- کارشناس ارشد هماتولوژی و بانک خون ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
2- مؤلف مسئول: PhD خونشناسی و بانک خون ـ دانشیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
3- مؤلف مسئول: PhD خونشناسی و بانک خون ـ استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
4- کارشناس ارشد ایمونولوژی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
زهرا دانشور1، ناصر امیریزاده2، آرزو اودی3، سمیرا گودرزی4
چکیده
سابقه و هدف
از آن جایی که شناسایی آنتیژنهای D ضعیف میتواند از مصرف بی جای خون RhD منفی و تزریق نا به جای رگام در مادران جلوگیری نماید، تعیین فراوانی انواع آلل های D ضعیف در کشور ما ضروری به نظر میرسد. در این مطالعه فراوانی این آللها در بین اهداکنندگان خون 21 استان ایران در سال 1395 از طریق آنالیز مولکولی بررسی گردید.
مواد و روشها
مطالعه انجام شده از نوع توصیفی بود. تعداد 105 نمونه خون دارای بیان ضعیف آنتیژن D از اهداکنندگان خون جمعآوری و فنوتیپ نمونهها از نظر آنتیژنهای D, C, c, E, e به وسیله روشهای سرولوژیک تعیین گردید و سپس وجود آللهای مختلف مسئول ایجاد فنوتیپ D ضعیف به وسیله روشهای مولکولی RFLP ، PCR-SSP و تعیین توالیDNA ارزیابی شدند.
یافتهها
بیشترین فراوانی مربوط به D ضعیف نوع 15 (1/38%) بود. نوع 1 (48/10%)، نوع 5 (62/7%)، نوع 4 (76/4%)، نوع 80 (8/3%)، نوع 3 (9/1%) و نوع 11 ، 8 ، 100 هر کدام(95/0%) بود. D ناقص با فراوانی DLO (57/8%) و Va/DAU (95/0%) دیده شد. نتایج این مطالعه هم چنین همراهی D ضعیف نوع 15 را با آنتیژن E و همراهی D ضعیف نوع 1 و D ناقص DLO را با آنتیژن C نشان داد.
نتیجه گیری
در این مطالعه تفاوت چشمگیری بین فراوانی واریانتهای D ضعیف در بین اهداکنندگان خون کشور ما در مقایسه با جمعیتهای سفید پوست اروپایی، آمریکایی و آفریقایی و هم چنین جمعیت آسیایی وجود دارد.
کلمات کلیدی: اهداکنندگان خون، ژنوتیپ، آللها
تاریخ دریافت: 10/10/96
تاریخ پذیرش: 10/11/96
1- کارشناس ارشد هماتولوژی و بانک خون ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
2- مؤلف مسئول: PhD خونشناسی و بانک خون ـ دانشیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
3- مؤلف مسئول: PhD خونشناسی و بانک خون ـ استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
4- کارشناس ارشد ایمونولوژی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
مقدمه
آنتیژن D به دلیل خاصیت ایمنی زایی بالا یکی از مهمترین آنتیژنهای گروه خونی Rh از نظر اهمیت کلینیکی است که در ایجاد بیماری همولیتیک نوزادان HDFN (Hemolytic Disease of Fetus and New born) و واکنشهای ناشی از انتقال خون HTR (Hemolytic Transfusion Reaction) نقش به سزائی دارد(6-1). HTR در اثر دریافت خون Rh مثبت توسط فرد Rh منفی و تولید آنتیبادی در بدن فرد Rh منفی، به دنبال آلوایمیونیزاسیون در مواجهه بعدی با خون Rh مثبت باعث همولیز در بدن گیرنده میشود. HDFN در نوزاد مادر Rh منفی که همسر Rh مثبت دارد، ممکن است دیده شود(5). هر چند تقریباً 90%-85% افراد جامعه Rh مثبت و حدود 15%-10% به طور مشخص Rh منفی هستند ولی در آزمایشگاههای سرولوژی مواردی دیده میشوند که تحت عنوان D ضعیف طبقهبندی میگردید(7). از نظر سرولوژیکی در Dضعیف، واکنش RBC با معرف آنتی D در مرحله اول منفی، کمتر یا مساوی 2+ میباشد ولی با استفاده از آنتی هیومن گلوبولین (AHG) ایجـاد آگلوتیناسیـون متوسط یا شدید میکند (12-8). بروز تغییرات ژنتیکی و موتاسیون باعث تغییرات کمی یا کیفی در بیان سرولوژیکی آنتیژن D میشوند که حاصل آن، انواع آللهای D واریانت است و در سه گروه اصلی D ناقص(partial D)، D ضعیف (weak D) و Del طبقهبندی میشوند(10، 7). در نوع D ضعیف، تغییر کمی در بیان آنتیژن D صورت گرفته یعنی فقط تعداد آنتیژن D بر سطح RBC کاهش یافته ولی ساختارش تغییر نکرده در حالی که در نوع D ناقص تغییر کیفی در آنتیژن D ایجاد شده است، لذا این افراد در مواجهه با RBC دارای آنتیژن D، تولید آنتیبادی میکنند( 7,10).
تا به امروز 147 نوع D ضعیف شناسایی شده است که برخی انواع دارای زیر گروه هستند(10، 6). میزان این فنوتیپ در نژادها و اقوام مختلف متفاوت است به عنوان مثال در قفقازیها میزان شیوع آن 2/0% تا 1% است و اکثریت با نوع 1، 2 و 3 میباشد(15-13، 7). مطالعهها نشان میدهد گیرندگان خون دارای D ضعیف نوع 1، 2 و 3 چه به صورت هموزیگوت و چه هتروزیگوت وقتی RBC های RhD مثبت دریافت میکنند، در معرض خطر تولید آلوآنتی D نیستند و فقط در افراد دارای انواع 2/4 ، 11 ، 15 ، 21 و 57 در صورت دریافت خون Rh مثبت تولید آنتیD دیده شده است(20-16) .از آن جایی که روشهای سرولوژیک قادر به تعیین نوع D ضعیف نمیباشند، لذا با تعیین ژنوتیپ و اثبات نوع D ضعیف میتوان در مصرف بیجای خون RhD منفی صرفه جویی کرد و نیز در مادران دارای فنوتیپ D ضعیف که نوزاد RhD مثبت به دنیا آوردهاند یا دارای جنین RhDمثبت هستند، نیاز به تزریق روگام(که یک فرآورده مشتق از پلاسما و دارای خطرات بالقوه انتقال بیماریها میباشد) نیست و در مصرف آن نیز صرفهجویی میشود(10، 7).
D ضعیف شایعترین نوع D واریانت در امریکا و اروپاست که در یک برآورد 3% از افراد RhD منفی را تشکیل میدهد. از این میزان 80% از نوع 1 ، 2 و3 هستند ولی تاکنون آماری درباره فراوانی آللهای Dضعیف در ایران گزارش نشده است(7). در این مطالعه فراوانی انواع آللهای D ضعیف در نمونههای اهداکنندگان خون با بیان ضعیف آنتیژنD با روشهای مولکولی PCR-SSP ، PCR-RFLP و تعیین توالی DNA مشخص شد.
مواد و روشها
جمعآوری نمونهها:
در یک مطالعه توصیفی، تعداد 105 نمونه از اهداکنندگان خون دارای فنوتیپ D ضعیف که به انتقال خون استان تهران (63 نمونه) و 11 استان دیگر شامل استانهای آذربایجان غربی (7 نمونه)، مرکزی (1 نمونه)، قزوین (4 نمونه)، یزد (8 نمونه)، اردبیل (2 نمونه)، قم (4 نمونه)، خوزستان (1 نمونه)، اصفهان (5 نمونه)، خراسان جنوبی (7 نمونه)، سیستان و بلوچستان (2 نمونه) و هرمزگان (1 نمونه) مراجعه کرده بودند، انتخاب گردید. از اهداکنندگان خون دارای فنوتیپ D ضعیف مقدار 5 میلیلیتر نمونه خون کامل EDTA دار جمعآوری شد.
تعیین فنوتیپ:
ابتـدا سـوسپـانسیـون 5%-3% (در سـرم فیـزیـولوژی)
جدول 1: توالی آغازگرهای D ضعیف نوع 1 تا 5 (حروف کوچک نواحی داخل اینترون را نشان میدهد)
| D ضعیف نوع 1 | جلوبرنده | acacgctatttctttgcagACTTATGG |
| معکوس | GGTACTTGGCTCCCCCGAC | |
| D ضعیف نوع 2 | جلوبرنده | ctccaaatcttttaacattaaattatgcatttaaacagC |
| معکوس | gtgaaaaatcttacCTTCCAGAAAACTTGGTCATC | |
| D ضعیف نوع 3 | جلوبرنده | acagagacggacacaggATGAGATG |
| معکوس | CTTGATAGGATGCCACGAGCCC | |
| D ضعیف نوع 4 | جلوبرنده | AGACTACCACATGAACATGATGCACA |
| معکوس | CAGACAAACTGGGTATCGTTGCTC | |
| D ضعیف نوع 5 | جلوبرنده | GGTGCTGGTGGAGGTGACGGA |
| معکوس | gagcttttggcccttttctccc |
گلبولهای قرمز اهداکنندگان تهیه و سپس کلیه نمونهها که با آنتی - D (ایمیونودیاگنوستیکا ، GmbH) واکنش منفی نشان دادند، با آنتی هیومن گلوبولین آزمایش شدند و با دیدن آگلوتیناسیون قوی در این مرحله، نمونههای D ضعیف مشخص شدند. قبل از آزمایش D ضعیف، آزمایش کومبس مستقیم جهت اطمینان از عدم حضور آنتیبادی یا اجزای کمپلمان در سطح گلبولهای قرمز انجام شد. سپس فنوتیپ هر نمونه با استفاده از آنتی C-، آنتیc-، آنتیE- و آنتیe- تولید شرکت ایمیونودیاگنوستیکا، GmbH تعیین شد. مراحل آزمایش بر اساس دستورالعملهای شرکت سازنده کیت با روش استاندارد لولهای انجام و نتایج ثبت گردید.
به منظور استخراج DNA از خون کامل یا بافیکوت، از Nucleic Acid purification kit محصول شرکت یکتا تجهیز آزما استفاده شد. جهت اطمینان از کیفیت نمونههای استخراج شده، غلظت DNA استخراج شده با قرائت جذب نوری توسط دستگاه نانو دراپ مورد بررسی قرار گرفت و نمونهها در فریزر 25- درجه سانتیگراد ذخیره شد.
روش PCR-SSP جهت تعیین آللهای شایع D ضعیف:
بر روی کلیه نمونهها پس از استخراج DNA با استفاده از آغازگرهای Dضعیف نوع 1 تا 5 به دست آمده از مقاله مـولـر و همکارانش در سـال 2001، آزمـایـش مــولکولی
(Single Specific Primer) PCR-SSP انجام شد(14) (جدول 1). جهت کنترل از هورمون رشد انسانی استفاده شد. حجم کلی واکنش PCR ، µL 25 و شامل: µL 5/12 از Master Mix 2X PCR ، غلظت DNA ng 60 و آغازگر جلوبرنده و معکوس 2/0 میکرو مولار بود. سپس طبق برنامه دمایی زیر در دستگاه ترمال سایکلر مراحل تکثیر انجام شد: 1 چرخه در 94 درجه سانتیگراد به مدت 2 دقیقه و 10 چرخه (در 94 درجه سانتیگراد به مدت 10 ثانیه، در 66 درجه سانتیگراد به مدت 60 ثانیه) و 20 چرخه (در 94 درجه سانتیگراد به مدت 30 ثانیه، 62 درجه سانتیگراد به مدت 60 ثانیه و 72 درجه سانتیگراد به مدت 30 ثانیه). بعد از انجام واکنش PCR محصولات به دست آمده با استفاده از الکتروفورز روی ژل آگارز 2% بررسی شدند.
تعیین توالی DNA (DNA sequencing) :
به منظور تایید آزمایش مولکولی PCR-SSP و نیز تعیین موتاسیونهای موارد منفی که با آغازگر 1 تا 5 D ضعیف باند نداده بودند بر روی همه نمونهها، تکثیر اگزونهای 1، 3، 4، 5، 6 و 9 انجام و جهت سکانس ارسال شد. آغازگرهای تکثیر اگزون از مقاله آندریا دوچر و همکارانش (سال 2005) برداشت شد(21). طبق برنامه دمایی زیر در دستگاه ترمال سایکلر مراحل تکثیر انجام شد: 1 چرخه در 95 درجه سانتیگراد به مدت 2 دقیقه و 35 چرخه(در 95 درجه سانتیگراد به مدت 30 ثانیه، 62 درجه سانتیگراد به مدت 45 ثانیه و 72 درجه سانتیگراد به مدت 30 ثانیه) و 1 چرخه در 72 درجه سانتیگراد به مدت 10 دقیقه. نتیجه تعیین توالی با برنامه کروماس بررسی شد و در صورت مشاهده موتاسیون و مکانیابی آن، نوع آلل D ضعیف مشخص شد.
روش PCR- RFLP جهت تعیین آللهای شایع D ضعیف:
روش PCR-RFLP (Restriction Fragment Length Polymorphism) بر روی نمونههای دارای فراوانی بالای D ضعیف شامل نوع 5 و 15 انجام شد تا به این وسیله نتایج به دست آمده از PCR-SSP تائید گردند. آغازگرهای rb20d/rb21d که از مقاله وگنر و همکارانش در سال 1999 به دست آمده بود، جهت Dضعیف نوع 5 به کار رفت(13). قطعهای به طول bp 210 تکثیر شد که در فرد Rh مثبت به وسیله آنزیم AluI برش خورد و دو قطعه bp 80 و bp 130 ایجاد شد ولی در فرد حامل آلل D ضعیف نوع 5 به دلیل موتاسیون جایگاه برش آنزیم از بین رفته است. از آن جایی که روشPCR-RFLP جهت تایید D ضعیف نوع 15 برای اولین بار انجام شد به این منظور با استفـاده از آغازگرهای زیر اگزون 6 ژن RHD تکثیر گردید:
آغازگر جلوبرنده: 5′-cagtagtgagctggcccatca-3′
و آغازگر معکوس: ccttcagccaaagcagaggagg-3′-5′
طبق برنامه دمایی زیر در دستگاه ترمال سایکلر، مراحل تکثیر انجام شد: 1 چرخه در 94 درجه سانتیگراد به مدت 2 دقیقه و 35 چرخه (در 94 درجه سانتیگراد به مدت 20 ثانیه PCR_ RFLP ، 60 درجه سانتیگراد به مدت 30 ثانیه و 72 درجه سانتیگراد به مدت 30 ثانیه) و 1 چرخه در 72 درجه سانتیگراد به مدت 3 دقیقه. محصول این PCR قطعهای به طولbp 372 تکثیر میکند که در فرد Rh مثبت به وسیله آنزیم KpnI برش میخورد و دو قطعه به طول bp 132 و bp 240 ایجاد میکند ولی در فرد حامل آلل D ضعیف نوع 15 بـه دلیل موتاسیون، جایگاه برش آنزیم از
بین رفته است.
یافتهها
نتایج مربوط به فراوانی فنوتیپ D,C,E,c,e در بین نمونههای D ضعیف:
در بین 105 نمونه D ضعیف، فنوتیپ DccEe (67/46%) بیشترین فراوانی و بعد از آن به ترتیب فنوتیپ DCcee (33/33%) ، فنوتیپ Dccee (57/8%)، فنوتیپ DCCee (67/6%) و فنوتیپ DccEE (8/3%) فراوانی بالایی را دارا بودند. کمترین فراوانی مربوط به فنوتیپDCcEe (95%) بود.
نتایج مربوط به آزمایش مولکولی PCR-SSP :
از بین 105 نمونه، فقط 26 نمونه D ضعیف نوع 1 تا 5 بودند که از این تعداد 11 نمونه (48/10%) D ضعیف نوع 1 ، 8 نمونه (62/7%) Dضعیف نوع 5، 5 نمونه(76/4%) D ضعیف نوع 4 و 2 نمونه(9/1%) D ضعیف نوع 3 بودند. شایان ذکر است که در بین نمونهها، نمونه D ضعیف نوع 2 دیده نشد. نتایج PCR-SSP ، مربوط به 4 نمونه D ضعیف انواع 1، 3، 4 و 5 در شکل آمده است(شکل 1).
نتایج مربوط به تعیین توالی DNA اگزونهای مختلف ژن RHD :
به منظور تایید آزمایش مولکولیPCR-SSP (26 نمونه D ضعیف نوع 1 تا 5) و نیز تعیین سایر آللهای D ضعیف که با روش PCR-SSP قابل تشخیص نبودند(79 نمونه)، تعیین توالی DNA انجام شد و نتایج به دست آمده با برنامه کروماس بررسی گردید.
نتایج این مطالعه وجود 9 آلل مختلف D ضعیف و دو نوع آلل D ناقص را نشان داد. بیشترین فراوانی مربوط به D ضعیف نوع 15 (1/38%) بود. بعد از آن به ترتیب D ضعیف نوع 1 (48/10%)، D ضعیف نوع 5 (62/7%)، D ضعیف نوع 4 (76/4%)، D ضعیف نوع 80 (8/3%)، D ضعیف نوع 3 (9/1%) و D ضعیف نوع 11، 8 و 100 هر کدام (95/0%) قرار داشتند(نمودار 1). دو نوع D ناقص یافت شده در بیـن نمونههــا، D ناقص DLOبا فراوانی در حد(57/8%) و D ناقص Va/DAU با فراوانی فقط (95/0%) قرار داشتند.
به منظور استخراج DNA از خون کامل یا بافیکوت، از Nucleic Acid purification kit محصول شرکت یکتا تجهیز آزما استفاده شد. جهت اطمینان از کیفیت نمونههای استخراج شده، غلظت DNA استخراج شده با قرائت جذب نوری توسط دستگاه نانو دراپ مورد بررسی قرار گرفت و نمونهها در فریزر 25- درجه سانتیگراد ذخیره شد.
روش PCR-SSP جهت تعیین آللهای شایع D ضعیف:
بر روی کلیه نمونهها پس از استخراج DNA با استفاده از آغازگرهای Dضعیف نوع 1 تا 5 به دست آمده از مقاله مـولـر و همکارانش در سـال 2001، آزمـایـش مــولکولی
(Single Specific Primer) PCR-SSP انجام شد(14) (جدول 1). جهت کنترل از هورمون رشد انسانی استفاده شد. حجم کلی واکنش PCR ، µL 25 و شامل: µL 5/12 از Master Mix 2X PCR ، غلظت DNA ng 60 و آغازگر جلوبرنده و معکوس 2/0 میکرو مولار بود. سپس طبق برنامه دمایی زیر در دستگاه ترمال سایکلر مراحل تکثیر انجام شد: 1 چرخه در 94 درجه سانتیگراد به مدت 2 دقیقه و 10 چرخه (در 94 درجه سانتیگراد به مدت 10 ثانیه، در 66 درجه سانتیگراد به مدت 60 ثانیه) و 20 چرخه (در 94 درجه سانتیگراد به مدت 30 ثانیه، 62 درجه سانتیگراد به مدت 60 ثانیه و 72 درجه سانتیگراد به مدت 30 ثانیه). بعد از انجام واکنش PCR محصولات به دست آمده با استفاده از الکتروفورز روی ژل آگارز 2% بررسی شدند.
تعیین توالی DNA (DNA sequencing) :
به منظور تایید آزمایش مولکولی PCR-SSP و نیز تعیین موتاسیونهای موارد منفی که با آغازگر 1 تا 5 D ضعیف باند نداده بودند بر روی همه نمونهها، تکثیر اگزونهای 1، 3، 4، 5، 6 و 9 انجام و جهت سکانس ارسال شد. آغازگرهای تکثیر اگزون از مقاله آندریا دوچر و همکارانش (سال 2005) برداشت شد(21). طبق برنامه دمایی زیر در دستگاه ترمال سایکلر مراحل تکثیر انجام شد: 1 چرخه در 95 درجه سانتیگراد به مدت 2 دقیقه و 35 چرخه(در 95 درجه سانتیگراد به مدت 30 ثانیه، 62 درجه سانتیگراد به مدت 45 ثانیه و 72 درجه سانتیگراد به مدت 30 ثانیه) و 1 چرخه در 72 درجه سانتیگراد به مدت 10 دقیقه. نتیجه تعیین توالی با برنامه کروماس بررسی شد و در صورت مشاهده موتاسیون و مکانیابی آن، نوع آلل D ضعیف مشخص شد.
روش PCR- RFLP جهت تعیین آللهای شایع D ضعیف:
روش PCR-RFLP (Restriction Fragment Length Polymorphism) بر روی نمونههای دارای فراوانی بالای D ضعیف شامل نوع 5 و 15 انجام شد تا به این وسیله نتایج به دست آمده از PCR-SSP تائید گردند. آغازگرهای rb20d/rb21d که از مقاله وگنر و همکارانش در سال 1999 به دست آمده بود، جهت Dضعیف نوع 5 به کار رفت(13). قطعهای به طول bp 210 تکثیر شد که در فرد Rh مثبت به وسیله آنزیم AluI برش خورد و دو قطعه bp 80 و bp 130 ایجاد شد ولی در فرد حامل آلل D ضعیف نوع 5 به دلیل موتاسیون جایگاه برش آنزیم از بین رفته است. از آن جایی که روشPCR-RFLP جهت تایید D ضعیف نوع 15 برای اولین بار انجام شد به این منظور با استفـاده از آغازگرهای زیر اگزون 6 ژن RHD تکثیر گردید:
آغازگر جلوبرنده: 5′-cagtagtgagctggcccatca-3′
و آغازگر معکوس: ccttcagccaaagcagaggagg-3′-5′
طبق برنامه دمایی زیر در دستگاه ترمال سایکلر، مراحل تکثیر انجام شد: 1 چرخه در 94 درجه سانتیگراد به مدت 2 دقیقه و 35 چرخه (در 94 درجه سانتیگراد به مدت 20 ثانیه PCR_ RFLP ، 60 درجه سانتیگراد به مدت 30 ثانیه و 72 درجه سانتیگراد به مدت 30 ثانیه) و 1 چرخه در 72 درجه سانتیگراد به مدت 3 دقیقه. محصول این PCR قطعهای به طولbp 372 تکثیر میکند که در فرد Rh مثبت به وسیله آنزیم KpnI برش میخورد و دو قطعه به طول bp 132 و bp 240 ایجاد میکند ولی در فرد حامل آلل D ضعیف نوع 15 بـه دلیل موتاسیون، جایگاه برش آنزیم از
بین رفته است.
یافتهها
نتایج مربوط به فراوانی فنوتیپ D,C,E,c,e در بین نمونههای D ضعیف:
در بین 105 نمونه D ضعیف، فنوتیپ DccEe (67/46%) بیشترین فراوانی و بعد از آن به ترتیب فنوتیپ DCcee (33/33%) ، فنوتیپ Dccee (57/8%)، فنوتیپ DCCee (67/6%) و فنوتیپ DccEE (8/3%) فراوانی بالایی را دارا بودند. کمترین فراوانی مربوط به فنوتیپDCcEe (95%) بود.
نتایج مربوط به آزمایش مولکولی PCR-SSP :
از بین 105 نمونه، فقط 26 نمونه D ضعیف نوع 1 تا 5 بودند که از این تعداد 11 نمونه (48/10%) D ضعیف نوع 1 ، 8 نمونه (62/7%) Dضعیف نوع 5، 5 نمونه(76/4%) D ضعیف نوع 4 و 2 نمونه(9/1%) D ضعیف نوع 3 بودند. شایان ذکر است که در بین نمونهها، نمونه D ضعیف نوع 2 دیده نشد. نتایج PCR-SSP ، مربوط به 4 نمونه D ضعیف انواع 1، 3، 4 و 5 در شکل آمده است(شکل 1).
نتایج مربوط به تعیین توالی DNA اگزونهای مختلف ژن RHD :
به منظور تایید آزمایش مولکولیPCR-SSP (26 نمونه D ضعیف نوع 1 تا 5) و نیز تعیین سایر آللهای D ضعیف که با روش PCR-SSP قابل تشخیص نبودند(79 نمونه)، تعیین توالی DNA انجام شد و نتایج به دست آمده با برنامه کروماس بررسی گردید.
نتایج این مطالعه وجود 9 آلل مختلف D ضعیف و دو نوع آلل D ناقص را نشان داد. بیشترین فراوانی مربوط به D ضعیف نوع 15 (1/38%) بود. بعد از آن به ترتیب D ضعیف نوع 1 (48/10%)، D ضعیف نوع 5 (62/7%)، D ضعیف نوع 4 (76/4%)، D ضعیف نوع 80 (8/3%)، D ضعیف نوع 3 (9/1%) و D ضعیف نوع 11، 8 و 100 هر کدام (95/0%) قرار داشتند(نمودار 1). دو نوع D ناقص یافت شده در بیـن نمونههــا، D ناقص DLOبا فراوانی در حد(57/8%) و D ناقص Va/DAU با فراوانی فقط (95/0%) قرار داشتند.

شکل 1 : نتایج PCR-SSP، 4 نمونه D ضعیف انواع 1، 3، 4و5 را نشان می دهد. اولین چاهک از سمت راست bp ladder 100 میباشد وبعد از آن به ترتیب نتایج مربوط به PCR-SSP با آغازگرهای D ضعیف انواع 1، 2، 3 ، 4 و 5، هورمون رشد(Hgh) و آخرین چاهک کنترل منفی می باشد. شکل A: D ضعیف نوع 1 ، شکل B: D ضعیف نوع 3 ، شکل C: D ضعیف نوع 4، شکل D: D ضعیف نوع 5.

نمودار 1: فراوانی انواع D ضعیف در بین اهداکنندگان خون استان تهران و سایر استانها
نتایج مربوط به آزمایش مولکولی PCR-RFLP :
به منظور راه اندازی آزمایش، PCR- RFLP فقط بر روی نمونههای D ضعیف 5 و 15 انجام شد. در فردRh مثبت برش با آنزیم AluI دو قطعه bp80 وbp 130 ایجاد میکند ولی در D ضعیف نوع 5 ، محل برش آنزیم AluI به دلیل جایگزینی نوکلئوتیدی از بین رفته است. هم چنین در فرد Rh مثبت برش با آنزیم KpnI دو قطعه bp 132 و bp 240 ایجاد میکند ولی در D ضعیف نوع 15 محل برش آنزیم KpnI به دلیل جایگزینی نوکلئوتیدی از بین رفته است(شکل 2).
به منظور راه اندازی آزمایش، PCR- RFLP فقط بر روی نمونههای D ضعیف 5 و 15 انجام شد. در فردRh مثبت برش با آنزیم AluI دو قطعه bp80 وbp 130 ایجاد میکند ولی در D ضعیف نوع 5 ، محل برش آنزیم AluI به دلیل جایگزینی نوکلئوتیدی از بین رفته است. هم چنین در فرد Rh مثبت برش با آنزیم KpnI دو قطعه bp 132 و bp 240 ایجاد میکند ولی در D ضعیف نوع 15 محل برش آنزیم KpnI به دلیل جایگزینی نوکلئوتیدی از بین رفته است(شکل 2).

شکل 2: نتایج مربوط به PCR- RFLP نمونههای D ضعیف 5 و 15 . شکل A : نتایج PCR-RFLP مربوط به D ضعیف نوع 15. ردیفهای 1، 2 و 3 مربوط به سه نمونه D ضعیف نوع 15، قطعه bp 372 که جایگاه برش آنزیم KpnI را ندارد. - ردیف 4 مربوط به نمونه Rh مثبت دارای دو قطعه bp 132 وbp 240 پس از برش با آنزیم KpnI. شکل B : نتایج PCR-RFLP مربوط به Dضعیف نوع 5 – ردیفهای 1 ، 2، 3 و 4 مربوط به 4 نمونه Dضعیف نوع 5: قطعه bp 210 که جایگاه برش آنزیم AluI را ندارد. - ردیف 5 مربوط به نمونه Rh مثبت دارای دو قطعه bp 80 وbp 130 پس از برش با آنزیم AluI.
بحث
نتایج این مطالعه نشان داد که از بین 105 نمونه دارای فنوتیپ D ضعیف، فقط 13 نمونه(4/12%) D ضعیف نوع 1 و نوع 3 بودند و هیچ نمونه D ضعیف نوع 2 در بین این افراد مشاهده نشد. این در حالی است که مطالعههای متعدد انجام شده در کشورهای اروپایی و آمریکایی فراوانی بین 90%-67% را برای D ضعیف نوع 1، 2و 3 (با خطر آلوایمیونیزاسیون همراه نمیباشند) گـزارش نمـودهاند که اختلاف زیادی با نتایج به دست آمده در مطالعه ما دارد(23، 22، 14، 13، 7). هم چنین نتایج این تحقیق نشان داد هر 13 نمونه D ضعیف نوع 1و 3 دارای آنتی ژن C میباشند، که فرانس وگنر در مطالعه خود در سال 1999 نیز به این یافته اشاره نموده است(13).
در مطالعه حاضر شایعترین نوع D ضعیف مربوط به D ضعیف نوع 15 (845 G>A) با فراوانی 38% بود. این در حالی است که در مطالعههایی که در جمعیتهای سفید پوست انجام شده است، فراوانی این نوع D ضعیف کمتر از 2% گزارش شده است(24-13). فقط در مطالعهای که توسط آگنیزکا ارزینسکا و همکاران در سال 2013 در کشور لهستان انجام شده بود، فراوانی D ضعیـف نوع 15 در بین اهداکنندگان خون دارای ژن RHD ، 19% گزارش شده است(25). فراوانی D ضعیف نوع 15 در بین کشورهای آسیایی بالاتر از کشورهای اروپایی میباشد، به طور مثال فراوانی D ضعیف نوع 15 در کشور چین بسیار متغیر و بین 56%-9/7% گزارش شده است. در افراد دارای آلل D ضعیف نوع 15 (Asp 282Gly) به دلیل تعداد کم آنتیژن D بر روی گلبول قرمز، در صورت دریافت خون +Rh آلوایمیونیزاسیون دیده میشود(18، 16).
از لحاظ فراوانی سایر آنتیژنهای سیستم Rh ، نتایج این مطالعه نشان داد از بین 40 نمونه D ضعیف نوع 15، به جز یک نمونه بقیه همه دارای آنتیژن E بودند. این یافته، یافتهای است که در مطالعهای در سال 1999 که برای اولین بار اساس مولکولی انواع فنوتیپهای D ضعیف را شرح داده است، به آن اشاره شده است(13). ارزینسکا و همکاران در سال 2013 در مطالعهای که در کشور لهستان انجام دادند، به همراهی آنتیژن E با آلل مربوط به D ضعیف نوع 15 اشاره داشتهاند(25). هم چنین سان جیدی و همکاران در سال 2006 گزارش نمودند که 89% افراد دارای آلل مربوط به D ضعیف نوع 15 آنتیژن E را دارا میباشند(26).
در مطالعهای که توسط اُرزینسکا و همکاران در سال 2013 در کشور لهستان انجام شده بود فراوانی D ضعیف نوع 15 در بین اهداکنندگان خون دارای ژن RHD ، 19% گزارش شده است(25). فراوانی D ضعیف نوع 15 در بین کشورهای آسیایی بالاتر از کشورهای اروپایی میباشد، به طور مثال فراوانی D ضعیف نوع 15 در کشور چین بسیار متغیر و بین 56%-9/7% گزارش شده است. در افراد دارای آلل D ضعیف نوع 15 (Asp 282Gly) به دلیل تعداد کم آنتیژن D بر روی گلبول قرمز، در صورت دریافت خون Rh+ آلوایمیونیزاسیون دیده میشود (18، 16).
از لحاظ فراوانی سایر آنتیژنهای سیستم Rh ، نتایج این مطالعه نشان داد از بین 40 نمونه D ضعیف نوع 15، به جز یک نمونه بقیه همه دارای آنتیژن E بودند. این یافته، یافتهای است که در مطالعه وگنر در سال 1999 که برای اولین بار اساس مولکولی انواع فنوتیپهای D ضعیف را شرح داده است، به آن اشاره شده است(13). اُرزینسکا و همکاران در سال 2013 در مطالعهای که در کشور لهستان انجام دادند، به همراهی آنتیژن E با آلل مربوط به D ضعیف نوع 15 اشاره داشتهاند(25). هم چنین سانجیدی و همکاران در سال 2006 گزارش نمودند که 89% افراد دارای آلل مربوط به D ضعیف نوع 15، آنتیژن E را دارا میباشند(26).
شیهویه و همکاران در سال 2014 نیز گزارش نمودند به جز دو مورد از 64 مورد D ضعیف نوع 15، همه موارد دارای آنتیژن E میباشند (27). نتایج این مطالعه نشان داد بعد از D ضعیف نوع 15 و 1 ، سومین واریانت شایع مربوط به D ناقصDLO با فراوانی 57/8% میباشد(D ناقص C>T 851). DLO با فراوانی کمتر از یک درصد در جمعیت سفید پوست، اولین بار توسط انصارت ـ پیرن و همکاران در سال 2004 در کشور فرانسه گزارش شد. افراد دارای این واریانت قادر به تولید آلوآنتی D میباشند(22). نکته قابل توجه این است که 50% موارد D ناقص DLOدر مطالعـه حاضـر مـربوط بـه استـان خراسان جنوبی بود. هم چنین همه 10 نمونه گزارش شده دارای آنتیژن C بودند که این یافته نیز با مطالعه پیـرن هماهنگی داشت(22).
در ایـن مطالعـه D ضعیـف نوع 5 (446 C>A) فراوانی
62/7% را نشان داد که با فراوانی گزارش شده (کمتر از یک درصد) توسط فرانس وگنر در سال 1999 در جمعیت سفید پوست اروپایی دارای فنوتیپ D ضعیف اختلاف زیادی دارد(13). مونا اکاری و همکاران در سال 2015 فراوانی 7/2% را برای D ضعیف نوع 5 در بین اهداکنندگان تونس، دارای فنوتیپ D ضعیف گزارش نمود (28).
همه 8 نمونه D ضعیف نوع 5 گزارش شده دارای آنتیژن E بودند که این یافته نیز با دو مطالعه فوق هماهنگی داشت(28، 13). شایان ذکر است از این 8 نمونه، 7 نمونه مربوط به اهداکنندگان استان تهران بودند.
فراوانی D ضعیف نوع 4 با دو نوع موتاسیون(602 C>G) و(667T>G ) در این مطالعه 76/4% به دست آمد. فرانس وگنر در سال 1999 در جمعیت سفید پوست اروپایی دارای فنوتیپ D ضعیف، فراوانی D ضعیف نوع 4 با دو نوع موتاسیون (602C>G) و (667 T>G) را 3/1% گزارش نموده است(13).
ایمان حسین و همکاران در سال 2013 فراوانی انواع D ضعیف نوع 4 را در کشور مصر جمعاً 48% گزارش نمود در حالی که بیشترین فراوانی در این کشور مربوط به انواع D ناقص میباشد. نتایج این مطالعه با فراوانی به دست آمده در مطالعه ما اختلاف زیادی را نشان میدهد (29). هم چنین مونا اکاری و همکاران در سال 2015 شایعترین نوع D ضعیف در بین اهداکنندگان خون کشور تونس را D ضعیف نوع 4 (91/73%) با انواع مختلف موتاسیونها گزارش نمودند(28). همکر و همکارانش در سال 1999 گزارش نمودند که این موتاسیونها در بین سیاهپوستان آفریقایی بعد از انواع D ناقص بیشترین فراوانی را دارد(30). کارین پریسکو آرنونی و همکاران در سال 2014 نیز فراوانی انواع Dضعیف نوع 4 را بیش از 50% در بین سیاهپوستان کشور برزیل گزارش نمودند(31).
مونا اکاری و همکاران در تحقیق دیگری که در سال 2017 انجام دادند، فراوانی انواع D ضعیف نوع 4 را در تونس 90% اعلام کردند که 88% آن، D ضعیف نوع 0/4 بود و توصیه کردند افراد دارای D ضعیف نوع 0/4 میتوانند بدون خطر آلوایمیونیزاسیون، خون Rh مثبت دریافت کنند(32). نتایج این مطالعهها در مقایسه با جمعیت مورد مطالعه ما تفاوت چشمگیری را برای فراوانی انواع D ضعیف نوع 4 نشان میدهد.
نتیجهگیری
تفاوت چشمگیری بین فراوانی واریانتهای D ضعیف در بین اهداکنندگان خون کشور ما در مقایسه با جمعیتهای سفید پوست اروپایی و آمریکایی با فراوانی بالای انواع D ضعیف(1، 2 و 3) جمعیت آفریقایی با فراوانی بالای انواع D ناقص و D ضعیف نوع 4 و هم چنین جمعیت آسیایی با فراوانی بالای Del وجود دارد(10).
تشکر و قدردانی
از زحمات همکاران بخش اتوماسیون و سرولوژی اختصاصی انتقال خون استان تهران، بخش ایمونوهماتولوژی ستاد مرکزی سازمان انتقال خون و همکاران بخش اتوماسیون و سرولوژی اختصاصی در مراکز انتقال خون استانهای آذربایجان غربی، مرکزی، قزوین، یزد، اردبیل، قم، خوزستان، اصفهان، خراسان جنوبی، سیستان و بلوچستان و هرمزگان که با ارسال نمونه ما را یاری کردند، صمیمانه سپاسگزاریم. این طرح در کمیته دانشگاهی اخلاق در پژوهشهای زیست پزشکی مؤسسه عالی آموزشی و پژوهشی طب انتقال خون با کد IR.TMI.REC.1395.023 مجوز گرفته است.
نوع مطالعه: پژوهشي |
موضوع مقاله:
ايمونوهماتولوژي
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |






