جلد 14، شماره 4 - ( زمستان 1396 )
جلد 14 شماره 4 صفحات 324-314 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Nikkhoo P, Oodi A, Sotoodehnejadnematalahi F. Effect of harmalin on Dnmt1 expression and hypomethylation of P15 gene promoter in NB4 leukemic cell. bloodj 2017; 14 (4) :314-324
URL: http://bloodjournal.ir/article-1-1125-fa.html
URL: http://bloodjournal.ir/article-1-1125-fa.html
نیکخو پریسا، اودی آرزو، ستوده نژاد نعمت الهی فتاح. تاثیر هارمالین بر بیان ژن Dnmt1 و هیپومتیلاسیون پروموتور ژن P15 در رده سلولی لوسمیک NB4. فصلنامه پژوهشی خون. 1396; 14 (4) :314-324
استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون
متن کامل [PDF 681 kb]
(2017 دریافت)
| چکیده (HTML) (7372 مشاهده)
مقدمه
سرطان خون و یا لوسمی یک اختلال نئوپلاستی است که در سلولهای مغز استخوان به وجود میآید و به دنبال آن کلون این سلولها گسترش یافته و وارد خون و بافتها میشوند. اختلالات سلولهای لوسمی ناشی از تغییرات ژنتیکی، اپیژنتیکی و یا تلفیقی از این دو میباشند(1). با توجه به بروز اولیه تغییرات اپیژنتیک و برگشتپذیر بودن این تغییرات، پژوهشهای متعددی در زمینه شناخت تغییرات اپیژنتیک انجام گرفته است و تلاشها جهت فهم مکانیسم و چگونگی بروز این تغییرات، به طور قابل ملاحظهای افزایش یافته است.
تغییرات اپیژنتیک و از جمله متیلاسیون DNA در ناحیه پروموتور ژنهای سرکوبگر تومور به عنوان یکی از مهمترین مکانیسمهای ایجاد بدخیمیهای خونی مطرح است. این فرآیندها که برگشتپذیر هم میباشند، بدون تغییر در سکانس DNA بیان ژن را تحت تاثیر قرار میدهند. متیلاسیون DNA در ناحیه پروموتر ژنهای سرکوبگر تومور به عنوان یکی از مهمترین مکانیسمهای ایجاد بدخیمیهای خونی مطرح است. متیلاسیون DNA توسط آنزیمهای Dnmts صورت میگیرد که مهمترین آن Dnmt1 میباشد(2). هیپرمتیلاسیون نابهجای پروموتر ژنهای سرکوبکننده تومور(TSG) توسط آنزیم Dnmt1 موجب خاموشی این ژنها و شکلگیری انواع لوسمیها میشود. P15 از پروتئینهای تنظیمی چرخه سلولی میباشد که به صورت تنظیمکننده منفی در چرخه عمل میکند. هیپرمتیلاسیون پروموتر این ژنها باعث کاهش بیان این پروتئین شده، این امر باعث کاهش نقاط کنترل چرخه سلولی گردیده و میتواند باعث افزایش خطر سرطانی شدن سلول شود(3). هیپرمتیلاسیون DNA در ژن P15 در 45% از موارد AML و 14% از تمام موارد ALL شناسایی شده است(4). با توجه به بروز اولیه تغییرات اپیژنتیک و برگشتپذیر بودن این تغییرات، پژوهشهای متعددی به سمت و سوی شناخت مهارکنندههای Dnmt1 معطوف گشته است. 5– آزاسیتیدین و دسیتابین به عنوان دو عامل هیپومتیله کننده DNA و مورد تایید FDA در درمان لوسمیهای حاد مورد استفاده قرار میگیرد. با این وجود داروهای آزانوکلئوزیدی فوق به دلیل عملکرد غیر اختصاصی در اتصال به DNA ، تاثیرگذاری محدود آنها در فاز سلولی S و هم چنین استفاده نامناسب از این داروها در درمان لوسمیهای هیپوپرولیفراتیو محدودیتهای کاربردی دارد. به همین دلیل این عرصه به سمت مهارکنندههای سنتتیک غیر نوکلئوزیدی مثل پروکاینامید پیش رفت، البته این مهارکنندهها نیز از قدرت هیپومتیلاسیون ناچیزی برخوردار میباشند. لذا امروزه استفاده از مواد طبیعی که دارای اثر هیپومتیلاسیون بر DNA میباشند، مورد توجه فراوان قرار گرفته است(5). برای مثال کورکامین، پلیفنلهای چای سبز نمونههایی قابل ذکر از این منبع عظیم میباشند که علاوه بر این که فاقد محدودیتها و عوارض مهارکنندههای سنتتیک میباشند با مکانسیمهای مختلف در القای هیپومتیلاسیون پروموتور ژنهای کنترل چرخه سلولی و تاثیر بر بیان ژن Dnmt1 عمل میکنند. هارمالین یکی از آلکالوئیدهای مشتق شده از گیاه اسپند است که دارای خاصیت آنتیپرولیفراتیو بر روی ردههای سلولی لوسمی میباشد؛ ولی مکانیسم عمل و چگونگی عملکرد این دارو در القای این اثر آنتی پرولیفراتیو مشخص نشده است. در این مقاله عوامل دخیل در القای این اثر آنتیپرولیفراتیو بررسی شد و تاثیر هارمالین بر چرخه سلولی، هیپومتیلاسیون ناحیه پروموتور ژن P15، همچنین بیان مجدد ژن P15 در رده سلولی NB4 مورد بررسی قرار گرفت.
مواد و روشها
کشت سلولی و تیمار با داروی هارمالین:
در یک مطالعه تجربی، سلولهای NB4 از بانک سلولی انستیتو پاستور تهیه شدند. تعداد 106× 5/1سلول NB4 در هر میلیلیتر به صورت سوسپانسیونی در محیط حاوی 1640 RPMI (آلمان، سیگما) همراه با FBS 10% ،U/mL 100 پنیسیلین و µg/mL 100 استرپتومایسین(آمریکا، سنت لوئیس و سیگما) در در دمای 37 درجه سانتیگراد و فشار 5% CO2 کشت داده شد. تعداد 106× 3/0 سلول NB4 در هر چاهک از پلیتهای 6 خانهای کشت داده شد. سپس سلولها به مدت 3 روز تحت تاثیر غلظتهای µg/mL10 ، µg/mL 15،µg/mL 20، µg/mL 25 و µg/mL 30 هارمالین (آمریکا، سیگما) و غلظت µM 2 از 5– آزاسیتیدین (آمریکا، سیگما) به عنوان کنترل مثبت مورد مطالعه قرار گرفتند. هارمالین در اتانول خالص و 5– آزاسیتیدین (کنترل مثبت) در حجم مساوی آب مقطر و استیک اسید حل شد.
ارزیابی زندهمانی و شمارش سلولی با استفاده از رنگ تریپان بلو:
تعداد 106 × 3/0 از سلولهای NB4 در پلیتهای 6 خانهای با غلظتهای مختلف هارمالین و در مدت 24 ، 48 و 72 ساعت تیمار شده و با استفاده از رنگ تریپانبلو (آلمان، مرک) 4/0% و لام نئوبار مورد مطالعه قرار گرفته شد. در این آزمایش سلولهای مرده نسبت به تریپان بلو نفوذپذیر هستند و رنگ را جذب میکند اما سلولهای زنده نسبت به این رنگ نفوذ ناپذیر است. برای شمارش سلولهای زنده سلولهای بدون رنگ را در خانههای گلبول سفید شمارش شد و میانگین گرفته شد.
ارزیابی تاثیر سایتوتوکسیک هارمالین با استفاده از روش MTT :
به منظور بررسی تاثیرات سایتوتوکسیک داروها به روش سنجش MTT ، به هر چاهک از پلیت 96 تایی، 106 × 15/0 سلول تحت تاثیر غلظتهای مختلف دارو(µg/mL 10 ، µg/mL 15 ، µg/mL 20 ، µg/mL 25 ، µg/mL 30) به حجم 100 میکرولیتر اضافه شد. چاهکهایی که تنها حاوی محیط کشت و سلول است و دارویی ندارد، به عنوان گروه کنترل منفی استفاده شدند. پلیتهای آماده شده در انکوباتور با دمای 37 درجه سانتیگراد و فشار 5% CO2 قرارداده شدند. با توجه به این که زمانهای مختلف 1 تا 3 روز برای انکوباسیون سلولها با رقتهای مختلف دارویی در نظر گرفته شده بودند، بعد از اتمام زمان انکوباسیون به هر چاهک محلول MTT به غلظت mg/mL 5 و حجم 10 میکرولیتر افزوده شد و سپس پلیتها 4 تا 6 ساعت در دمای 37 درجه سانتیگراد انکوبه شدند. بعد از به اتمام رسیدن این 4-6 ساعت به هر چاهک به منظور حل شدن بلورهای فورومازان 150 میکرولیتر DMSOاضافه شد و پس از هموژن کردن هر پلیت، توسط دستگاه الایزا ریدر جذب نوری در طول موج 570 نانومتر خوانده شد.
ارزیابی چرخه سلولی با استفاده رنگ PI و فلوسیتومتری:
آنالیز چرخه سلولی یکی از اولین کاربردهای فلوسیتومتری به شمار میرود. اصول این آنالیز بر اساس رنگآمیزی DNA سلول با رنگهای مخصوصDNA است، به طوری که میزان رنگ جذب شده متناسب با محتوای DNA سلول میباشد و چرخه سلولی دارای 4 مرحله متمایز است:G1SG2M همه سلولها در فاز G1 محتوای یکسان DNA دارند و بنابراین یک پیک باریک در نمودار فلورسانس به دست میآید، ضریب تغییرات (CV) عرض پیک را نشانه میدهد. سلولها در فاز G2/M دو برابر محتوای DNA در فاز G1 را دارند، بنابراین پیک ایجاد شده در موقعیت دو برابر پیک G1 قرار دارد. از نظر تئوری، نسبت G2 به G1، 2 به 1 است اما در عمل معمولاً کمتر از آن به دست میآید. فاصله بینG1 و G2 توسط سلولهایی که در فاز Sهستند اشغال شده است.
سلولهای NB4 کشت داده شده (106×1) تحت تاثیر غلظتهای(µg/mL 15 ، µg/mL 20) هارمالین در مدت زمان دو روز انکوبه شدند. سپس سلولها را دو بار با 200 میکرولیتر PBS شستشو داده و بعد از آخرین شستشو، 200 میکرولیتر PBS به توده سلولی اضافه شده و سوسپانسیون سلولی تهیه شد. 50 میکرولیتر از سوسپانسیون برداشته شده و به آن 5/0 میلیلیتر RNase اضافه شد و سپس 50 میکرولیتر تریتون 10% و 5/0 میکرولیتر رنگ PI افزوده شد و به مدت 30 دقیقه در 37 درجه سانتیگراد انکوبه شد. در این مرحله نمونهها جهت ارائه به دستگاه فلوسایتومتری آماده شدند.
استخراج RNA و ساختcDNA :
سلولهای کشت داده شده NB4، تحت تاثیر غلظت µg/mL 15 هارمالین در مدت زمان دو روز انکوبه شد. سلولهای موجود در فلاسک را شمارش و آنها را در میکروتیوب 5/1 میلیلیتری ریخته و در دور g1000 به مدت 6 دقیقه سانتریفیوژ مینماییم. مایع رویی را خارج کرده و به محتوای ته لوله 500 میکرولیتر PBS اضافه مینماییم و مجدداً با همان دور و زمان سانتریفیوژ را تکرار میکنیم. سپس استخراج RNA به وسیله کیت و طبق دستورالعمل (آمریکا، کیاژن) صورت گرفت. بر طبق دستورالعمل کیت استخراج RNA بافر RLT را µL 350 به پلاک سلولی اضافه کرده و مخلوط میکنیم. µL 350 از الکل 70% را به محلول بالا اضافه کرده و آن را مخلوط مینماییم و سپس به ستون اضافه میکنیم و ستون را در دور g 9300 به مدت 15 ثانیه سانتریفیوژ مینماییم. مواد جمع شده میکروتیوب زیر ستون را خارج کرده، یک میکروتیوب دیگر در زیر آن قرار میدهیم و به ستون µL 500 از محلول شستشو RPE همراه الکل را اضافه کرده و آن را در دور g 9300 به مدت 15 ثانیه سانتریفیوژ میکنیم. در نهایت غلظت RNA در دستگاه نانو دراپ خوانده شد که برحسب نانوگرم بر میکرولیتر به دست آورده شد. ساخت cDNA به وسیله آنزیم نسخهبردار معکوس توسط کیت(ایران، 4500YT) و با آغازگر اولیگو dT طبق
دستورالعمل این کیت انجام گرفته شد. از cDNA ساخته شده یک PCR با آغازگر GAPDH (ژن خانهدار) و آغازگر Dnmt1 و P15 قبل از Real Time PCR انجام شد و سپس بر روی ژل 5/1% ، کیفیت cDNA ساخته شده بررسی گردید.
Real-time PCR :
آزمون Real time PCR در دستگاه RotorGene 3000 system (کوربت) و در حجم 20 میکرولیتر انجام شد. پیش از بررسی نسبی بیان ژنهای مورد مطالعه، شرایط تکثیر قطعات توسط روش Real-time PCR برای ژنهای مورد مطالعه P15 و Dnmt1 و ژنهای کنترل داخلی Bact و GAPDH از نظر دمای اتصال آغازگرها و انجام بهینه تکثیر، بهینهسازی و نرمالیزه شد. توالی آغازگرهایReal-time PCR اختصاصی ژن P15 و Dnmt1 و ژنهای کنترل داخلی Bact و GAPDH (ایران، ژن فناوران) در جدول آمده است(جداول 3-1). در انتها برای محاسبه تغییرات بیان ژن از فرمول CTΔΔ2- استفاده شد.
شکل 1 : نمودار جذب نوری سلولهای NB4 حاصل آزمایشMTT تحت تاثیر غلظتهای مختلف داروی هارمالین و 5-آزاسیتیدین (کنترل مثبت، 0 CV= ؛ µM 2) سلولهایNB4 بدون تاثیر دارو(کنترل منفی)(3 n= ، 05/0 p< (*) و (**) (01/0 p<) دادههای آماری در مقایسه دوزهای مختلف دارو در مقایسه با سلولهای بدون تاثیر دارو با استفاده از t-Test نشان داده شده است.)

شکل 2 : نمودارهای مربوط به فلوسیتومتری با استفاده از رنگ PI جهت بررسی چرخه سلولی، RN1 میزان سلولهای متوقف شده در فاز G0G1 را نشان میدهد، RN2 سلولهای متوقف شده در فاز Sو RN3 سلولهای متوقف شده در فاز G2Mرا نشان میدهد. تصویر Aسلولها NB4 را بدون تاثیر دارو، B سلولهای NB4تیمار شده با 5- آزاسیتیدین(کنترل مثبت، µM 2) و C سلول تیمار شده با هارمالین را در دوز µg/mL 15 پس از 48 ساعت نشان میدهد.
پایینتر هارمالین یعنی µg/mL 15 هارمالین را انتخاب کردیم. داروی 5-آزاسیتیدین که به عنوان کنترل مثبت تلقی میشد در غلظت µM2 باعث توقف سلولی در فاز S میشود(شکل 2).
تاثیر هارمالین بر بیان ژن Dnmt1با استفاده از Real-time PCR :
بیان ژن Dnmt1 درسلولهای NB4 تحت تاثیر غلظت µg/mL 15 هارمالین نسبت به سلولهای NB4تیمار نشده نمونه کنترل کاهش نشان داده است(001/0 p<). کاهش بیان ژن Dnmt1 در غلظت µg/mL 15 هارمالین نسبت به کاهش بیان ایجاد شده در اثر تاثیر 5– آزاسیتیدین بر سلولها به صورت معناداری بیشتر میباشد(01/0 p<) (شکل 3).
نتایج تاثیر هارمالین بر بیان ژن P15با استفاده ازReal-time PCR :
نتایج تاثیر هارمالین (µg/mL 15) پس از 48 ساعت موجب افزایش بیان ژن P15 در مقایسه با نمونه کنترل منفی
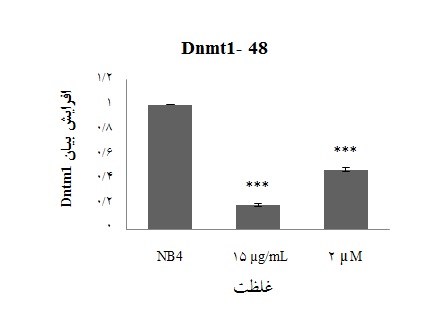
شکل 3 : نمودار میزان بیان Dnmt1در رده سلولی NB4تحت تاثیر هارمالین و 5-آزاسیتیدین(کنترل مثبت، غلظت µM 2) پس از 48 ساعت(کنترل منفی 0 cv=) 3 n= (***)(001/0 p<). دادههای آماری در مقایسه دوزهای مختلف دارو با سلولهای بدون تاثیر دارو(کنترل منفی یا NB4) با استفاده از t-test نشان داده شده است.
و یا سلولهای غیر تیمار شده NB4 شده است(3 n= ، 01/0 p<). این افزایش بیان ژن P15 در غلظت µg/mL 15 هارمالین نسبت به نمونه کنترل مثبت و یا 5-آزاسیتیدین با غلظت µM2 معنادار میباشد(01/0 p<)(شکل 4).
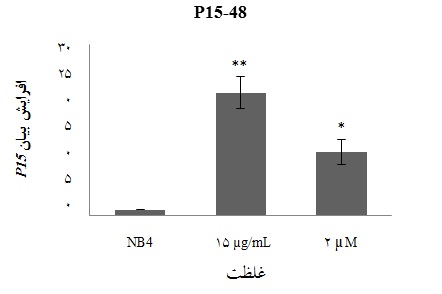
شکل 4: میزان بیان ژن p15در رده سلولی NB4تحت تاثیر هارمالین و 5-آزاسیتیدین )کنتـرل مثبـت) پـس از 48 ساعـت (کنترل منفی 0 cv=)(3 n= ، 05/0 p< (*) و 01/0 p< (**)) دادههای آماری مقایسه دوزهای مختلف دارو با سلولهای بدون تاثیر دارو(کنترل منفی) با استفاده از t-test را نشان داده است.

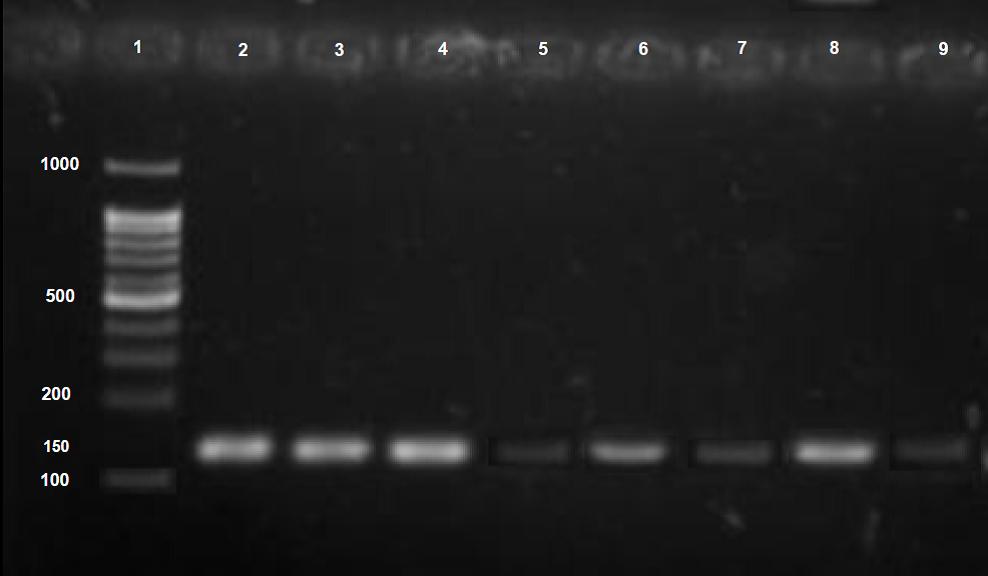
شکل 5: بررسی محصول MSP بر روی ژل 2%، ستون 1 ladder ، ستون 2 کنترل غیر متیله (U) با آغازگر غیر متیله P15 ، ستون 3 کنترل متیله با آغازگر متیله P15 (M)، ستون 4NB4 غیر تیمار شده با آغازگر متیله، ستون 5 نمونه غیر تیمار شده NB4 با آغازگر غیر متیله، ستون 6 NB4 تیمار شده با 5- آزاسیتیدین با آغازگر غیر متیله ، ستون 7NB4 تیمار شده با 5-آزاسیتیدین با آغازگر متیله ستون 8 NB4 تیمار شده با هارمالین با آغازگر غیر متیله، ستون 9NB4 تیمار شده با هارمالین با آغازگر متیله.
ارزیابی وضعیت متیلاسیون پروموتور ژن P15:
 تکثیر با آغازگر متیله(M) نشاندهنده متیلاسیون نواحی CpG درون توالی آغازگرها و تکثیر با آغازگر غیرمتیله(U) نشاندهنده عدم وجود متیلاسیون در نواحی CpG درون توالی آغازگرها میباشد و تکثیر نمونه مورد نظر با هر دو آغازگر M و U نشان دهنده متیلاسیون نسبی است. نتایج نشان داد که پروموتور ژن P15 رده سلولی NB4 ، متیله است. هارمالین در غلظت µg/mL 15 موجب هیپومتیله شدن پروموتور ژن P15 شده است(شکل 5).
تکثیر با آغازگر متیله(M) نشاندهنده متیلاسیون نواحی CpG درون توالی آغازگرها و تکثیر با آغازگر غیرمتیله(U) نشاندهنده عدم وجود متیلاسیون در نواحی CpG درون توالی آغازگرها میباشد و تکثیر نمونه مورد نظر با هر دو آغازگر M و U نشان دهنده متیلاسیون نسبی است. نتایج نشان داد که پروموتور ژن P15 رده سلولی NB4 ، متیله است. هارمالین در غلظت µg/mL 15 موجب هیپومتیله شدن پروموتور ژن P15 شده است(شکل 5).
بحث
آلکالوئیدهای مشتق شده از گیاه اسپند دارای خاصیت آنتیپرولیفراتیو بر روی ردههای سلولی لوسمیک میباشد(8، 7). در این مطالعه هارمالین که یکی از آلکالوئیدهای مشتق شده از گیاه اسپند است به عنوان یک عامل ضد سرطان و هم چنین عامل مهار کننده متیلاسیون DNA مورد مطالعه قرارگرفته است. هارمالین دارای خاصیت سایتوتوکسیک به صورت وابسته به دوز و زمان میباشد که نتایج مشابهی از تاثیر این دارو و سایر داروهای استخراج شده از گیاه اسپند بر روی ردههای مختلف لوسمیک گزارش شده است(9، 7). نتایج این مطالعه نشان داد که سلولهای تیمار شده با هارمالین پس از 48 ساعت در دوز µg/mL 15 باعث توقف سلولهای لوسمی در فاز G0/G1 میشود. در صورتی که داروی 5-آزاسیتیدین به عنوان کنترل مثبت در غلظت 2 میکرومولار باعث توقف سلولی در فاز S میگردد. نتیجه مشابهی توسط بلوم و همکارانش و منتسا و همکارانش در سال 2013 بر روی 5-آزاسیتیدین انجام شد که نشان داد 5-آزاسیتیدین موجب توقف چرخه سلولی در فاز S میشوند(11، 10). بروتنسکیت و همکاران در سال 2016 به بررسی تاثیر پروکانامید پرداختند، که این دارو در غلظت 5 میکرومولار باعث توقف سلولهای لوسمی NB4در فاز G0G1 چرخه سلولی شد. این دارو در غلظت 5 میکرومولار پروکانامید بیان ژن Dnmt1 را کاهش میدهد(2). اودی و همکاران در سال 2017 به بررسی هارمین(یکی دیگر از آلکالوئید گیاهی مشتق شده از گیاه اسپند) و تاثیر دوزهای آنتی پرولیفراتیو آن بر رده سلولی لوسمی NB4 پرداختند، هارمین پس از 72 ساعت وابسته به دوز و زمان بوده که در غلظت µg/mL 2/51 باعث توقف رده سلولی NB4 در فاز چرخه سلول G0G1 شد(12). همسا و همکاران در سال 2011 نتایج مشابهی از تاثیر هارمین در غلظتهای پایین هارمین به دست آوردند(13). هارمالین از غلظت µg/mL 15 موجب کاهش بیان ژن Dnmt1 و هیپومتیلاسیون در پروموتر ژن P15 میشود. با توجه به هیپومتیلاسیون در پروموتر ژن P15، انتظار میرود بیان ژن P15 افزایش پیدا کند و بررسی تاثیر دوزهای آنتیپرولیفراتیو هارمالین بر بیان ژن P15 در رده سلولی NB4 نشان داد که هارمالین در غلظت µg/ml 15موجب افزایش 19 برابری بیان ژن P15 میگردد. اودی و همکاران در بررسی هارمین بر روی سلولهای لوسمی NB4 در غلظت µg/mL 6/25 موجب کاهش بیان 58% mRNA Dnmt1 و در غلظت µg/ml 2/51 موجب کاهش 65% در بیان ژن Dnmt1 میشود. که این کاهش باعث هیپومتیله شدن پروموتر P15 گردیده و این امر باعث افزایش بیان P15 شده است. علاوه بر هارمین و هارمالین، ترکیبات دیگری از گیاهان باعث تاثیر در هیپومتیلاسیون سلولهای لوسمی میشوند. جیان هو و همکارانش در سال 2013 به بررسی متیلاسیون پروموتور ژن P15پرداختند و بررسیهای آنها نشان داد که کورکامین(µg/mL 36) موجب توقف سلولهای NB4 در فار G1 چرخه سلولی و هم چنین کاهش متیلاسیون پروموتور ژن P15 ومتعاقب آن، افزایش 5 برابری در بیان ژن P15 میشود(14). حسن حمزه و همکاران در سال 2014 به بررسی تاثیر کورکومین و دی متوکسی کورکومین پرداختند، که نتایج بررسی نشان داد این دو دارو تاثیر سیتوتوکسیک و هیپومتیلاسیون پروموتور بر رده سلول لوسمی را نداشته، اما از مسیری دیگر بیان پروموتر ژن P15 را افزایش میدهند(15). هم چنین اکوار وهمکارانشان در سال 2012 نشان دادند که EGCG (Epigallocatechin-3-
gallat) در غلظت µg/mL 30 موجب هیپومتیله شدن پروموتور ژنهای P16 ، TSGL و P73 در سلولهای Jurkat و افزایش بیان این ژنها میشود(16). با توجه به گزارشهای ارائه شده هارمالین در مقایسه با سایر داروهای طبیعی مانند کورکامین، پلیفنل چای سبز(EGCG)، ماهانین و هارمین در غلظت پایینتر، اثر بخشی بیشتری بر روی هیپومتیلاسیون پروموتر ژن سلول لوسمی دارد(17).
نتیجهگیری
با توجه به هیپرمتیلاسیون ژنهای سرکوبکننده تومور در بیماران APLو هم چنین اثر بخشی داروی هارمالین در القای اثرات سیتوتوکسیک در سلولهای پرومیلوسیتکNB4 و هم چنین کاهش بیان Dnmt1 و تاثیر آن بر هیپومتیلاسیون ژن P15 که موجب افزایش بیان ژن P15 در این رده سلولی میشود، میتوان چنین پیشنهاد داد که این دارو میتواند به عنوان یک راهکار درمانی مناسب چه به صورت مونوتراپی و چه به صورت داروی مکمل همراه با داروهای متداول APL مورد استفاده قرار گیرد.
تشکر و قدردانی
این مقاله حاصل پایان نامه کارشناسی ارشد دانشگاه آزاد اسلامی واحد علوم و تحقیقات میباشد. بدین وسیله از مرکز تحقیقات سازمان انتقال خون و خانم دکتر آقایی قدردانی مینمایم. هم چنین شایسته است از آقای دکتر امیریزاده و خانم دکتر محمدیپور که در این راه از راهنمایی ایشان بهرمند شدهام بسیار تشکر نمایم. از همکاری بیمارستان شریعتی و خانم دکتر رستمی نیز تشکر مینمایم.
متن کامل: (4406 مشاهده)
تاثیر هارمالین بر بیان ژن Dnmt1 و هیپومتیلاسیون پروموتور ژن P15
در رده سلولی لوسمیک NB4
پریسا نیکخو1، آرزو اودی2، فتاح ستوده نژاد نعمتالهی3
چکیده
سابقه و هدف
متیلاسیون DNA در ناحیه پروموتر ژنهای سرکوبگر تومور از جمله P15 ، به عنوان یکی از مهمترین مکانیسمهای ایجاد بدخیمیهای خونی مطرح است .هارمالین یکی از آلکالوئیدهای مشتق شده از گیاه اسپند است که دارای خاصیت آنتیپرولیفراتیو بر روی ردههای سلولی لوسمیک میباشد. در این مقاله تاثیر هارمالین بر کاهش بیان ژنDnmt1 و هیپومتیلاسیون ناحیه پروموتر ژن P15 در رده سلولی NB4 مورد بررسی قرار گرفت.
مواد و روشها
در این مطالعه تجربی با استفاده از روش MTT ، تاثیرات سیتوتوکسیک بر رده سلولی NB4 تا 72 ساعت بررسی شد. جهت بررسی چرخه سلولی پس از تیمار با هارمالین، از روش فلوسیتومتری استفاده شد. وضعیت متیلاسیون پروموتور ژن P15 با استفاده از روش Methylation specific PCR بررسی شد. با استفاده از روش Real-time PCR ، میزان بیان ژنهای Dnmt1 و P15 بررسی گردید.
یافتهها
نتایج نشان داد که داروی هارمالین از غلظت µg/mL 15 به بالا، پس از 48 ساعت به صورت وابسته به دوز و زمان دارای خاصیت آنتیپرولیفراتیو بر روی رده سلولی NB4 میباشد. آنالیز چرخه سلولی نشاندهنده ایست سلولها در فاز G0G1 است. هارمالین در غلظت µg/mL15 موجب کاهش بیان ژن Dnmt1 ، هیپومتیلاسیون پروموتور ژنP15 و افزایش مجدد بیان ژنP15 در رده سلولی NB4میشود.
نتیجه گیری
با توجه به اثر بخشی داروی هارمالین بر کاهش بیان ژن Dnmt1 و هیپومتیلاسیون پروموتور و افزایش بیان ژن P15 در این رده سلولی، میتوان چنین پیشنهاد کرد که این دارو میتواند به عنوان یک راهکار درمانی مناسب به صورت منوتراپی و یا داروی مکمل همراه با داروهای متداول لوسمی پرومیلوسیتیک حاد مورد استفاده قرار گیرد.
کلمات کلیدی: متیلاسیون، ژن، لوسمی
تاریخ دریافت: 23/3/96
تاریخ پذیرش: 29/5/96
1- کارشناس ارشد بیولوژی سلولی و مولکولی ـ دانشگاه آزاد اسلامی واحد علوم و تحقیقات ـ تهران ـ ایران
2- مؤلف مسئول: PhD خونشناسی و بانک خون ـ استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
3- PhD ایمنی سلولی و مولکولی ـ استادیار گروه ژنتیک سلولی و مولکولی ـ دانشکده علوم پایه دانشگاه آزاد اسلامی واحد علوم و تحقیقات ـ تهران ـ ایران
در رده سلولی لوسمیک NB4
پریسا نیکخو1، آرزو اودی2، فتاح ستوده نژاد نعمتالهی3
چکیده
سابقه و هدف
متیلاسیون DNA در ناحیه پروموتر ژنهای سرکوبگر تومور از جمله P15 ، به عنوان یکی از مهمترین مکانیسمهای ایجاد بدخیمیهای خونی مطرح است .هارمالین یکی از آلکالوئیدهای مشتق شده از گیاه اسپند است که دارای خاصیت آنتیپرولیفراتیو بر روی ردههای سلولی لوسمیک میباشد. در این مقاله تاثیر هارمالین بر کاهش بیان ژنDnmt1 و هیپومتیلاسیون ناحیه پروموتر ژن P15 در رده سلولی NB4 مورد بررسی قرار گرفت.
مواد و روشها
در این مطالعه تجربی با استفاده از روش MTT ، تاثیرات سیتوتوکسیک بر رده سلولی NB4 تا 72 ساعت بررسی شد. جهت بررسی چرخه سلولی پس از تیمار با هارمالین، از روش فلوسیتومتری استفاده شد. وضعیت متیلاسیون پروموتور ژن P15 با استفاده از روش Methylation specific PCR بررسی شد. با استفاده از روش Real-time PCR ، میزان بیان ژنهای Dnmt1 و P15 بررسی گردید.
یافتهها
نتایج نشان داد که داروی هارمالین از غلظت µg/mL 15 به بالا، پس از 48 ساعت به صورت وابسته به دوز و زمان دارای خاصیت آنتیپرولیفراتیو بر روی رده سلولی NB4 میباشد. آنالیز چرخه سلولی نشاندهنده ایست سلولها در فاز G0G1 است. هارمالین در غلظت µg/mL15 موجب کاهش بیان ژن Dnmt1 ، هیپومتیلاسیون پروموتور ژنP15 و افزایش مجدد بیان ژنP15 در رده سلولی NB4میشود.
نتیجه گیری
با توجه به اثر بخشی داروی هارمالین بر کاهش بیان ژن Dnmt1 و هیپومتیلاسیون پروموتور و افزایش بیان ژن P15 در این رده سلولی، میتوان چنین پیشنهاد کرد که این دارو میتواند به عنوان یک راهکار درمانی مناسب به صورت منوتراپی و یا داروی مکمل همراه با داروهای متداول لوسمی پرومیلوسیتیک حاد مورد استفاده قرار گیرد.
کلمات کلیدی: متیلاسیون، ژن، لوسمی
تاریخ دریافت: 23/3/96
تاریخ پذیرش: 29/5/96
1- کارشناس ارشد بیولوژی سلولی و مولکولی ـ دانشگاه آزاد اسلامی واحد علوم و تحقیقات ـ تهران ـ ایران
2- مؤلف مسئول: PhD خونشناسی و بانک خون ـ استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
3- PhD ایمنی سلولی و مولکولی ـ استادیار گروه ژنتیک سلولی و مولکولی ـ دانشکده علوم پایه دانشگاه آزاد اسلامی واحد علوم و تحقیقات ـ تهران ـ ایران
مقدمه
سرطان خون و یا لوسمی یک اختلال نئوپلاستی است که در سلولهای مغز استخوان به وجود میآید و به دنبال آن کلون این سلولها گسترش یافته و وارد خون و بافتها میشوند. اختلالات سلولهای لوسمی ناشی از تغییرات ژنتیکی، اپیژنتیکی و یا تلفیقی از این دو میباشند(1). با توجه به بروز اولیه تغییرات اپیژنتیک و برگشتپذیر بودن این تغییرات، پژوهشهای متعددی در زمینه شناخت تغییرات اپیژنتیک انجام گرفته است و تلاشها جهت فهم مکانیسم و چگونگی بروز این تغییرات، به طور قابل ملاحظهای افزایش یافته است.
تغییرات اپیژنتیک و از جمله متیلاسیون DNA در ناحیه پروموتور ژنهای سرکوبگر تومور به عنوان یکی از مهمترین مکانیسمهای ایجاد بدخیمیهای خونی مطرح است. این فرآیندها که برگشتپذیر هم میباشند، بدون تغییر در سکانس DNA بیان ژن را تحت تاثیر قرار میدهند. متیلاسیون DNA در ناحیه پروموتر ژنهای سرکوبگر تومور به عنوان یکی از مهمترین مکانیسمهای ایجاد بدخیمیهای خونی مطرح است. متیلاسیون DNA توسط آنزیمهای Dnmts صورت میگیرد که مهمترین آن Dnmt1 میباشد(2). هیپرمتیلاسیون نابهجای پروموتر ژنهای سرکوبکننده تومور(TSG) توسط آنزیم Dnmt1 موجب خاموشی این ژنها و شکلگیری انواع لوسمیها میشود. P15 از پروتئینهای تنظیمی چرخه سلولی میباشد که به صورت تنظیمکننده منفی در چرخه عمل میکند. هیپرمتیلاسیون پروموتر این ژنها باعث کاهش بیان این پروتئین شده، این امر باعث کاهش نقاط کنترل چرخه سلولی گردیده و میتواند باعث افزایش خطر سرطانی شدن سلول شود(3). هیپرمتیلاسیون DNA در ژن P15 در 45% از موارد AML و 14% از تمام موارد ALL شناسایی شده است(4). با توجه به بروز اولیه تغییرات اپیژنتیک و برگشتپذیر بودن این تغییرات، پژوهشهای متعددی به سمت و سوی شناخت مهارکنندههای Dnmt1 معطوف گشته است. 5– آزاسیتیدین و دسیتابین به عنوان دو عامل هیپومتیله کننده DNA و مورد تایید FDA در درمان لوسمیهای حاد مورد استفاده قرار میگیرد. با این وجود داروهای آزانوکلئوزیدی فوق به دلیل عملکرد غیر اختصاصی در اتصال به DNA ، تاثیرگذاری محدود آنها در فاز سلولی S و هم چنین استفاده نامناسب از این داروها در درمان لوسمیهای هیپوپرولیفراتیو محدودیتهای کاربردی دارد. به همین دلیل این عرصه به سمت مهارکنندههای سنتتیک غیر نوکلئوزیدی مثل پروکاینامید پیش رفت، البته این مهارکنندهها نیز از قدرت هیپومتیلاسیون ناچیزی برخوردار میباشند. لذا امروزه استفاده از مواد طبیعی که دارای اثر هیپومتیلاسیون بر DNA میباشند، مورد توجه فراوان قرار گرفته است(5). برای مثال کورکامین، پلیفنلهای چای سبز نمونههایی قابل ذکر از این منبع عظیم میباشند که علاوه بر این که فاقد محدودیتها و عوارض مهارکنندههای سنتتیک میباشند با مکانسیمهای مختلف در القای هیپومتیلاسیون پروموتور ژنهای کنترل چرخه سلولی و تاثیر بر بیان ژن Dnmt1 عمل میکنند. هارمالین یکی از آلکالوئیدهای مشتق شده از گیاه اسپند است که دارای خاصیت آنتیپرولیفراتیو بر روی ردههای سلولی لوسمی میباشد؛ ولی مکانیسم عمل و چگونگی عملکرد این دارو در القای این اثر آنتی پرولیفراتیو مشخص نشده است. در این مقاله عوامل دخیل در القای این اثر آنتیپرولیفراتیو بررسی شد و تاثیر هارمالین بر چرخه سلولی، هیپومتیلاسیون ناحیه پروموتور ژن P15، همچنین بیان مجدد ژن P15 در رده سلولی NB4 مورد بررسی قرار گرفت.
مواد و روشها
کشت سلولی و تیمار با داروی هارمالین:
در یک مطالعه تجربی، سلولهای NB4 از بانک سلولی انستیتو پاستور تهیه شدند. تعداد 106× 5/1سلول NB4 در هر میلیلیتر به صورت سوسپانسیونی در محیط حاوی 1640 RPMI (آلمان، سیگما) همراه با FBS 10% ،U/mL 100 پنیسیلین و µg/mL 100 استرپتومایسین(آمریکا، سنت لوئیس و سیگما) در در دمای 37 درجه سانتیگراد و فشار 5% CO2 کشت داده شد. تعداد 106× 3/0 سلول NB4 در هر چاهک از پلیتهای 6 خانهای کشت داده شد. سپس سلولها به مدت 3 روز تحت تاثیر غلظتهای µg/mL10 ، µg/mL 15،µg/mL 20، µg/mL 25 و µg/mL 30 هارمالین (آمریکا، سیگما) و غلظت µM 2 از 5– آزاسیتیدین (آمریکا، سیگما) به عنوان کنترل مثبت مورد مطالعه قرار گرفتند. هارمالین در اتانول خالص و 5– آزاسیتیدین (کنترل مثبت) در حجم مساوی آب مقطر و استیک اسید حل شد.
ارزیابی زندهمانی و شمارش سلولی با استفاده از رنگ تریپان بلو:
تعداد 106 × 3/0 از سلولهای NB4 در پلیتهای 6 خانهای با غلظتهای مختلف هارمالین و در مدت 24 ، 48 و 72 ساعت تیمار شده و با استفاده از رنگ تریپانبلو (آلمان، مرک) 4/0% و لام نئوبار مورد مطالعه قرار گرفته شد. در این آزمایش سلولهای مرده نسبت به تریپان بلو نفوذپذیر هستند و رنگ را جذب میکند اما سلولهای زنده نسبت به این رنگ نفوذ ناپذیر است. برای شمارش سلولهای زنده سلولهای بدون رنگ را در خانههای گلبول سفید شمارش شد و میانگین گرفته شد.
ارزیابی تاثیر سایتوتوکسیک هارمالین با استفاده از روش MTT :
به منظور بررسی تاثیرات سایتوتوکسیک داروها به روش سنجش MTT ، به هر چاهک از پلیت 96 تایی، 106 × 15/0 سلول تحت تاثیر غلظتهای مختلف دارو(µg/mL 10 ، µg/mL 15 ، µg/mL 20 ، µg/mL 25 ، µg/mL 30) به حجم 100 میکرولیتر اضافه شد. چاهکهایی که تنها حاوی محیط کشت و سلول است و دارویی ندارد، به عنوان گروه کنترل منفی استفاده شدند. پلیتهای آماده شده در انکوباتور با دمای 37 درجه سانتیگراد و فشار 5% CO2 قرارداده شدند. با توجه به این که زمانهای مختلف 1 تا 3 روز برای انکوباسیون سلولها با رقتهای مختلف دارویی در نظر گرفته شده بودند، بعد از اتمام زمان انکوباسیون به هر چاهک محلول MTT به غلظت mg/mL 5 و حجم 10 میکرولیتر افزوده شد و سپس پلیتها 4 تا 6 ساعت در دمای 37 درجه سانتیگراد انکوبه شدند. بعد از به اتمام رسیدن این 4-6 ساعت به هر چاهک به منظور حل شدن بلورهای فورومازان 150 میکرولیتر DMSOاضافه شد و پس از هموژن کردن هر پلیت، توسط دستگاه الایزا ریدر جذب نوری در طول موج 570 نانومتر خوانده شد.
ارزیابی چرخه سلولی با استفاده رنگ PI و فلوسیتومتری:
آنالیز چرخه سلولی یکی از اولین کاربردهای فلوسیتومتری به شمار میرود. اصول این آنالیز بر اساس رنگآمیزی DNA سلول با رنگهای مخصوصDNA است، به طوری که میزان رنگ جذب شده متناسب با محتوای DNA سلول میباشد و چرخه سلولی دارای 4 مرحله متمایز است:G1SG2M همه سلولها در فاز G1 محتوای یکسان DNA دارند و بنابراین یک پیک باریک در نمودار فلورسانس به دست میآید، ضریب تغییرات (CV) عرض پیک را نشانه میدهد. سلولها در فاز G2/M دو برابر محتوای DNA در فاز G1 را دارند، بنابراین پیک ایجاد شده در موقعیت دو برابر پیک G1 قرار دارد. از نظر تئوری، نسبت G2 به G1، 2 به 1 است اما در عمل معمولاً کمتر از آن به دست میآید. فاصله بینG1 و G2 توسط سلولهایی که در فاز Sهستند اشغال شده است.
سلولهای NB4 کشت داده شده (106×1) تحت تاثیر غلظتهای(µg/mL 15 ، µg/mL 20) هارمالین در مدت زمان دو روز انکوبه شدند. سپس سلولها را دو بار با 200 میکرولیتر PBS شستشو داده و بعد از آخرین شستشو، 200 میکرولیتر PBS به توده سلولی اضافه شده و سوسپانسیون سلولی تهیه شد. 50 میکرولیتر از سوسپانسیون برداشته شده و به آن 5/0 میلیلیتر RNase اضافه شد و سپس 50 میکرولیتر تریتون 10% و 5/0 میکرولیتر رنگ PI افزوده شد و به مدت 30 دقیقه در 37 درجه سانتیگراد انکوبه شد. در این مرحله نمونهها جهت ارائه به دستگاه فلوسایتومتری آماده شدند.
استخراج RNA و ساختcDNA :
سلولهای کشت داده شده NB4، تحت تاثیر غلظت µg/mL 15 هارمالین در مدت زمان دو روز انکوبه شد. سلولهای موجود در فلاسک را شمارش و آنها را در میکروتیوب 5/1 میلیلیتری ریخته و در دور g1000 به مدت 6 دقیقه سانتریفیوژ مینماییم. مایع رویی را خارج کرده و به محتوای ته لوله 500 میکرولیتر PBS اضافه مینماییم و مجدداً با همان دور و زمان سانتریفیوژ را تکرار میکنیم. سپس استخراج RNA به وسیله کیت و طبق دستورالعمل (آمریکا، کیاژن) صورت گرفت. بر طبق دستورالعمل کیت استخراج RNA بافر RLT را µL 350 به پلاک سلولی اضافه کرده و مخلوط میکنیم. µL 350 از الکل 70% را به محلول بالا اضافه کرده و آن را مخلوط مینماییم و سپس به ستون اضافه میکنیم و ستون را در دور g 9300 به مدت 15 ثانیه سانتریفیوژ مینماییم. مواد جمع شده میکروتیوب زیر ستون را خارج کرده، یک میکروتیوب دیگر در زیر آن قرار میدهیم و به ستون µL 500 از محلول شستشو RPE همراه الکل را اضافه کرده و آن را در دور g 9300 به مدت 15 ثانیه سانتریفیوژ میکنیم. در نهایت غلظت RNA در دستگاه نانو دراپ خوانده شد که برحسب نانوگرم بر میکرولیتر به دست آورده شد. ساخت cDNA به وسیله آنزیم نسخهبردار معکوس توسط کیت(ایران، 4500YT) و با آغازگر اولیگو dT طبق
دستورالعمل این کیت انجام گرفته شد. از cDNA ساخته شده یک PCR با آغازگر GAPDH (ژن خانهدار) و آغازگر Dnmt1 و P15 قبل از Real Time PCR انجام شد و سپس بر روی ژل 5/1% ، کیفیت cDNA ساخته شده بررسی گردید.
Real-time PCR :
آزمون Real time PCR در دستگاه RotorGene 3000 system (کوربت) و در حجم 20 میکرولیتر انجام شد. پیش از بررسی نسبی بیان ژنهای مورد مطالعه، شرایط تکثیر قطعات توسط روش Real-time PCR برای ژنهای مورد مطالعه P15 و Dnmt1 و ژنهای کنترل داخلی Bact و GAPDH از نظر دمای اتصال آغازگرها و انجام بهینه تکثیر، بهینهسازی و نرمالیزه شد. توالی آغازگرهایReal-time PCR اختصاصی ژن P15 و Dnmt1 و ژنهای کنترل داخلی Bact و GAPDH (ایران، ژن فناوران) در جدول آمده است(جداول 3-1). در انتها برای محاسبه تغییرات بیان ژن از فرمول CTΔΔ2- استفاده شد.
جدول 1: توالی آغازگرهای Real-time PCR اختصاصی ژن P15 و Dnmt1 و ژنهای کنترل داخلی Bact و GAPDH
جدول 2: برنامه زمانی دستگاه Real-time PCR جهت انجام PCR با آغازگر ژن Bact و ژن P15
جدول 3: برنامه زمانی دستگاه Real-time PCR جهت انجام PCR با آغازگر ژن Bact و ژن P15
جدول 4: آغازگرهای متیله و غیر متیله P15 جهت انجام MSP (Methylation specific PCR)
جدول 5: برنامه زمانی ترموسایکلر جهت PCR کردن DNA بیسولفیته و کنترلهای تجاری متیله و غیر متیله کیاژن با آغازگر ژن P15
| نام ژن | نام آغازگر | توالی آغازگر | اندازه (bp) |
| GAPDH | GAPDH(R)F | CCACTCCTCCACCTTTGACGCT | 150 |
| GAPDH(R)R | TTACTCCTTGGAGGCCATGTGGG | ||
| BACT | BACT(R)F | TGGGGGCGGCAGCGATGAG | 245 |
| BACT( R)R | GGTTGGCCTTAGGGTTCAGGGGGG | ||
| P15 (CDKN2B) | CDKN2B(R)F | GATGTGCAAGCGACGACAGA | 80 |
| CDKN2B (R)R | GAGCAAAGGCCAGCATCCT | ||
| Dnmt1 | Dnmt1 F | CCTCCAAAAACCCAGCCAAC | 111 |
| Dnmt1 R | TCCAGGACCCTGGGGTTTC |
جدول 2: برنامه زمانی دستگاه Real-time PCR جهت انجام PCR با آغازگر ژن Bact و ژن P15
| فاز | زمان | دما | چرخه |
| دناتوراسیون اولیه | 5 دقیقه | 95 درجه سانتیگراد | 1 |
| دناتوراسیون | 30 ثانیه | 95 درجه سانتیگراد | 35 |
| آنیلینگ | 30 ثانیه | 57 درجه سانتیگراد | |
| اکستنشن | 30 ثانیه | 72 درجه سانتیگراد |
| فاز | زمان | دما | چرخه |
| دناتوراسیون اولیه | 5 دقیقه | 95 درجه سانتیگراد | 1 |
| دناتوراسیون | 30 ثانیه | 94 درجه سانتیگراد | 35 |
| آنیلینگ | 30 ثانیه | 58 درجه سانتیگراد | |
| اکستنشن | 30 ثانیه | 72 درجه سانتیگراد |
جدول 4: آغازگرهای متیله و غیر متیله P15 جهت انجام MSP (Methylation specific PCR)
| نام ژن | نام آغازگر | توالی آغازگر | اندازه (bp) |
| P15 (CDKN2B) | CDKN2B MF | GCGTTCGTATTTTGCGGTT | 150 |
| CDKN2B MR | CGTACAATAACCGAACGACCGA | ||
| CDKN2B UF | TGTGATGTGTTTGTATTTTGTGGTT | 150 | |
| CDKN2B UR | CCATACAATAACCAAACAACCAA |
جدول 5: برنامه زمانی ترموسایکلر جهت PCR کردن DNA بیسولفیته و کنترلهای تجاری متیله و غیر متیله کیاژن با آغازگر ژن P15
| فاز | زمان | دما (درجه سانتیگراد) |
| دناتوراسیون اولیه | 10 دقیقه | 95 درجه سانتیگراد |
| دناتوراسیون | 45 ثانیه | 95 درجه سانتیگراد |
| آنیلینگ | 45 ثانیه | 56 درجه سانتیگراد |
| اکستنشن | 30 ثانیه | 72 درجه سانتیگراد |
| اکستنشن نهایی | 10 دقیقه | 72 درجه سانتیگراد |
استخراج DNA و بررسی متیلاسیون:
سلولهای کشت داده شده NB4، تحت تاثیر غلظت µg/mL 15 هارمالین در مدت زمان دو روز انکوبه شد و سپس با استفاده از کیت یکتا تجهیز استخراج DNA صورت گرفت. طبق دستورالعمل این کیت 200 میکرولیتر P.B.S (Phosphat Buffer Saline) را به تکمه سلولی حاصل از سانتریفیوژ اضافه شد و محتویات فالکون به تیوب 5/1 میلیلیتر انتقال داده شد. 20 میکرولیتر از پروتئاز به تیوب 5/1 اضافه شد و سپس 200 میکرولیتر از بافر AL به تیوب اضافه شد و به مدت 15 ثانیه ورتکس شد. انکوباسیون تیوب در 56 درجه سانتیگراد به مدت 10 دقیقه صورت گرفت و 200 میکرولیتر از اتانول 100-96 درصد به تیوب اضافه و 15 ثانیه ورتکس شد. محتویات تیوب به ستونهای استخراج اضافه شد و در g 13400برای یک دقیقه سانتریفیوژ شد. ستون به تیوب 2 میلیلیتری استریل انتقال داده شد. 500 میکرولیتر از بافر AW1 به ستون اضافه شد و در g 13400 برای یک دقیقه سانتریفیوژ شد و مجدداً ستون به تیوب 2 میلیلیتری استریل انتقال داده شد. 500 میکرولیتر بافر AW2 به ستون اضافه شد و در g1600 به مدت 3 دقیقه سانتریفیوژ شد و ستون به تیوب 2 میلیلیتری استریل انتقال داده شد. 100 میکرولیتر بافر AE به ستون اضافه شد و در دمای 15 تا 20 درجه سانتیگراد به مدت 15 دقیقه انکوبه شد و سپس در g 9300 برای یک دقیقه سانتریفیوژ شد. مایع خارج شده از ستون به تیوب 5/1 میلیلیتری انتقال داده شد و سپس با استفاده از نانودراپ، غلظت DNA قرائت گردید. DNA استخراج شده با توجه به دستورالعمل کیت اپیتیک بیسولفیت(آمریکا، کیاژن)، بیسولفیته شد. سپس با استفاده از روش MSP و (ng 100) DNA ، بیسولفیت به همراه آغازگرهای متیله و یا غیر متیله(µM 4/0) و Master PCR 2X (µL 5/12) به حجم نهایی µL 25 برای تکثیر ژن مورد نظر رسانده شد(جدول 5) ( 6). هم چنین کنترلهای تجاری متیله و غیر متیله(کیاژن)، که عبارتند از DNA متیله شده و DNA ژنومی، برای بررسی فرآیند MSP استفاده شد و محصول آن ها بر روی ژل 2% الکتروفورز بررسی گردید.
آنالیز آماری:
محاسبه آماری از روش t-test و آزمونTwo-Sample Assuming Unequal Variances در نرمافزار 2016 Excel استفاده شد.
یافتهها
نتایج حاصل از رشد و پرولیفراسیون رده NB4 :
قبل از بررسی تاثیر دارو بر رشد و پرولیفراسیون سلولی، ابتدا رشد و پرولیفراسیون سلولهای NB4 به تنهایی و بدون تاثیر دارو در محیط کشت RPMI (FBS 10%) بررسی شد. رشد این سلولها سریع بوده و در زمان
20 ساعت تعداد آنها دو برابر شد.
تاثیرسایتوتوکسیک هارمالین بر رده سلولی NB4 با استفاده از روش کمی MTT ASSAY:
نتایج حاصل از آزمایش MTT مشخص کرد تاثیر داروی هارمالین بر کاهش پرولیفراسیون سلولی به صورت وابسته به دوز و زمان میباشد. هارمالین پس از 48 ساعت در غلظتهای(µg/mL 10 ، µg/mL 15، µg/mL 20 ، µg/mL 25 و µg/mL 30) موجب کاهش پرولیفراسیون سلولها به ترتیب به صورت 40%، 50% ، 70% و 80% میشود(01/0 p<)(شکل 1).
نتایـج حاصل از تاثیر دارو بر چرخه سلولی سلولهای NB4 :
با بررسی چرخه سلولی توسط رنگ PI مشخص شد که داروی هارمالین در غلظت (µg/mL 15 و µg/mL 20) باعث توقف سلولها در فاز G0G1 میشود(05/0 p<). ولی توقف سلولها در فاز G0G1 در مقایسه با غلظت µg/mL 20 نسبت به غلظت µg/mL 15 داروی هارمالین معنادار نمیباشد. بـه همیـن دلیل بـرای ادامــه کار غلظت
سلولهای کشت داده شده NB4، تحت تاثیر غلظت µg/mL 15 هارمالین در مدت زمان دو روز انکوبه شد و سپس با استفاده از کیت یکتا تجهیز استخراج DNA صورت گرفت. طبق دستورالعمل این کیت 200 میکرولیتر P.B.S (Phosphat Buffer Saline) را به تکمه سلولی حاصل از سانتریفیوژ اضافه شد و محتویات فالکون به تیوب 5/1 میلیلیتر انتقال داده شد. 20 میکرولیتر از پروتئاز به تیوب 5/1 اضافه شد و سپس 200 میکرولیتر از بافر AL به تیوب اضافه شد و به مدت 15 ثانیه ورتکس شد. انکوباسیون تیوب در 56 درجه سانتیگراد به مدت 10 دقیقه صورت گرفت و 200 میکرولیتر از اتانول 100-96 درصد به تیوب اضافه و 15 ثانیه ورتکس شد. محتویات تیوب به ستونهای استخراج اضافه شد و در g 13400برای یک دقیقه سانتریفیوژ شد. ستون به تیوب 2 میلیلیتری استریل انتقال داده شد. 500 میکرولیتر از بافر AW1 به ستون اضافه شد و در g 13400 برای یک دقیقه سانتریفیوژ شد و مجدداً ستون به تیوب 2 میلیلیتری استریل انتقال داده شد. 500 میکرولیتر بافر AW2 به ستون اضافه شد و در g1600 به مدت 3 دقیقه سانتریفیوژ شد و ستون به تیوب 2 میلیلیتری استریل انتقال داده شد. 100 میکرولیتر بافر AE به ستون اضافه شد و در دمای 15 تا 20 درجه سانتیگراد به مدت 15 دقیقه انکوبه شد و سپس در g 9300 برای یک دقیقه سانتریفیوژ شد. مایع خارج شده از ستون به تیوب 5/1 میلیلیتری انتقال داده شد و سپس با استفاده از نانودراپ، غلظت DNA قرائت گردید. DNA استخراج شده با توجه به دستورالعمل کیت اپیتیک بیسولفیت(آمریکا، کیاژن)، بیسولفیته شد. سپس با استفاده از روش MSP و (ng 100) DNA ، بیسولفیت به همراه آغازگرهای متیله و یا غیر متیله(µM 4/0) و Master PCR 2X (µL 5/12) به حجم نهایی µL 25 برای تکثیر ژن مورد نظر رسانده شد(جدول 5) ( 6). هم چنین کنترلهای تجاری متیله و غیر متیله(کیاژن)، که عبارتند از DNA متیله شده و DNA ژنومی، برای بررسی فرآیند MSP استفاده شد و محصول آن ها بر روی ژل 2% الکتروفورز بررسی گردید.
آنالیز آماری:
محاسبه آماری از روش t-test و آزمونTwo-Sample Assuming Unequal Variances در نرمافزار 2016 Excel استفاده شد.
یافتهها
نتایج حاصل از رشد و پرولیفراسیون رده NB4 :
قبل از بررسی تاثیر دارو بر رشد و پرولیفراسیون سلولی، ابتدا رشد و پرولیفراسیون سلولهای NB4 به تنهایی و بدون تاثیر دارو در محیط کشت RPMI (FBS 10%) بررسی شد. رشد این سلولها سریع بوده و در زمان
20 ساعت تعداد آنها دو برابر شد.
تاثیرسایتوتوکسیک هارمالین بر رده سلولی NB4 با استفاده از روش کمی MTT ASSAY:
نتایج حاصل از آزمایش MTT مشخص کرد تاثیر داروی هارمالین بر کاهش پرولیفراسیون سلولی به صورت وابسته به دوز و زمان میباشد. هارمالین پس از 48 ساعت در غلظتهای(µg/mL 10 ، µg/mL 15، µg/mL 20 ، µg/mL 25 و µg/mL 30) موجب کاهش پرولیفراسیون سلولها به ترتیب به صورت 40%، 50% ، 70% و 80% میشود(01/0 p<)(شکل 1).
نتایـج حاصل از تاثیر دارو بر چرخه سلولی سلولهای NB4 :
با بررسی چرخه سلولی توسط رنگ PI مشخص شد که داروی هارمالین در غلظت (µg/mL 15 و µg/mL 20) باعث توقف سلولها در فاز G0G1 میشود(05/0 p<). ولی توقف سلولها در فاز G0G1 در مقایسه با غلظت µg/mL 20 نسبت به غلظت µg/mL 15 داروی هارمالین معنادار نمیباشد. بـه همیـن دلیل بـرای ادامــه کار غلظت

شکل 1 : نمودار جذب نوری سلولهای NB4 حاصل آزمایشMTT تحت تاثیر غلظتهای مختلف داروی هارمالین و 5-آزاسیتیدین (کنترل مثبت، 0 CV= ؛ µM 2) سلولهایNB4 بدون تاثیر دارو(کنترل منفی)(3 n= ، 05/0 p< (*) و (**) (01/0 p<) دادههای آماری در مقایسه دوزهای مختلف دارو در مقایسه با سلولهای بدون تاثیر دارو با استفاده از t-Test نشان داده شده است.)

شکل 2 : نمودارهای مربوط به فلوسیتومتری با استفاده از رنگ PI جهت بررسی چرخه سلولی، RN1 میزان سلولهای متوقف شده در فاز G0G1 را نشان میدهد، RN2 سلولهای متوقف شده در فاز Sو RN3 سلولهای متوقف شده در فاز G2Mرا نشان میدهد. تصویر Aسلولها NB4 را بدون تاثیر دارو، B سلولهای NB4تیمار شده با 5- آزاسیتیدین(کنترل مثبت، µM 2) و C سلول تیمار شده با هارمالین را در دوز µg/mL 15 پس از 48 ساعت نشان میدهد.
پایینتر هارمالین یعنی µg/mL 15 هارمالین را انتخاب کردیم. داروی 5-آزاسیتیدین که به عنوان کنترل مثبت تلقی میشد در غلظت µM2 باعث توقف سلولی در فاز S میشود(شکل 2).
تاثیر هارمالین بر بیان ژن Dnmt1با استفاده از Real-time PCR :
بیان ژن Dnmt1 درسلولهای NB4 تحت تاثیر غلظت µg/mL 15 هارمالین نسبت به سلولهای NB4تیمار نشده نمونه کنترل کاهش نشان داده است(001/0 p<). کاهش بیان ژن Dnmt1 در غلظت µg/mL 15 هارمالین نسبت به کاهش بیان ایجاد شده در اثر تاثیر 5– آزاسیتیدین بر سلولها به صورت معناداری بیشتر میباشد(01/0 p<) (شکل 3).
نتایج تاثیر هارمالین بر بیان ژن P15با استفاده ازReal-time PCR :
نتایج تاثیر هارمالین (µg/mL 15) پس از 48 ساعت موجب افزایش بیان ژن P15 در مقایسه با نمونه کنترل منفی

شکل 3 : نمودار میزان بیان Dnmt1در رده سلولی NB4تحت تاثیر هارمالین و 5-آزاسیتیدین(کنترل مثبت، غلظت µM 2) پس از 48 ساعت(کنترل منفی 0 cv=) 3 n= (***)(001/0 p<). دادههای آماری در مقایسه دوزهای مختلف دارو با سلولهای بدون تاثیر دارو(کنترل منفی یا NB4) با استفاده از t-test نشان داده شده است.
و یا سلولهای غیر تیمار شده NB4 شده است(3 n= ، 01/0 p<). این افزایش بیان ژن P15 در غلظت µg/mL 15 هارمالین نسبت به نمونه کنترل مثبت و یا 5-آزاسیتیدین با غلظت µM2 معنادار میباشد(01/0 p<)(شکل 4).

شکل 4: میزان بیان ژن p15در رده سلولی NB4تحت تاثیر هارمالین و 5-آزاسیتیدین )کنتـرل مثبـت) پـس از 48 ساعـت (کنترل منفی 0 cv=)(3 n= ، 05/0 p< (*) و 01/0 p< (**)) دادههای آماری مقایسه دوزهای مختلف دارو با سلولهای بدون تاثیر دارو(کنترل منفی) با استفاده از t-test را نشان داده است.

شکل 5: بررسی محصول MSP بر روی ژل 2%، ستون 1 ladder ، ستون 2 کنترل غیر متیله (U) با آغازگر غیر متیله P15 ، ستون 3 کنترل متیله با آغازگر متیله P15 (M)، ستون 4NB4 غیر تیمار شده با آغازگر متیله، ستون 5 نمونه غیر تیمار شده NB4 با آغازگر غیر متیله، ستون 6 NB4 تیمار شده با 5- آزاسیتیدین با آغازگر غیر متیله ، ستون 7NB4 تیمار شده با 5-آزاسیتیدین با آغازگر متیله ستون 8 NB4 تیمار شده با هارمالین با آغازگر غیر متیله، ستون 9NB4 تیمار شده با هارمالین با آغازگر متیله.
ارزیابی وضعیت متیلاسیون پروموتور ژن P15:
بحث
آلکالوئیدهای مشتق شده از گیاه اسپند دارای خاصیت آنتیپرولیفراتیو بر روی ردههای سلولی لوسمیک میباشد(8، 7). در این مطالعه هارمالین که یکی از آلکالوئیدهای مشتق شده از گیاه اسپند است به عنوان یک عامل ضد سرطان و هم چنین عامل مهار کننده متیلاسیون DNA مورد مطالعه قرارگرفته است. هارمالین دارای خاصیت سایتوتوکسیک به صورت وابسته به دوز و زمان میباشد که نتایج مشابهی از تاثیر این دارو و سایر داروهای استخراج شده از گیاه اسپند بر روی ردههای مختلف لوسمیک گزارش شده است(9، 7). نتایج این مطالعه نشان داد که سلولهای تیمار شده با هارمالین پس از 48 ساعت در دوز µg/mL 15 باعث توقف سلولهای لوسمی در فاز G0/G1 میشود. در صورتی که داروی 5-آزاسیتیدین به عنوان کنترل مثبت در غلظت 2 میکرومولار باعث توقف سلولی در فاز S میگردد. نتیجه مشابهی توسط بلوم و همکارانش و منتسا و همکارانش در سال 2013 بر روی 5-آزاسیتیدین انجام شد که نشان داد 5-آزاسیتیدین موجب توقف چرخه سلولی در فاز S میشوند(11، 10). بروتنسکیت و همکاران در سال 2016 به بررسی تاثیر پروکانامید پرداختند، که این دارو در غلظت 5 میکرومولار باعث توقف سلولهای لوسمی NB4در فاز G0G1 چرخه سلولی شد. این دارو در غلظت 5 میکرومولار پروکانامید بیان ژن Dnmt1 را کاهش میدهد(2). اودی و همکاران در سال 2017 به بررسی هارمین(یکی دیگر از آلکالوئید گیاهی مشتق شده از گیاه اسپند) و تاثیر دوزهای آنتی پرولیفراتیو آن بر رده سلولی لوسمی NB4 پرداختند، هارمین پس از 72 ساعت وابسته به دوز و زمان بوده که در غلظت µg/mL 2/51 باعث توقف رده سلولی NB4 در فاز چرخه سلول G0G1 شد(12). همسا و همکاران در سال 2011 نتایج مشابهی از تاثیر هارمین در غلظتهای پایین هارمین به دست آوردند(13). هارمالین از غلظت µg/mL 15 موجب کاهش بیان ژن Dnmt1 و هیپومتیلاسیون در پروموتر ژن P15 میشود. با توجه به هیپومتیلاسیون در پروموتر ژن P15، انتظار میرود بیان ژن P15 افزایش پیدا کند و بررسی تاثیر دوزهای آنتیپرولیفراتیو هارمالین بر بیان ژن P15 در رده سلولی NB4 نشان داد که هارمالین در غلظت µg/ml 15موجب افزایش 19 برابری بیان ژن P15 میگردد. اودی و همکاران در بررسی هارمین بر روی سلولهای لوسمی NB4 در غلظت µg/mL 6/25 موجب کاهش بیان 58% mRNA Dnmt1 و در غلظت µg/ml 2/51 موجب کاهش 65% در بیان ژن Dnmt1 میشود. که این کاهش باعث هیپومتیله شدن پروموتر P15 گردیده و این امر باعث افزایش بیان P15 شده است. علاوه بر هارمین و هارمالین، ترکیبات دیگری از گیاهان باعث تاثیر در هیپومتیلاسیون سلولهای لوسمی میشوند. جیان هو و همکارانش در سال 2013 به بررسی متیلاسیون پروموتور ژن P15پرداختند و بررسیهای آنها نشان داد که کورکامین(µg/mL 36) موجب توقف سلولهای NB4 در فار G1 چرخه سلولی و هم چنین کاهش متیلاسیون پروموتور ژن P15 ومتعاقب آن، افزایش 5 برابری در بیان ژن P15 میشود(14). حسن حمزه و همکاران در سال 2014 به بررسی تاثیر کورکومین و دی متوکسی کورکومین پرداختند، که نتایج بررسی نشان داد این دو دارو تاثیر سیتوتوکسیک و هیپومتیلاسیون پروموتور بر رده سلول لوسمی را نداشته، اما از مسیری دیگر بیان پروموتر ژن P15 را افزایش میدهند(15). هم چنین اکوار وهمکارانشان در سال 2012 نشان دادند که EGCG (Epigallocatechin-3-
gallat) در غلظت µg/mL 30 موجب هیپومتیله شدن پروموتور ژنهای P16 ، TSGL و P73 در سلولهای Jurkat و افزایش بیان این ژنها میشود(16). با توجه به گزارشهای ارائه شده هارمالین در مقایسه با سایر داروهای طبیعی مانند کورکامین، پلیفنل چای سبز(EGCG)، ماهانین و هارمین در غلظت پایینتر، اثر بخشی بیشتری بر روی هیپومتیلاسیون پروموتر ژن سلول لوسمی دارد(17).
نتیجهگیری
با توجه به هیپرمتیلاسیون ژنهای سرکوبکننده تومور در بیماران APLو هم چنین اثر بخشی داروی هارمالین در القای اثرات سیتوتوکسیک در سلولهای پرومیلوسیتکNB4 و هم چنین کاهش بیان Dnmt1 و تاثیر آن بر هیپومتیلاسیون ژن P15 که موجب افزایش بیان ژن P15 در این رده سلولی میشود، میتوان چنین پیشنهاد داد که این دارو میتواند به عنوان یک راهکار درمانی مناسب چه به صورت مونوتراپی و چه به صورت داروی مکمل همراه با داروهای متداول APL مورد استفاده قرار گیرد.
تشکر و قدردانی
این مقاله حاصل پایان نامه کارشناسی ارشد دانشگاه آزاد اسلامی واحد علوم و تحقیقات میباشد. بدین وسیله از مرکز تحقیقات سازمان انتقال خون و خانم دکتر آقایی قدردانی مینمایم. هم چنین شایسته است از آقای دکتر امیریزاده و خانم دکتر محمدیپور که در این راه از راهنمایی ایشان بهرمند شدهام بسیار تشکر نمایم. از همکاری بیمارستان شریعتی و خانم دکتر رستمی نیز تشکر مینمایم.
نوع مطالعه: پژوهشي |
موضوع مقاله:
خون و انكولوژي
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |





