جلد 14، شماره 3 - ( پاییز 1396 )
جلد 14 شماره 3 صفحات 216-204 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Ameri Z, Ghiasi S, Farsinejad A, Ehsan M, Aghajani S, Pur Yazdan Panah N, et al . Investigation of telomerase inhibition effect on apoptosis of myeloma cell line U266. bloodj 2017; 14 (3) :204-216
URL: http://bloodjournal.ir/article-1-1121-fa.html
URL: http://bloodjournal.ir/article-1-1121-fa.html
عامری زهرا، غیاثی سعیده، فارسی نژاد علیرضا، احسان محسن، آقاجانی ساناز، پوریزدانپناه نوشین، و همکاران.. اثر مهارکننده تلومراز MST-312 بر آپوپتوز سلولهای میلومی U266. فصلنامه پژوهشی خون. 1396; 14 (3) :204-216
زهرا عامری 
 ، سعیده غیاثی
، سعیده غیاثی 
 ، علیرضا فارسی نژاد
، علیرضا فارسی نژاد 
 ، محسن احسان
، محسن احسان 
 ، ساناز آقاجانی
، ساناز آقاجانی 
 ، نوشین پوریزدانپناه
، نوشین پوریزدانپناه 
 ، شیما کاظم زاده
، شیما کاظم زاده 
 ، احمد فاطمی*
، احمد فاطمی* 


 ، سعیده غیاثی
، سعیده غیاثی 
 ، علیرضا فارسی نژاد
، علیرضا فارسی نژاد 
 ، محسن احسان
، محسن احسان 
 ، ساناز آقاجانی
، ساناز آقاجانی 
 ، نوشین پوریزدانپناه
، نوشین پوریزدانپناه 
 ، شیما کاظم زاده
، شیما کاظم زاده 
 ، احمد فاطمی*
، احمد فاطمی* 

متن کامل [PDF 913 kb]
(2432 دریافت)
| چکیده (HTML) (5607 مشاهده)
مقدمه
میلوم مولتیپل((MM دومین بدخیمی هماتولوژیک شایع و غیر قابل درمان پلاسماسل است که مغز استخوان را در گیر کرده و منجر به تکثیر بیرویه پلاسماسلهای بدخیم(سلولهای میلومی) تولیدکننده آنتیبادیهای مونوکلونال میگردد. این بدخیمی با آنمی، ضایعات استخوانی، هیپرکلسمی، و نارسایی کلیوی همراه میشود.MM یک سرطان منتشر است که تمام اسکلت را درگیر میکند. شایعترین مشکل بیمار درد، نارسایی کلیوی و عفونتهای مکرر است. البته علائم دیگری مثل آنمی، خستگی، تب، و عرق شبانه هم به طور شایعی در این بیماران دیده میشود. بیمار رنگ پریده است و بعضی از استخوانهایش بخصوص جناغ و لگن در لمس دردناک میباشد. شکستگی استخوانهای ضعیف شده به خصوص در مهره، لگن و دنده در تعدادی از این بیماران دیده میشود(1). در پاتوژنز میلوم مولتیپل، IL6 نقش اساسی را ایفا میکند(2).
سرطانها با وجود داشتن ویژگیهای هتروژن بسیار، در یکسری ویژگیها مشترک هستند: توانایی تقسیم نامحدود، مقاومت به سیگنالهای ضد رشد، فرار از آپوپتوز، آنژیوژنز، تهاجم و متاستاز. شاخص کلیدی انواع سلولهای توموری، توانایی تقسیم نامحدود بوده که ارتباط تنگاتنگی با حفظ طول تلومر و افزایش بیان تلومراز دارد(3).
تلومرها کمپلکسهای نوکلئوپروتئینی با طولKb 20-15در انتهای کروموزمها هستند(4). تلومرازها آنزیمهایی هستند که با اضافه کردن تکرارهای TTAGGGبه انتهای کروموزوم، باعث افزایش طول تلومر میشوند و در سلولهای ژرم لاین و سلولهای بنیادی و دیگر سلولهایی که تکثیر زیادی دارند بیان میشوند. هولوآنزیم تلومراز، نوکلئوپروتئینی متشکل از یک قسمت با فعالیت آنزیمی ترانسکریپتازی معکوس به نام hTERT و یک قسمت حاوی RNAبه نام TERC که الگویی برای hTERT است، میباشد. در عدم حضور تلومراز، طول تلومر با هر تقسیم به قدری کاسته میشود که در نهایت رشد سلول متوقف شده و آپوپتوز رخ میدهد. تلومراز در طول تکامل و تمایز عمدتاً از طریق کنترل رونویسی hTERT تنظیم میشود(5).
یافتهها حاکی از آن است که بیان نابهجای hTERT، مرحله بحرانی در شکلگیری بدخیمی است(6، 5). اگر به هر ترتیبی مکانیسمهای کنترلی دچار اختلال شود، بیان نابهجای تلومراز منجر به حفظ طول تلومر، افزایش تکثیر، اختلال در مسیر سیکل سلولی و نهایتاً نامیرایی سلولها میگردد(7). فعالیت نابهجای تلومراز در بیش از 85% از بدخیمیها از جمله MM نشان داده شده است(9، 8). در سلولهای سرطانی، بیـان تلـومراز توسط مسیر NF-κB، β-CATHENIN و MYC افزایش مییابد. هم چنین خود تلومراز نیز باعث افزایش فعالیت مسیر بیان ژنهای یادشده، میشود(10). مسیر NF-κBدر سلولهای MM فعال است و منجر به تولید سیتوکاین التهابی IL6 در این سلولها میشود. این سایتوکاین در پاتوژنز میلوم مولتیپل نقش اساسی را ایفا میکند(2). طی تحقیقات به عمل آمده بر کلانژیوکارسینوم، نشان داده شده است که IL6 به عنوان یک سایتوکاین اتوکرین بر فعالیت تلومراز اثر گذاشته و با فعال کردن دوباره تلومراز، فرآیند Senescenceرا به تاخیر میاندازد، و منجر به بقای سلولهای تومورال میگردد(2). به نظر میرسد این سایتوکاین در سلولهای میلومی نیز اثر مشابه داشته باشد. در واقع مسیر NF-κBبا تولید IL6 باعث افزایش بیان تلومراز در سلولهای میلومی میشود و هم چنین تلومراز نیز باعث افزایش بیان مسیر NF-κB میگردد(11). بنابراین میتوان با مهار فعالیت تلومراز، جلوی تکثیر بیرویه سلولها را در MM گرفت و با افزایش آپوپتوز سلولهای بدخیم، در بهبود علائم، به درمان بیماران کمک کرد.
MST-312 از اپیگالوکاتچین گالات(EGCG)، که کاتچین اصلی چای سبز است، مشتق شده است و به صورت مؤثر تلومراز را مهار مینماید(12). این دارو میتواند در دوزهای بالا(2 میکرومولار)، فعالیت ضد تلومرازی و سوق دادن سلول به سمت مرگ را داشته باشد(13). هدف مطالعه حاضر، بررسی اثر مهارکننده تلومراز MST-312 بر روی آپوپتوز سلولهای میلومی U266 میباشد. با توجه به مطالعههای گذشته، رده سلولی میلومی U266 دارای فعالیت بالای آنزیم تلومراز بوده و چنانچه مهارکننده تلومراز بتواند مرگ سلولهای میلومی را القا کند، میتوان مهار تلومراز را به عنوان یک استراتژی درمانی در MM پیشنهاد نمود(15، 14، 8).
مواد و روشها
مطالعه حاضر از نوع تجربی بود. در این مطالعه از ردهی سلولی توموری U266 که مربوط به بدخیمی میلوم مولتیپل میباشد، برای کشت استفاده شد. همان طور که گفته شد این سلولها آنزیم تلومراز را بیان میکنند(15، 14، 8). این رده سلولی از مرکز ملی ذخائر ژنتیک و زیستی ایران تهیه گردید. سلولهای U266در محیط کشت RPMI 1640 غنی شده با سرم جنین گاوی(FBS) 10%، پنیسیلین- استرپتومایسین(µg/mL 100 streptomycin ، µg/mL 100 penicillin)، در انکوباتور کشت سلول با دمای 37 درجه سانتیگراد و هوای حاوی 5% CO2 و رطوبت 95% کشت داده شدند. محلول ذخیره MST-312 (سیگما ـ آلدریچ، آمریکا) با حل کردن آن در DMSO تهیه شد. این دارو دارای جرم مولی 35/380 گرم بر مول میباشد. برای تهیه محلول ذخیره، 5 میلیگرم دارو در 1 میلیلیتر DMSO حل شد و غلظت 14/13 میلیمولار (13140 میکرومولار) به دست آمد.
غلظت 100 میکرومولار محلول کار در حجم 500 میکرولیتر از محیط کشت(برای هر ران کاری) با استفاده از فرمول زیر تهیه شد.
M1V1=M2V2 100 µM * 500 µL = 13140 µM * V2
V2 = 3.8 µL
با استفاده از فرمول زیر حجمهای مورد نیاز از محلول کار برای ایجاد غلظتهای 2، 4 و 8 میکرومولار در حجمهای مورد نظر به دست آمد.
M1V1=M2V2 2µM * 2mL = 100 µM * V2 V2 = 40 µL
سلولهای طبیعی منونوکلئار خون محیطی(Peripheral Blood Mononuclear Cell (PBMC)) نیز در مطالعههای قبلی ما با داروی MST-312 تیمار شدند و نتایج نشان داد که ایـن دارو هیـچ تأثیر سیتوتوکسیسیتـی بـر روی PBMC
ندارد(جدول 1).
جدول 1: حجمهای مورد نیاز از محلول کار(µM 100) برای تیمار سلولهای میلومی با MST-312
بررسی زندهمانی سلولی با آزمون دفع رنگ تریپان بلو:
برای بررسی تأثیر MST-312 روی زندهمانی سلولی، سلولهای میلومی (U266)با رنگ تریپانبلو مواجه شدند. به طور خلاصه سلولها در پلیت کشت سلولی 12 خانه با تراکم 105×2 سلول در هر خانه کشت داده و با غلظتهای مختلف (2، 4 و 8 میکرو مولار) داروی MST-312 تیمار شدند(16، 12). نمونه سلولی که مورد تیمار با MST-312 قرار نگرفته(غلظت صفر) به عنوان کنترل منفی استفاده شده است. پس از تیمار، پلیت کشت سلولی به انکوباتور کشت سلول با دمای 37 درجه سانتیگراد و هوای مرطوب حاوی 5% CO2 منتقل شد. پس از پایان انکوباسیون در زمانهای 24، 48 و 72 ساعت، سوسپانسیون سلولی با محلول تریپان بلو 4/0% به نسبت 1 به 1 مخلوط شدند(16، 12). پس از 5 دقیقه انکوباسیون در دمای اتاق، مخلوط مورد نظر بر روی لام نئوبار برده و در زیر میکروسکوب بررسی شد. سلولهای زنده(شفاف) و مرده(آبی) شمارش شدند و زندهمانی با استفاده از فرمول زیر محاسبه شد. تعداد تکرار برای هر آزمایش سه بار بود.
100 × (تعداد کل سلولها/تعداد سلولهای زنده) = درصد زندهمانی
بررسی فعالیت متابولیک سلول با روش MTT :
تأثیر غلظتهای مختلف MST-312 روی فعالیت متابولیکی سلولهای میلومی با استفاده از روش رنگسنجی MTT (سیگما ـ آلدریچ، آمریکا) مورد بررسی قرار گرفت. MTT یک روش رنگسنجی سریع، حساس و دقیق و بر پایه احیای نمکهای تترازولیوم زرد رنگ به وسیله فعالیتهای متابولیکی سلول زنده توسط آنزیمهای دهیدروژناز میتوکندریایی میباشد که در نتیجه فرآیند احیا، بلورهای بنفش رنگ فورمازان تشکیل میشود. سپس این بلورها در حلال مناسب حل شده و به وسیله روشهای اسپکتروفتومتری مقدار سنجی میشود. میزان بلور فورمازان ایجاد شده میتواند نشاندهنده درصد سلولهای زنده باشد. به طور خلاصه، 104 سلول به چاهکهای پلیت 96 خانه منتقل شدند و با غلظتهای 2، 4 و 8 میکرو مولار MST-312 به مدت 48 ساعت تیمار شدند. حجم نهایی هر چاهک µL 100 بود. نمونـه سلولـی که مورد تیمار با MST-312 قرار نگرفته(غلظت صفر) به عنوان کنترل منفی استفاده شده است.
بعد از گذشت 48 ساعت، محیط چاهکها خارج شد و سلولها با µL100 از محلول MTT (mg/mL 5 در PBS فیلتر شده) به مدت 4 ساعت در 37 درجه سانتیگراد انکوبه شدند. بلورهای بنفش رنگ فورمازان ایجاد شده، با اضافه کردن µL 100 محلول DMSO به هر چاهک حل شدند. میزان جذب نوری در طول موج 570 نانومتر با استفاده از دستگاه الایزا ریدر اندازهگیری شد. میزان فعالیت متابولیک سلولی با استفاده از فرمول زیر محاسبه گردید. هر آزمایش سه بار تکرار شد.
100 × (جذب نوری کنترل/ جذب نوری تست) = درصد فعالیت متابولیک سلولی
بررسی آپوپتوز:
تأثیر MST-312 روی مرگ سلولهای میلومی با استفاده از آنالیز آپوپتوز مورد بررسی قرار گرفت. به طور خلاصه، سلولهای U266 در پلیت کشت سلول 12 خانه با تراکم 105 × 2 سلول در هر خانه کشت داده و با غلظتهای مورد نظر(2، 4 و 8 میکرومولار) MST-312 به مدت 48 ساعت انکوبه شدند. نمونه سلولی که مورد تیمار با MST-312 قرار نگرفته(غلظت صفر) به عنوان کنترل منفی استفاده شده است. بعد از اتمام انکوباسیون، سلولها دو مرتبه با PBS شسته شدند. سپس سلولها با استفاده از کیت آنکسین V شناساییکننده آپوپتوز(آمریکا، BD بیوساینس) رنگ شدند. پس از خالی کردن PBS رویی، به هر پک سلولی µL 100 بایندینگ بافر(X 1)، µL 5 آنکسین PE-V و µL 5 محلول رنگ 7AAD اضافه شد. پس از یک ورتکس ملایم، نمونهها به مدت 15 دقیقه در تاریکی انکوبه شدند. پس از اتمام انکوباسیون، µL 400 بایندینگ بافر(X 1) به سوسپانسیون سلولی اضافه شد و با دستگاه فلوسایتومتر Becton Dickinson FACS مورد آنالیز قرار گرفت. درصد سلولهای آپوپتوزی با استفاده از نرمافزار Cell Ques تعیین شد. هر آزمایش سه مرتبه تکرار گردید. سلولهایی که آنکسین V مثبت و 7AAD منفی بودند، در فاز اولیه آپوپتوز در نظر گرفته شدند و سلولهایی که هم آنکسین V و هم 7AAD مثبتی داشتند، در مراحل انتهایی آپوپتوز در نظر گرفته شدند.
استخراج RNA و ساخت cDNA :
سلولهای میلومی(U266) برای 48 ساعت با داروی MST-312 تیمار شدند و RNA این سلولها با استفاده از محلول TriPure (رُوش) استخراج شد. به طور خلاصه، سلولها با مقدار تقریبی 106 × 5 به مدت 10 دقیقه با دور rpm 2000 در دمای 4 درجه سانتیگراد سانتریفوژ شدند. مایعرویی دور ریخته شد و به پک سلولی یک میلیلیتر از محلول Tripure اضافه شده و سلولها با استفاده از پیپتاژ و حرکت محکم دست لیز شدند. پس از 5 دقیقه انکوباسیون در دمای اتاق، 200 میکرولیتر از محلول کلروفرم اضافه شده و پس از بستن درب میکروتیوب به مدت 30 ثانیه با حرکت محکم دست تکان داده شد. سپس میکروتیوب به مدت 5 دقیقه در دمای اتاق انکوبه شد. میکروتیوپها به مدت 15 دقیقه در 4 درجه سانتیگراد با دور rpm 1200 سانتریفوژ شدند.
در این مرحله 3 فاز تشکیل شد که فاز رویی که شامل RNA میباشد برداشته شده و هم حجم آن ایزوپروپانول سرد اضافه گردید. پس از 10 دقیقه انکوباسیون در دمای اتاق، میکروتیوبها به مدت 10 دقیقه با دور rpm 12200 در 4 درجه سانتیگراد سانتریفوژ شدند. مایع رویی خالی شد و به رسوب RNA ، اتانول 75% اضافه گردید. میکروتیوبها چندین مرتبه سروته شدند و سپس 10 دقیقه انکوباسیون بر روی یخ اعمال شد. 10 دقیقه سانتریفوژ با دور rpm 7500 در 4 درجه سانتیگراد انجام شد. سپس مایع رویی تخلیه و رسوب خشک شد. رسوب در 20 میکرولیتر آبDEPC حل شد و در پایان 10 دقیقه انکوباسیون بر روی یخ و 10 دقیقه در 60 درجه سانتیگراد همراه با حرکت ملایم انجام گرفت. RNA های استخراج شده در منهای 80 درجه سانتیگراد نگهداری شدند.
واکنش رونویسی معکوس(RT) با استفاده از کیت ساخت DNA مکمل (RevertAid First Strand complementary DNA (cDNA) Synthesis kit from Fermentas ) تهیه شد. به طور خلاصه، برای ساخت cDNA ، 9 میکرولیتر آب تهی از نوکلئاز، 1 میکرولیتر آغازگر رندوم هگزامر، 4 میکرولیتر Reaction Buffer × 5 ، 2 میکرولیتر مخلوط dNTP (mM 10)، 1 میکرولیتر RiboLock RNase Inhibitor U/µL 20) و 1 میکرولیتر ترانس کریپتاز معکوسRevertAid M-MuLV (U/µL 200) به عنوان مستر میکس، و 2 میکرولیتر از RNA توتال (1 میکروگرم در هر واکنش) در میکروتیوب با حجم نهایی 20 میکرولیتر برای هر واکنش مخلوط گردید. هر واکنش 20 میکرولیتری با برنامه دمایی زیر در دستگاه ترموسایکلر قرار گرفت:
5 دقیقه در 25 درجه سانتیگراد انکوبه شد و به دنبال آن 60 دقیقه در دمای 42 درجه سانتیگراد قرار گرفت. واکنش با حرارت دادن آن در 70 درجه سانتیگراد برای 5 دقیقه خاتمه یافت.
واکنش کمی Real-Time PCR :
واکنش Real-time PCR با استفاده از 5/7 میکرولیتر مستر میکس گرین X 2 (آمپلیکون، 5/1 میکرولیتر از
cDNA ساخته شده، 1 میکرولیتر از هر کدام از آغازگرهای جلوبرنده و معکوس(pmol 10)، 4 میکرولیتر آب تهی از نوکلئاز با حجم نهایی 15 میکرولیتر انجام شد(جدول 2). چرخههای دمایی شامل مرحله فعالسازی اولیه با دمای 95 درجه سانتیگراد به مدت 15 دقیقه، و در ادامه با 40 چرخه دمایی که هر چرخه دارای مرحله دناتوراسیون با دمای 95 درجه سانتیگراد به مدت 15 ثانیه و یک مرحله ادغامی اتصال آغازگر و مرحله طویلسازی (annealing/ elongation) در دمای 60 درجه سانتیگراد به مدت 60 ثانیه میباشد. واکنش در دستگاه ABI Biosystem انجام شد و با استفاده از نرمافزار REST ، دادههای حاصل از Real time PCR آنالیز گردید. برای تأیید اختصاصی بودن محصولات تولید شده، آنالیز منحنی ذوب (melting curve) صورت گرفت. در این آنالیز محصولاتی که دارای طول و توالی یکسانی باشند دمای ذوب مشابهی داشته و منحنی ذوب آنها روی هم قرار میگیرد(شکل 1). همان طور که در شکل 1 نشان داده شده است، محصولات مربوط به تکثیر هر یک از ژنها دارای دمای ذوب یکسانی بوده که دال بر اختصاصی بودن محصولات PCR هر ژن میباشد. از ژن GAPDH به عنوان ژنHousekeeping جهت نرمالیزه کردن نتایج بیان ژنها استفاده شد. بیان نسبی ژنهای هدف با استفاده از روش مقایسهای∆∆CT طبق فرمول 2 ∆∆CT محاسبه شد. بیان هر ژن سه بار تکرار گردید. ∆∆CT با فرمول زیر محاسبه میشود.
∆∆CT = (CTtreated – CTcontrol) targeted gene – (CTtreated – CTcontrol) GAPDH
Ct (threshold cycle): تلاقی بین منحنی تکثیر و خط آستانه
Treated : گروه تیمار شده با دارو
Control : گروه تیمار نشده با دارو


نمودار 3: MST-312 بیان ژن BCL2 را کاهش و بیان ژن BAX را افزایش میدهد. بعد از تیمار سلولهای U266 با غلظت 2 میکرومولار MST-312 به مدت 48 ساعت، RNA سلول استخراج گردید و ساخت cDNA انجام شد. نتایج Real-Time PCR با روش سایبرگرین با استفاده از آغازگرهای اختصاصی نشان داده شده است. تمام مقادیر با بیان ژن GAPDH نرمالیزه شدهاند(05/0 p<*).
جدول 3: مقادیر میانگین Ct گروه کنترل و گروه تیمار شده با دوز 2 میکرومولار و میزان تغییر بیان ژنهای BAX ، BCL2
MST-312 بیان ژن Bcl2 را کاهش و بیان ژن BAX را افزایش میدهد:
ژنهای BAX و BCL2 اعضای خانواده Bcl-2 میباشند. ژن BAX و پروتئین حاصل از آن به عنوان فعالکننده آپوپتوز و ژن BCL2 و پروتئین حاصل از آن به عنوان مهارکننده آپوپتوز عمل میکنند. برای بررسی بیان ژن از غلظت 2 میکرومولار که در بررسی فلوسایتومتری با آپوپتوز قابل توجهی همراه بود استفاده شد. در سلولهای میلومی تیمار شده با غلظت 2 میکرومولار MST-312 برای مدت کوتاه(48 ساعت)، بیان ژن BAX افزایش یافته و بیان ژن BCL2 کاهش یافته است که نشان میدهد MST-312 باعث القای آپوپتوز در سلولهای میلومی میشود(نمودار 3 و جدول 3).
بحث
نتایج مطالعه حاضر نشان داد MST-312 باعث کاهش زندهمانی، کاهش فعالیت متابولیک و افزایش آپوپتوز سلولی میشود. این دارو با مهار تلومراز و القای آپوپتوز در سلولهای میلومی میتواند به عنوان کاندیدی در درمان میلوممالتیپل باشد.
در حال حاضر هدف قرار دادن یک مارکر مشخص (درمان هدفمند) در سلولهای بدخیم برای درمان سرطان اهمیت به سزایی دارد. علیرغم این که سلولهای توموری در علائم بالینی تفاوتهای زیادی دارند ولی این سلولها برای بدخیم بودن مجموعهای از شرایط مشابه دارند. در میان این مارکرها داشتن پتانسیل همانندسازی نامحدود، گامی کلیدی برای رشد و تکثیر تومور میباشد(4). در این رابطه میتوان گفت که تلومراز آنزیمی است که تلومرها را گسترش میدهد و از فرآیند پیرشدن همانندسازی جلوگیری میکند(11). تلومراز در اکثر سرطانهای انسانی بیان میشود، بنابراین هدف قرار دادن آن یکی از رویکردهای درمانی مؤثر برای درمان سرطان میباشد(9). در این رابطه انواع مختلفی از داروهای ضد تلومراز در فاز I و II کارآزمایی بالینی هستند(4). در مطالعههای فراوان، نقش و اهمیت تلومراز در مالتیپل میلوما به خوبی بیان شده است. در مطالعه حاضر سلولهای U266 که آنزیم تلومراز را بیان میکنند، با داروی MST-312 تیمار شدند(15، 14، 8). همان طور که در نتایج نشان داده است، تیمار کوتاه مدت سلولهای میلومی با MST-312 باعث کاهش زندهمانی و فعالیت متابولیک سلول شد(شکل 2). به علاوه، تیمار 48 ساعته با غلظت 2 میکرومولار این دارو، باعث افزایش 30 % آپوپتوز در این سلولها گردید(شکل 3). هم چنین مطابق با نتایج مطالعههای دیگر، بررسی سطح بیان ژنهای BAX و BCL2 نیز نشان داد که این دارو با افزایش بیان BAX و کاهش بیان BCL2 باعث القای آپوپتوز در سلولهای میلومی U266 میشود(شکل 4). در مطالعههای قبلی ما، سلولهای طبیعی منونوکلئار خون محیطی (PBMC) نیز با داروی MST-312 تیمار شدند، نتایج نشان داد که این دارو هیچ تأثیر سیتوتوکسیسیتی بر روی سلولهای طبیعی منونوکلئار خون محیطی ندارد. در واقع بعد از تیمار سلولهای PBMC با غلظتهای 5/0، 1 و 2 میکرومولار این دارو، آپوپتوز سلولی با اتصال به آنکسینV / PI مورد بررسی قرار گرفت. میزان آپوپتوز سلولی بعد از تیمار دارو با دوز 2 میکرومولار مساوی با گروه کنترل (سلولهای تیمار نشده با دارو) بود و افزایش در آپوپتوز سلولی مشاهده نشد؛ این نتایج نشان میدهد که این داروی مهارکننده تلومراز به صورت انتخابی بر روی سلولهای توموری که دارای فعالیت بالای تلومراز میباشند اثر میگذارد اما سلولهای طبیعی که فاقد تلومراز هستند متاثر نمیشوند(16).
در مطالعه شیراتسوچی و همکاران ، فعالیت تلومراز در سلولهای میلومی به عنوان فاکتور پیشآگهیدهنده مورد بررسی قرار گرفت؛ آنها یافتند که بقای بیمارانی که بیان بالایی از فعالیت تلومراز دارند، به طور قابل توجه بعد از نمونهگیری کوتاه میباشد. اندازهگیری فعالیت تلومراز در سلولهای میلومی مارکری قابل اعتماد برای نشان دادن ظرفیت پرولیفراسیون و توده توموری در بیماران مبتلا به میلوم مالتیپل است(17). در مطالعه ونگ، مهار شدن تلومراز به وسیله تیوفوسفورامیدات مکمل ناحیه الگوی تلومراز(GRN163) روی رده سلولی میلومی، رده سلولی لنفوم غیر هوچکین، سلولهای گرفته شده از بیماران مبتلا به میلوم مالتیپل(MM) و مدل زنوگرافت تومور بررسی شد. تیمار سلولها با GRN163 سطح تلومراز را در همه سلولها کاهش داد و کوتاه شدن تلومر را تسریع کرد. GRN163 رشد زنوگرافت MM و لنفوم غیر هوچکین ناشی از ردههای سلولی با طول کوتاه تلومر را مهار کرد و آپوپتوز سلولهای توموری را افزایش داد. هم چنین استفاده سیستمیک روزانه داخل پریتوئن GRN163 در مدل زنوگرافت میلوما با طول کوتاه تلومر، باعث کاهش سطح تلومراز و کاهش حجم تومور شد. این اطلاعات نشان داد که تلومراز با حفظ تلومر نقش مهمی در همانندسازی نئوپلاسمهای سلول B دارد و آنها پیشنهاد کردند که مهار تلومراز رویکرد درمانی جدید برای میلوم مالتیپل و لنفوم غیر هوچکین میباشد(18). در مطالعه ویس و همکاران ردههای سلولی میلومی و سلولهای گرفته شده از بیماران مبتلا به مالتیپل میلوما با داروی بورتزومیب(bortezomib) تیمار شدند و تأثیر آن روی فعالیت تلومراز و پرولیفراسیون سلولی بررسی گردید. بورتزومیب باعث تنطیم کاهشی فعالیت تلومراز در سلولهای میلومی هم در زمان رونویسی و هم بعد از رونویسی میشود(14). در مطالعه ژیهوآ سلولهای میلومی U266 با غلظتهای مختلف مهارکننده تلومراز زیدوودین(zidovudine) تیمار شدند و میزان بیان تلومراز با روش TRAP و فعالیت متابولیکی سلولی با روش MTT بررسی شد. بقای سلولهای میلومی U266 تیمار شده با زیدوودین در مقایسه با گروه کنترل به طور قابل توجه کاهش یافت. فعالیت تلومراز بعد از تیمار با غلظت 1000 میکرومـولار بـرای 72 ساعت به میزان 55% کاهش یافت.
زیدوودین به طور مؤثر فعالیت تلومراز را در میلوم مالتیپل مهار میکند و از پرولیفراسیون آنها جلوگیری مینماید(15). در مطالعه سیمیا و همکارانش، MST-312 به عنوان کاندیدی قابل اعتماد برای هدف قرار دادن تلومراز معرفی شده است (12). مطالعههای قبلی نشان دادهاند که استفاده از این دارو سلول را در مرحله G0-G1 نگه میدارد. تیمار کردن بعضی تومورها با این دارو با دو مکانیسم، موجب مهار عملکرد تلومراز میشود. تیمار مداوم تومور با دارو موجب کوتاهی طول تلومر و در نتیجه کاهش تکثیر میگردد، و تیمار کوتاه مدت با دارو باعث اثرات حاد در سلول شده، به طوری که باعث تخریب DNAو مهار حیات آن میشود(11). هم چنین نشان داده شده است که کاهش طول تلومر با استفاده از MST-312 ، 29 جفت باز بوده و بنابراین این ترکیب، باعث ایجاد اختلال در رونویسی قسمت انتهایی کروموزوم میشود. مطالعههای قبلی کاهش 67 درصدی فعالیت تلومراز را با استفاده از MST-312 در رده سلولی U937 نشان دادهاند(12). سیمیا و همکارانش ثابت کردند که استفاده از MST312 باعث القای پیری در 58% کل سلولهای کشت داده شده میشود، که این کار را با بررسی بیان SA-β-Gal activity که مارکری برای بررسی پیری است انجام دادند(19، 12). در مطالعه ونگ و همکاران، سلولهای تومور مغزی Ependymomas مورد بررسی قرار گرفت. در این تومور مغزی، بیان آنزیم تلومراز باعث پیش آگهی ضعیف بیماری میشود. در مطالعه آنها، بیان تلومراز اندازهگیری شد، سلولها نیز با غلظت 1 میکرومولار داروی MST-312به مدت 72 ساعت تیمار شدند و میزان آپوپتوز سلولی بررسی گردید. آنها مشاهده کردند که بیان تلومراز در این سلولها بالا میباشد و بعد از تیمار با MST-312 تعداد سلولها به شدت کاهش مییابد و آپوپتوز سلولی افزایش مییابد(20). در مطالعه چانگ و همکاران سلولهای سرطان روده بزرگ(کولون) HT-29 و سرطان پستان MDA-MB-231 به طور همزمان با داروی فلاوونویید مورین (flavonoid morin) به همراه مهارکننده تلومراز MST-312 تیمار شدند تا تعداد سلولهای بنیادی سرطانی را کاهش دهد. حجم توموری و توانایی هجوم سلولی با تیمار همزمان سلولها با این دو دارو کاهش یافت. مطالعه آنها، استفاده هم زمان از دو داروی فلاوونویید مورین و مهار کننده تلومراز MST-312 را به عنوان درمان هدفمند برای بهبود پیشآگهی سرطان کولون و پستان معرفی کردند(21). در مطالعههای گذشته بیان شده اسـت کـه پـرتوتابـی در سلولهـای بدخیـم باعث افزایش فعالیت تلومراز میشود و هم چنین باعث افزایش مقاومت به پرتو درمانی بعدی میشود. در این رابطه ونگ و همکارانش آنزیم تلومراز را با داروی MST-312 در رده سلولی کارسینوم کبد HepG2 مهار کردند و میزان حساسیت به پرتوتابی این سلولها را قبل و بعد از تیمار با دارو بررسی کردند. آنها یافتند که این دارو به طور مؤثر فعالیت تلومراز را مهار میکند و نشان دادند که غلظت 4 میکرومولار دارو، کشندگی ضعیفی روی سلولهای HepG2 دارد. در مقایسه با پرتوتابی به تنهایی، تیمار سلولها با غلظت 4 میکرومولار و به دنبال آن تیمار با اشعه X ، پتانسیل کلونزایی تومور را به طور قابل توجهی کاهش میدهد.
مطالعه آنها نشان داد که تداخل در عملکرد تلومراز میتواند حساسیت به پرتوتابی را در سلولهای HepG2 نسبت به اشعه X افزایش دهد و هم چنین MST-312 میتواند به عنوان درمان کمکی به همراه پرتوتابی در درمان بدخیمی مؤثر باشد(22). در مطالعه سرانو سلولهای سرطان ریه با داروی MST-312 تیمار شدند. در این مطالعه MST-312 تأثیر آنتی تلومرازی قوی روی سلولهای سرطان ریه دارد و باعث القای p21 و p27 و آپوپتوز در همه جمعیت سلولی میشود(13).
هم چنین در مطالعه گورانگ، تاثیر داروی MST-312 بر روی سلوهای توموری سرطان پستان نیز بررسی شده است. این دارو در زمان کوتاه(48 ساعت) با کاهش فعالیت تلومرازی و القای عملکرد بد تلومر باعث توقف رشد در سلولهای سرطانی پستان شد(23). مطابق با نتایج مطالعههای دیگر، نتایج مطالعه حاضر نشان داد که تیمار کوتاه مدت سلولهای میلومی با MST-312 باعث کاهش زنـدهمانی و فعالیـت متابولیـک سلـول و القـای آپــوپتوز
میشود.
نتیجهگیری
تیمار کوتاه مدت سلولهای سرطانی میلومی با MST-
312 باعـث کاهـش زندهمانـی، کاهش فعالیت متابولیک و
افزایش آپوپتوز سلولی میشود. با توجه نتایج مطالعه حاضر، این دارو با مهار تلومراز و القای آپوپتوز در سلولهای میلومی میتواند به عنوان کاندیدی جهت درمان میلوم مالتیپل پیشنهاد شود.
متن کامل: (3193 مشاهده)
اثر مهارکننده تلومراز MST-312 بر آپوپتوز سلولهای میلومی U266
زهرا عامری1، سعیده غیاثی1، علیرضا فارسینژاد2، محسن احسان1، ساناز آقاجانی1، نوشین پوریزدانپناه1،
شیما کاظمزاده3، احمد فاطمی4
چکیده
سابقه و هدف
تلومراز در اکثر سرطانهای انسانی و میلوم مالتیپل بیان میشود و با توجه به عدم بیان آن در سلولهای سوماتیک، هدف قرار دادن آن یک رویکرد درمانی مؤثر برای درمان سرطان میباشد. هدف از مطالعه ،بررسی تاثیر مهارکننده تلومراز MST-312 ،بر آپوپتوز سلول میلومی U266 بود.
مواد و روشها
در یک مطالعه تجربی، سلولهای U266 با دوزهای مختلف MST-312 در زمانهای مختلف تیمار شدند، سپس زنده مانی سلولی با آزمون دفع رنگ تریپانبلو، فعالیت متابولیک سلول با روش رنگ سنجی MTT و آپوپتوز سلولی به روش فلوسایتومتری با استفاده از اتصال به آنکسین-V /7AAD بررسی گردید. آپوپتوز در سطح ژن نیز با بررسی بیان ژنهای BAX و BCL2 بعد از تیمار سلولها با دارو و استخراج RNA با Real Time PCR انجام گرفت.
یافتهها
بیش از 50% کاهش در زندهمانی سلولهای تیمار شده در غلظت 8 میکرومولار به مدت 48 ساعت مشاهده شد. فعالیت متابولیک سلول بعد از تیمار 48 ساعته با دوز های 2، 4 و 8 میکرومولار MST-312 به ترتیب 25%، 46% و 62% کاهش یافت. تقریباً30 % افزایش آپوپتوز در سلولهای U266 بعد از مواجهه 48 ساعته با 2 میکرومولار MST-312 مشاهده شد. تیمار سلولهای میلومی با غلظت 2 میکرومولارMST-312 به مدت 48 ساعت، باعث افزایش بیان ژن BAX و کاهش بیان ژن BCL2 گردید.
نتیجه گیری
تیمار کوتاه مدت سلولهای سرطانی میلومی با MST-312 باعث کاهش زندهمانی و فعالیت متابولیک و افزایش آپوپتوز سلولی میشود. این دارو با مهار تلومراز و القای آپوپتوز در سلولهای میلومی میتواند به عنوان کاندیدی جهت درمان میلوم مالتیپل پیشنهاد شود.
کلمات کلیدی: آپوپتوز، میلوم مالتیپل، تلومراز
تاریخ دریافت: 30/2/96
تاریخ پذیرش: 20/4/96
1- کارشناس ارشد خونشناسی آزمایشگاهی و بانک خون ـ دانشکده پیراپزشکی دانشگاه علوم پزشکی کرمان ـ کرمان ـ ایران
2- PhD خونشناسی آزمایشگاهی و بانک خون ـ استادیار دانشکده پیراپزشکی دانشگاه علوم پزشکی کرمان ـ کرمان ـ ایران
3- کارشناس ارشد خونشناسی آزمایشگاهی و بانک خون ـ دانشکده پزشکی دانشگاه تربیت مدرس ـ تهران ـ ایران
4- مؤلف مسئول: PhD خونشناسی آزمایشگاهی و بانک خون ـ استادیار دانشکده پیراپزشکی دانشگاه علوم پزشکی کرمان ـ کرمان ـ ایران ـ کد پستی: 7619794435
زهرا عامری1، سعیده غیاثی1، علیرضا فارسینژاد2، محسن احسان1، ساناز آقاجانی1، نوشین پوریزدانپناه1،
شیما کاظمزاده3، احمد فاطمی4
چکیده
سابقه و هدف
تلومراز در اکثر سرطانهای انسانی و میلوم مالتیپل بیان میشود و با توجه به عدم بیان آن در سلولهای سوماتیک، هدف قرار دادن آن یک رویکرد درمانی مؤثر برای درمان سرطان میباشد. هدف از مطالعه ،بررسی تاثیر مهارکننده تلومراز MST-312 ،بر آپوپتوز سلول میلومی U266 بود.
مواد و روشها
در یک مطالعه تجربی، سلولهای U266 با دوزهای مختلف MST-312 در زمانهای مختلف تیمار شدند، سپس زنده مانی سلولی با آزمون دفع رنگ تریپانبلو، فعالیت متابولیک سلول با روش رنگ سنجی MTT و آپوپتوز سلولی به روش فلوسایتومتری با استفاده از اتصال به آنکسین-V /7AAD بررسی گردید. آپوپتوز در سطح ژن نیز با بررسی بیان ژنهای BAX و BCL2 بعد از تیمار سلولها با دارو و استخراج RNA با Real Time PCR انجام گرفت.
یافتهها
بیش از 50% کاهش در زندهمانی سلولهای تیمار شده در غلظت 8 میکرومولار به مدت 48 ساعت مشاهده شد. فعالیت متابولیک سلول بعد از تیمار 48 ساعته با دوز های 2، 4 و 8 میکرومولار MST-312 به ترتیب 25%، 46% و 62% کاهش یافت. تقریباً30 % افزایش آپوپتوز در سلولهای U266 بعد از مواجهه 48 ساعته با 2 میکرومولار MST-312 مشاهده شد. تیمار سلولهای میلومی با غلظت 2 میکرومولارMST-312 به مدت 48 ساعت، باعث افزایش بیان ژن BAX و کاهش بیان ژن BCL2 گردید.
نتیجه گیری
تیمار کوتاه مدت سلولهای سرطانی میلومی با MST-312 باعث کاهش زندهمانی و فعالیت متابولیک و افزایش آپوپتوز سلولی میشود. این دارو با مهار تلومراز و القای آپوپتوز در سلولهای میلومی میتواند به عنوان کاندیدی جهت درمان میلوم مالتیپل پیشنهاد شود.
کلمات کلیدی: آپوپتوز، میلوم مالتیپل، تلومراز
تاریخ دریافت: 30/2/96
تاریخ پذیرش: 20/4/96
1- کارشناس ارشد خونشناسی آزمایشگاهی و بانک خون ـ دانشکده پیراپزشکی دانشگاه علوم پزشکی کرمان ـ کرمان ـ ایران
2- PhD خونشناسی آزمایشگاهی و بانک خون ـ استادیار دانشکده پیراپزشکی دانشگاه علوم پزشکی کرمان ـ کرمان ـ ایران
3- کارشناس ارشد خونشناسی آزمایشگاهی و بانک خون ـ دانشکده پزشکی دانشگاه تربیت مدرس ـ تهران ـ ایران
4- مؤلف مسئول: PhD خونشناسی آزمایشگاهی و بانک خون ـ استادیار دانشکده پیراپزشکی دانشگاه علوم پزشکی کرمان ـ کرمان ـ ایران ـ کد پستی: 7619794435
مقدمه
میلوم مولتیپل((MM دومین بدخیمی هماتولوژیک شایع و غیر قابل درمان پلاسماسل است که مغز استخوان را در گیر کرده و منجر به تکثیر بیرویه پلاسماسلهای بدخیم(سلولهای میلومی) تولیدکننده آنتیبادیهای مونوکلونال میگردد. این بدخیمی با آنمی، ضایعات استخوانی، هیپرکلسمی، و نارسایی کلیوی همراه میشود.MM یک سرطان منتشر است که تمام اسکلت را درگیر میکند. شایعترین مشکل بیمار درد، نارسایی کلیوی و عفونتهای مکرر است. البته علائم دیگری مثل آنمی، خستگی، تب، و عرق شبانه هم به طور شایعی در این بیماران دیده میشود. بیمار رنگ پریده است و بعضی از استخوانهایش بخصوص جناغ و لگن در لمس دردناک میباشد. شکستگی استخوانهای ضعیف شده به خصوص در مهره، لگن و دنده در تعدادی از این بیماران دیده میشود(1). در پاتوژنز میلوم مولتیپل، IL6 نقش اساسی را ایفا میکند(2).
سرطانها با وجود داشتن ویژگیهای هتروژن بسیار، در یکسری ویژگیها مشترک هستند: توانایی تقسیم نامحدود، مقاومت به سیگنالهای ضد رشد، فرار از آپوپتوز، آنژیوژنز، تهاجم و متاستاز. شاخص کلیدی انواع سلولهای توموری، توانایی تقسیم نامحدود بوده که ارتباط تنگاتنگی با حفظ طول تلومر و افزایش بیان تلومراز دارد(3).
تلومرها کمپلکسهای نوکلئوپروتئینی با طولKb 20-15در انتهای کروموزمها هستند(4). تلومرازها آنزیمهایی هستند که با اضافه کردن تکرارهای TTAGGGبه انتهای کروموزوم، باعث افزایش طول تلومر میشوند و در سلولهای ژرم لاین و سلولهای بنیادی و دیگر سلولهایی که تکثیر زیادی دارند بیان میشوند. هولوآنزیم تلومراز، نوکلئوپروتئینی متشکل از یک قسمت با فعالیت آنزیمی ترانسکریپتازی معکوس به نام hTERT و یک قسمت حاوی RNAبه نام TERC که الگویی برای hTERT است، میباشد. در عدم حضور تلومراز، طول تلومر با هر تقسیم به قدری کاسته میشود که در نهایت رشد سلول متوقف شده و آپوپتوز رخ میدهد. تلومراز در طول تکامل و تمایز عمدتاً از طریق کنترل رونویسی hTERT تنظیم میشود(5).
یافتهها حاکی از آن است که بیان نابهجای hTERT، مرحله بحرانی در شکلگیری بدخیمی است(6، 5). اگر به هر ترتیبی مکانیسمهای کنترلی دچار اختلال شود، بیان نابهجای تلومراز منجر به حفظ طول تلومر، افزایش تکثیر، اختلال در مسیر سیکل سلولی و نهایتاً نامیرایی سلولها میگردد(7). فعالیت نابهجای تلومراز در بیش از 85% از بدخیمیها از جمله MM نشان داده شده است(9، 8). در سلولهای سرطانی، بیـان تلـومراز توسط مسیر NF-κB، β-CATHENIN و MYC افزایش مییابد. هم چنین خود تلومراز نیز باعث افزایش فعالیت مسیر بیان ژنهای یادشده، میشود(10). مسیر NF-κBدر سلولهای MM فعال است و منجر به تولید سیتوکاین التهابی IL6 در این سلولها میشود. این سایتوکاین در پاتوژنز میلوم مولتیپل نقش اساسی را ایفا میکند(2). طی تحقیقات به عمل آمده بر کلانژیوکارسینوم، نشان داده شده است که IL6 به عنوان یک سایتوکاین اتوکرین بر فعالیت تلومراز اثر گذاشته و با فعال کردن دوباره تلومراز، فرآیند Senescenceرا به تاخیر میاندازد، و منجر به بقای سلولهای تومورال میگردد(2). به نظر میرسد این سایتوکاین در سلولهای میلومی نیز اثر مشابه داشته باشد. در واقع مسیر NF-κBبا تولید IL6 باعث افزایش بیان تلومراز در سلولهای میلومی میشود و هم چنین تلومراز نیز باعث افزایش بیان مسیر NF-κB میگردد(11). بنابراین میتوان با مهار فعالیت تلومراز، جلوی تکثیر بیرویه سلولها را در MM گرفت و با افزایش آپوپتوز سلولهای بدخیم، در بهبود علائم، به درمان بیماران کمک کرد.
MST-312 از اپیگالوکاتچین گالات(EGCG)، که کاتچین اصلی چای سبز است، مشتق شده است و به صورت مؤثر تلومراز را مهار مینماید(12). این دارو میتواند در دوزهای بالا(2 میکرومولار)، فعالیت ضد تلومرازی و سوق دادن سلول به سمت مرگ را داشته باشد(13). هدف مطالعه حاضر، بررسی اثر مهارکننده تلومراز MST-312 بر روی آپوپتوز سلولهای میلومی U266 میباشد. با توجه به مطالعههای گذشته، رده سلولی میلومی U266 دارای فعالیت بالای آنزیم تلومراز بوده و چنانچه مهارکننده تلومراز بتواند مرگ سلولهای میلومی را القا کند، میتوان مهار تلومراز را به عنوان یک استراتژی درمانی در MM پیشنهاد نمود(15، 14، 8).
مواد و روشها
مطالعه حاضر از نوع تجربی بود. در این مطالعه از ردهی سلولی توموری U266 که مربوط به بدخیمی میلوم مولتیپل میباشد، برای کشت استفاده شد. همان طور که گفته شد این سلولها آنزیم تلومراز را بیان میکنند(15، 14، 8). این رده سلولی از مرکز ملی ذخائر ژنتیک و زیستی ایران تهیه گردید. سلولهای U266در محیط کشت RPMI 1640 غنی شده با سرم جنین گاوی(FBS) 10%، پنیسیلین- استرپتومایسین(µg/mL 100 streptomycin ، µg/mL 100 penicillin)، در انکوباتور کشت سلول با دمای 37 درجه سانتیگراد و هوای حاوی 5% CO2 و رطوبت 95% کشت داده شدند. محلول ذخیره MST-312 (سیگما ـ آلدریچ، آمریکا) با حل کردن آن در DMSO تهیه شد. این دارو دارای جرم مولی 35/380 گرم بر مول میباشد. برای تهیه محلول ذخیره، 5 میلیگرم دارو در 1 میلیلیتر DMSO حل شد و غلظت 14/13 میلیمولار (13140 میکرومولار) به دست آمد.
غلظت 100 میکرومولار محلول کار در حجم 500 میکرولیتر از محیط کشت(برای هر ران کاری) با استفاده از فرمول زیر تهیه شد.
M1V1=M2V2 100 µM * 500 µL = 13140 µM * V2
V2 = 3.8 µL
با استفاده از فرمول زیر حجمهای مورد نیاز از محلول کار برای ایجاد غلظتهای 2، 4 و 8 میکرومولار در حجمهای مورد نظر به دست آمد.
M1V1=M2V2 2µM * 2mL = 100 µM * V2 V2 = 40 µL
سلولهای طبیعی منونوکلئار خون محیطی(Peripheral Blood Mononuclear Cell (PBMC)) نیز در مطالعههای قبلی ما با داروی MST-312 تیمار شدند و نتایج نشان داد که ایـن دارو هیـچ تأثیر سیتوتوکسیسیتـی بـر روی PBMC
ندارد(جدول 1).
جدول 1: حجمهای مورد نیاز از محلول کار(µM 100) برای تیمار سلولهای میلومی با MST-312
| حجم مورد نیاز از محلول کار دارو | حجم کل مورد نظر | غلظت مورد نظر دارو |
| µL 40 | mL 2 | µM 2 |
| µL 80 | mL 2 | µM 4 |
| µL 160 | mL 2 | µM 8 |
بررسی زندهمانی سلولی با آزمون دفع رنگ تریپان بلو:
برای بررسی تأثیر MST-312 روی زندهمانی سلولی، سلولهای میلومی (U266)با رنگ تریپانبلو مواجه شدند. به طور خلاصه سلولها در پلیت کشت سلولی 12 خانه با تراکم 105×2 سلول در هر خانه کشت داده و با غلظتهای مختلف (2، 4 و 8 میکرو مولار) داروی MST-312 تیمار شدند(16، 12). نمونه سلولی که مورد تیمار با MST-312 قرار نگرفته(غلظت صفر) به عنوان کنترل منفی استفاده شده است. پس از تیمار، پلیت کشت سلولی به انکوباتور کشت سلول با دمای 37 درجه سانتیگراد و هوای مرطوب حاوی 5% CO2 منتقل شد. پس از پایان انکوباسیون در زمانهای 24، 48 و 72 ساعت، سوسپانسیون سلولی با محلول تریپان بلو 4/0% به نسبت 1 به 1 مخلوط شدند(16، 12). پس از 5 دقیقه انکوباسیون در دمای اتاق، مخلوط مورد نظر بر روی لام نئوبار برده و در زیر میکروسکوب بررسی شد. سلولهای زنده(شفاف) و مرده(آبی) شمارش شدند و زندهمانی با استفاده از فرمول زیر محاسبه شد. تعداد تکرار برای هر آزمایش سه بار بود.
100 × (تعداد کل سلولها/تعداد سلولهای زنده) = درصد زندهمانی
بررسی فعالیت متابولیک سلول با روش MTT :
تأثیر غلظتهای مختلف MST-312 روی فعالیت متابولیکی سلولهای میلومی با استفاده از روش رنگسنجی MTT (سیگما ـ آلدریچ، آمریکا) مورد بررسی قرار گرفت. MTT یک روش رنگسنجی سریع، حساس و دقیق و بر پایه احیای نمکهای تترازولیوم زرد رنگ به وسیله فعالیتهای متابولیکی سلول زنده توسط آنزیمهای دهیدروژناز میتوکندریایی میباشد که در نتیجه فرآیند احیا، بلورهای بنفش رنگ فورمازان تشکیل میشود. سپس این بلورها در حلال مناسب حل شده و به وسیله روشهای اسپکتروفتومتری مقدار سنجی میشود. میزان بلور فورمازان ایجاد شده میتواند نشاندهنده درصد سلولهای زنده باشد. به طور خلاصه، 104 سلول به چاهکهای پلیت 96 خانه منتقل شدند و با غلظتهای 2، 4 و 8 میکرو مولار MST-312 به مدت 48 ساعت تیمار شدند. حجم نهایی هر چاهک µL 100 بود. نمونـه سلولـی که مورد تیمار با MST-312 قرار نگرفته(غلظت صفر) به عنوان کنترل منفی استفاده شده است.
بعد از گذشت 48 ساعت، محیط چاهکها خارج شد و سلولها با µL100 از محلول MTT (mg/mL 5 در PBS فیلتر شده) به مدت 4 ساعت در 37 درجه سانتیگراد انکوبه شدند. بلورهای بنفش رنگ فورمازان ایجاد شده، با اضافه کردن µL 100 محلول DMSO به هر چاهک حل شدند. میزان جذب نوری در طول موج 570 نانومتر با استفاده از دستگاه الایزا ریدر اندازهگیری شد. میزان فعالیت متابولیک سلولی با استفاده از فرمول زیر محاسبه گردید. هر آزمایش سه بار تکرار شد.
100 × (جذب نوری کنترل/ جذب نوری تست) = درصد فعالیت متابولیک سلولی
بررسی آپوپتوز:
تأثیر MST-312 روی مرگ سلولهای میلومی با استفاده از آنالیز آپوپتوز مورد بررسی قرار گرفت. به طور خلاصه، سلولهای U266 در پلیت کشت سلول 12 خانه با تراکم 105 × 2 سلول در هر خانه کشت داده و با غلظتهای مورد نظر(2، 4 و 8 میکرومولار) MST-312 به مدت 48 ساعت انکوبه شدند. نمونه سلولی که مورد تیمار با MST-312 قرار نگرفته(غلظت صفر) به عنوان کنترل منفی استفاده شده است. بعد از اتمام انکوباسیون، سلولها دو مرتبه با PBS شسته شدند. سپس سلولها با استفاده از کیت آنکسین V شناساییکننده آپوپتوز(آمریکا، BD بیوساینس) رنگ شدند. پس از خالی کردن PBS رویی، به هر پک سلولی µL 100 بایندینگ بافر(X 1)، µL 5 آنکسین PE-V و µL 5 محلول رنگ 7AAD اضافه شد. پس از یک ورتکس ملایم، نمونهها به مدت 15 دقیقه در تاریکی انکوبه شدند. پس از اتمام انکوباسیون، µL 400 بایندینگ بافر(X 1) به سوسپانسیون سلولی اضافه شد و با دستگاه فلوسایتومتر Becton Dickinson FACS مورد آنالیز قرار گرفت. درصد سلولهای آپوپتوزی با استفاده از نرمافزار Cell Ques تعیین شد. هر آزمایش سه مرتبه تکرار گردید. سلولهایی که آنکسین V مثبت و 7AAD منفی بودند، در فاز اولیه آپوپتوز در نظر گرفته شدند و سلولهایی که هم آنکسین V و هم 7AAD مثبتی داشتند، در مراحل انتهایی آپوپتوز در نظر گرفته شدند.
استخراج RNA و ساخت cDNA :
سلولهای میلومی(U266) برای 48 ساعت با داروی MST-312 تیمار شدند و RNA این سلولها با استفاده از محلول TriPure (رُوش) استخراج شد. به طور خلاصه، سلولها با مقدار تقریبی 106 × 5 به مدت 10 دقیقه با دور rpm 2000 در دمای 4 درجه سانتیگراد سانتریفوژ شدند. مایعرویی دور ریخته شد و به پک سلولی یک میلیلیتر از محلول Tripure اضافه شده و سلولها با استفاده از پیپتاژ و حرکت محکم دست لیز شدند. پس از 5 دقیقه انکوباسیون در دمای اتاق، 200 میکرولیتر از محلول کلروفرم اضافه شده و پس از بستن درب میکروتیوب به مدت 30 ثانیه با حرکت محکم دست تکان داده شد. سپس میکروتیوب به مدت 5 دقیقه در دمای اتاق انکوبه شد. میکروتیوپها به مدت 15 دقیقه در 4 درجه سانتیگراد با دور rpm 1200 سانتریفوژ شدند.
در این مرحله 3 فاز تشکیل شد که فاز رویی که شامل RNA میباشد برداشته شده و هم حجم آن ایزوپروپانول سرد اضافه گردید. پس از 10 دقیقه انکوباسیون در دمای اتاق، میکروتیوبها به مدت 10 دقیقه با دور rpm 12200 در 4 درجه سانتیگراد سانتریفوژ شدند. مایع رویی خالی شد و به رسوب RNA ، اتانول 75% اضافه گردید. میکروتیوبها چندین مرتبه سروته شدند و سپس 10 دقیقه انکوباسیون بر روی یخ اعمال شد. 10 دقیقه سانتریفوژ با دور rpm 7500 در 4 درجه سانتیگراد انجام شد. سپس مایع رویی تخلیه و رسوب خشک شد. رسوب در 20 میکرولیتر آبDEPC حل شد و در پایان 10 دقیقه انکوباسیون بر روی یخ و 10 دقیقه در 60 درجه سانتیگراد همراه با حرکت ملایم انجام گرفت. RNA های استخراج شده در منهای 80 درجه سانتیگراد نگهداری شدند.
واکنش رونویسی معکوس(RT) با استفاده از کیت ساخت DNA مکمل (RevertAid First Strand complementary DNA (cDNA) Synthesis kit from Fermentas ) تهیه شد. به طور خلاصه، برای ساخت cDNA ، 9 میکرولیتر آب تهی از نوکلئاز، 1 میکرولیتر آغازگر رندوم هگزامر، 4 میکرولیتر Reaction Buffer × 5 ، 2 میکرولیتر مخلوط dNTP (mM 10)، 1 میکرولیتر RiboLock RNase Inhibitor U/µL 20) و 1 میکرولیتر ترانس کریپتاز معکوسRevertAid M-MuLV (U/µL 200) به عنوان مستر میکس، و 2 میکرولیتر از RNA توتال (1 میکروگرم در هر واکنش) در میکروتیوب با حجم نهایی 20 میکرولیتر برای هر واکنش مخلوط گردید. هر واکنش 20 میکرولیتری با برنامه دمایی زیر در دستگاه ترموسایکلر قرار گرفت:
5 دقیقه در 25 درجه سانتیگراد انکوبه شد و به دنبال آن 60 دقیقه در دمای 42 درجه سانتیگراد قرار گرفت. واکنش با حرارت دادن آن در 70 درجه سانتیگراد برای 5 دقیقه خاتمه یافت.
واکنش کمی Real-Time PCR :
واکنش Real-time PCR با استفاده از 5/7 میکرولیتر مستر میکس گرین X 2 (آمپلیکون، 5/1 میکرولیتر از
cDNA ساخته شده، 1 میکرولیتر از هر کدام از آغازگرهای جلوبرنده و معکوس(pmol 10)، 4 میکرولیتر آب تهی از نوکلئاز با حجم نهایی 15 میکرولیتر انجام شد(جدول 2). چرخههای دمایی شامل مرحله فعالسازی اولیه با دمای 95 درجه سانتیگراد به مدت 15 دقیقه، و در ادامه با 40 چرخه دمایی که هر چرخه دارای مرحله دناتوراسیون با دمای 95 درجه سانتیگراد به مدت 15 ثانیه و یک مرحله ادغامی اتصال آغازگر و مرحله طویلسازی (annealing/ elongation) در دمای 60 درجه سانتیگراد به مدت 60 ثانیه میباشد. واکنش در دستگاه ABI Biosystem انجام شد و با استفاده از نرمافزار REST ، دادههای حاصل از Real time PCR آنالیز گردید. برای تأیید اختصاصی بودن محصولات تولید شده، آنالیز منحنی ذوب (melting curve) صورت گرفت. در این آنالیز محصولاتی که دارای طول و توالی یکسانی باشند دمای ذوب مشابهی داشته و منحنی ذوب آنها روی هم قرار میگیرد(شکل 1). همان طور که در شکل 1 نشان داده شده است، محصولات مربوط به تکثیر هر یک از ژنها دارای دمای ذوب یکسانی بوده که دال بر اختصاصی بودن محصولات PCR هر ژن میباشد. از ژن GAPDH به عنوان ژنHousekeeping جهت نرمالیزه کردن نتایج بیان ژنها استفاده شد. بیان نسبی ژنهای هدف با استفاده از روش مقایسهای∆∆CT طبق فرمول 2 ∆∆CT محاسبه شد. بیان هر ژن سه بار تکرار گردید. ∆∆CT با فرمول زیر محاسبه میشود.
∆∆CT = (CTtreated – CTcontrol) targeted gene – (CTtreated – CTcontrol) GAPDH
Ct (threshold cycle): تلاقی بین منحنی تکثیر و خط آستانه
Treated : گروه تیمار شده با دارو
Control : گروه تیمار نشده با دارو
جدول 2: توالی آغازگرهای معکوس و جلوبرنده ژنهای BAX ، BCL2 و GAPDH
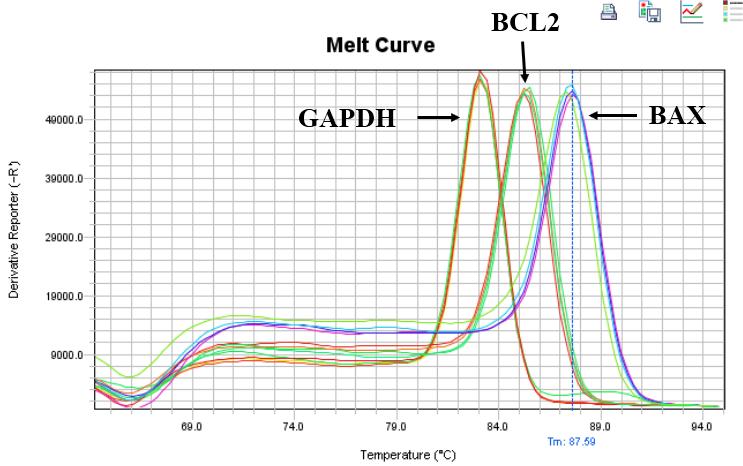
شکل 1: منحنی دمای ذوب ژنهای BAX ، BCL2 و GAPDH
| نام ژن | توالی آغازگر جلوبرنده | توالی آغازگر معکوس |
| GAPDH | GAAGGTGAAGGTCGGAGTC | GAAGATGGTGATGGGATTTC |
| BCL2 | ATCGCCCTGTGGATGACTGAG | CAGCCAGGAGAAATCAAACAGAGG |
| BAX | AGGATCGAGCAGGGCGAATG | TCAGCTTCTTGGTGGACGCA |
|
|

شکل 1: منحنی دمای ذوب ژنهای BAX ، BCL2 و GAPDH
آنالیز آماری:
دادههای مربوطه وارد 22SPSS شد و مورد تجزیه و تحلیل آماری به روشTwo-independent sample t-test قرار گرفت.
یافتهها
MST-312 زندهمانی سلولی و فعالیت متابولیک سلولهای میلوم مالتیپل را کاهش میدهد:
تأثیر غلظتهای مختلف MST-312 روی زندهمانی سلولهای میلومی با استفاده از آزمون دفع تریپانبلو بررسی گردید. همان طور که در نمودار A1 مشاهده میشود، زندهمانی سلولهای U266 مواجه شده با MST-312 به صورت وابسته به دوز و زمان به طور قابل توجهی کاهش یافته است. بیش از 50% کاهش در زندهمانی سلولهای تیمار شده در غلظت 8 میکرومولار به مدت 48 ساعت مشاهده شد. با در نظر گرفتن کاهش شدید زندهمانی سلولی به دنبال مواجه طولانی مدت با MST-312 ، مدت زمان کوتاه 48 ساعت برای آزمایشهای بعدی استفاده شد. به منظور بررسی اثر MST-312 روی فعالیت متابولیک سلول، سلولهای میلومی با روش رنگسنجی MTT مواجه شدند. همان طور که در نمودار B1 مشاهده میشود، فعالیت متابولیک سلولی که مربوط به تعداد سلولهای زنده میباشد، به طور مشخص در سلولهای میلومی تیمار شده با MST-312 کاهش یافته است. تاثیر کشندگی سلولی MST-312 وابسته به دوز میباشد که تقریباً فعالیت متابولیک در سلولهای U266 بعد از تیمار 48 ساعته با دوزهای 2، 4 و 8 میکرومولار MST-312 به ترتیب 25%، 46% و 62% کاهش یافت. در نظر گرفتن همه این یافتهها، نشان میدهد که MST-312 در زمان کوتاه میتواند کشندگی سلولی را روی سلولهای میلومی اعمال کند.
MST-312 آپوپتوز سلولهای میلومی را افزایش میدهد:
به منظور تعیین تاثیر MST-312 روی آپوپتوز سلولی، سلولهای میلومی برای اتصال آنکسین-V و آنکسین-V به همراه 7AAD توسط کیت PE آنکسین-V شناساییکننده آپوپتوز آنالیز شدند. سلولهای آنکسین منفی/ 7-AAD منفی به عنوان سلولهای زنده در نظر گرفته میشوند؛ سلولهای آنکسین مثبت/ 7-AAD منفی در مرحله اولیه آپوپتوز قرار دارند؛ سلولهای آنکسین مثبت/ 7-AAD مثبت در مراحل انتهایی آپوپتوز قرار دارند و سلولهای آنکسین منفی/ 7-AAD مثبت نکروتیک تلقی میشوند(نمودار 2). انکوباسیون کوتاه مدت سلولهای میلومی با MST-312 که به طور مشخص سلولهای آنکسین-V مثبت/ 7AAD منفی و آنکسین-V مثبت/ 7AAD مثبت را افزایش میدهد؛ نشاندهنده تأثیر آپوپتوتیک MST-312 روی سلولهای میلومی میباشد. همان طور که در نمودار 2 مشاهده میشود، تأثیر آپوپتوزی وابسته به دوز بود و تقریباً30 % (درصد توتال آنکسین-V مثبت/ 7AAD منفی و آنکسین-V مثبت/7AAD مثبت) افزایش آپوپتوز در سلولهای U266 بعد از مواجهه کوتاه مدت(48 ساعت) با غلظت 2 میکرومولار MST-312 دیده شد. این غلظت 2 میکرومولار که با آپوپتوز قابل توجهی همراه بود به عنوان غلظت مورد استفاده در بررسی بیان ژن انتخاب شد.
دادههای مربوطه وارد 22SPSS شد و مورد تجزیه و تحلیل آماری به روشTwo-independent sample t-test قرار گرفت.
یافتهها
MST-312 زندهمانی سلولی و فعالیت متابولیک سلولهای میلوم مالتیپل را کاهش میدهد:
تأثیر غلظتهای مختلف MST-312 روی زندهمانی سلولهای میلومی با استفاده از آزمون دفع تریپانبلو بررسی گردید. همان طور که در نمودار A1 مشاهده میشود، زندهمانی سلولهای U266 مواجه شده با MST-312 به صورت وابسته به دوز و زمان به طور قابل توجهی کاهش یافته است. بیش از 50% کاهش در زندهمانی سلولهای تیمار شده در غلظت 8 میکرومولار به مدت 48 ساعت مشاهده شد. با در نظر گرفتن کاهش شدید زندهمانی سلولی به دنبال مواجه طولانی مدت با MST-312 ، مدت زمان کوتاه 48 ساعت برای آزمایشهای بعدی استفاده شد. به منظور بررسی اثر MST-312 روی فعالیت متابولیک سلول، سلولهای میلومی با روش رنگسنجی MTT مواجه شدند. همان طور که در نمودار B1 مشاهده میشود، فعالیت متابولیک سلولی که مربوط به تعداد سلولهای زنده میباشد، به طور مشخص در سلولهای میلومی تیمار شده با MST-312 کاهش یافته است. تاثیر کشندگی سلولی MST-312 وابسته به دوز میباشد که تقریباً فعالیت متابولیک در سلولهای U266 بعد از تیمار 48 ساعته با دوزهای 2، 4 و 8 میکرومولار MST-312 به ترتیب 25%، 46% و 62% کاهش یافت. در نظر گرفتن همه این یافتهها، نشان میدهد که MST-312 در زمان کوتاه میتواند کشندگی سلولی را روی سلولهای میلومی اعمال کند.
MST-312 آپوپتوز سلولهای میلومی را افزایش میدهد:
به منظور تعیین تاثیر MST-312 روی آپوپتوز سلولی، سلولهای میلومی برای اتصال آنکسین-V و آنکسین-V به همراه 7AAD توسط کیت PE آنکسین-V شناساییکننده آپوپتوز آنالیز شدند. سلولهای آنکسین منفی/ 7-AAD منفی به عنوان سلولهای زنده در نظر گرفته میشوند؛ سلولهای آنکسین مثبت/ 7-AAD منفی در مرحله اولیه آپوپتوز قرار دارند؛ سلولهای آنکسین مثبت/ 7-AAD مثبت در مراحل انتهایی آپوپتوز قرار دارند و سلولهای آنکسین منفی/ 7-AAD مثبت نکروتیک تلقی میشوند(نمودار 2). انکوباسیون کوتاه مدت سلولهای میلومی با MST-312 که به طور مشخص سلولهای آنکسین-V مثبت/ 7AAD منفی و آنکسین-V مثبت/ 7AAD مثبت را افزایش میدهد؛ نشاندهنده تأثیر آپوپتوتیک MST-312 روی سلولهای میلومی میباشد. همان طور که در نمودار 2 مشاهده میشود، تأثیر آپوپتوزی وابسته به دوز بود و تقریباً30 % (درصد توتال آنکسین-V مثبت/ 7AAD منفی و آنکسین-V مثبت/7AAD مثبت) افزایش آپوپتوز در سلولهای U266 بعد از مواجهه کوتاه مدت(48 ساعت) با غلظت 2 میکرومولار MST-312 دیده شد. این غلظت 2 میکرومولار که با آپوپتوز قابل توجهی همراه بود به عنوان غلظت مورد استفاده در بررسی بیان ژن انتخاب شد.

نمودار 1: MST-312 باعث کاهش زندهمانی سلولی و فعالیت متابولیکی سلولهای میلومی میشود. در نمودار A سلولهای میلومی U266 با غلظتهای مختلف MST-312 مواجه شدند و زندهمانی سلولی با استفاده ار آزمون دفع رنگ تریپانبلو بعد از زمانهای مختلف مواجهه بررسی شد. زندهمانی سلولهای U266 بعد از مواجهه کوتاه مدت با MST-312 به طور قابل توجه به صورت وابسته به دوز کاهش یافت. در نمودار B سلولهای میلومی با غلظتهای مختلف MST-312 تیمار شدند و فعالیت متابولیک با آزمون MTT بعد از مواجهه 48 ساعته بررسی شد. فعالیت متابولیک سلولهای میلومی مواجهه شده با MST-312 به طور قابل توجه به صورت وابسته به دوز کاهش یافت(001/0 p< ***و 01/0 p<**).
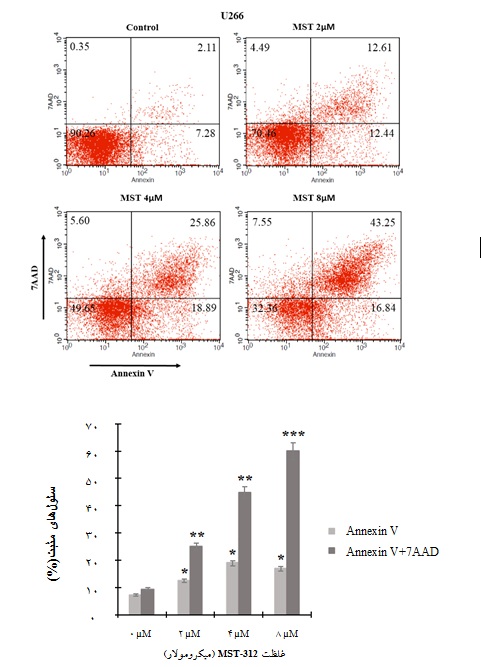

نمودار 2: تاثیر MST-312 روی آپوپتوز سلولهای U266. سلولهای U266 با غلظتهای مختلف MST-312 به مدت 48 ساعت تیمار شدند. سپس اتصال این سلولها به آنکسین-V /7AAD مورد بررسی قرار گرفت. سلولهای Annexin منفی/ 7-AAD منفی به عنوان سلولهای زنده در نظر گرفته میشوند؛ سلولهای Annexin مثبت/ 7-AAD منفی در مرحله اولیه آپوپتوز قرار دارند؛ سلولهای Annexin مثبت/ 7-AAD مثبت در مراحل انتهایی آپوپتوز قرار دارند و سلولهای Annexin منفی/ 7-AAD مثبت نکروتیک تلقی میشوند. یک آزمایش از سه مرتبه تکرار نشان داده شده است(001/0 p< *** و 01/0 p< ** و 05/0 p< *).

نمودار 3: MST-312 بیان ژن BCL2 را کاهش و بیان ژن BAX را افزایش میدهد. بعد از تیمار سلولهای U266 با غلظت 2 میکرومولار MST-312 به مدت 48 ساعت، RNA سلول استخراج گردید و ساخت cDNA انجام شد. نتایج Real-Time PCR با روش سایبرگرین با استفاده از آغازگرهای اختصاصی نشان داده شده است. تمام مقادیر با بیان ژن GAPDH نرمالیزه شدهاند(05/0 p<*).
جدول 3: مقادیر میانگین Ct گروه کنترل و گروه تیمار شده با دوز 2 میکرومولار و میزان تغییر بیان ژنهای BAX ، BCL2
| نام ژن | میانگین CT (سه بار تکرار) گروه تیمار نشده (کنترل) |
میانگین CT (سه بار تکرار) گروه تیمار شده (دوز 2 میکرومولار) |
2-∆∆CT (تغییر بیان ژن) |
| GAPDH | 03/15 | 01/15 | 1 |
| BCL2 | 46/25 | 09/26 | 65/0 |
| BAX | 93/21 | 14/21 | 7/1 |
MST-312 بیان ژن Bcl2 را کاهش و بیان ژن BAX را افزایش میدهد:
ژنهای BAX و BCL2 اعضای خانواده Bcl-2 میباشند. ژن BAX و پروتئین حاصل از آن به عنوان فعالکننده آپوپتوز و ژن BCL2 و پروتئین حاصل از آن به عنوان مهارکننده آپوپتوز عمل میکنند. برای بررسی بیان ژن از غلظت 2 میکرومولار که در بررسی فلوسایتومتری با آپوپتوز قابل توجهی همراه بود استفاده شد. در سلولهای میلومی تیمار شده با غلظت 2 میکرومولار MST-312 برای مدت کوتاه(48 ساعت)، بیان ژن BAX افزایش یافته و بیان ژن BCL2 کاهش یافته است که نشان میدهد MST-312 باعث القای آپوپتوز در سلولهای میلومی میشود(نمودار 3 و جدول 3).
بحث
نتایج مطالعه حاضر نشان داد MST-312 باعث کاهش زندهمانی، کاهش فعالیت متابولیک و افزایش آپوپتوز سلولی میشود. این دارو با مهار تلومراز و القای آپوپتوز در سلولهای میلومی میتواند به عنوان کاندیدی در درمان میلوممالتیپل باشد.
در حال حاضر هدف قرار دادن یک مارکر مشخص (درمان هدفمند) در سلولهای بدخیم برای درمان سرطان اهمیت به سزایی دارد. علیرغم این که سلولهای توموری در علائم بالینی تفاوتهای زیادی دارند ولی این سلولها برای بدخیم بودن مجموعهای از شرایط مشابه دارند. در میان این مارکرها داشتن پتانسیل همانندسازی نامحدود، گامی کلیدی برای رشد و تکثیر تومور میباشد(4). در این رابطه میتوان گفت که تلومراز آنزیمی است که تلومرها را گسترش میدهد و از فرآیند پیرشدن همانندسازی جلوگیری میکند(11). تلومراز در اکثر سرطانهای انسانی بیان میشود، بنابراین هدف قرار دادن آن یکی از رویکردهای درمانی مؤثر برای درمان سرطان میباشد(9). در این رابطه انواع مختلفی از داروهای ضد تلومراز در فاز I و II کارآزمایی بالینی هستند(4). در مطالعههای فراوان، نقش و اهمیت تلومراز در مالتیپل میلوما به خوبی بیان شده است. در مطالعه حاضر سلولهای U266 که آنزیم تلومراز را بیان میکنند، با داروی MST-312 تیمار شدند(15، 14، 8). همان طور که در نتایج نشان داده است، تیمار کوتاه مدت سلولهای میلومی با MST-312 باعث کاهش زندهمانی و فعالیت متابولیک سلول شد(شکل 2). به علاوه، تیمار 48 ساعته با غلظت 2 میکرومولار این دارو، باعث افزایش 30 % آپوپتوز در این سلولها گردید(شکل 3). هم چنین مطابق با نتایج مطالعههای دیگر، بررسی سطح بیان ژنهای BAX و BCL2 نیز نشان داد که این دارو با افزایش بیان BAX و کاهش بیان BCL2 باعث القای آپوپتوز در سلولهای میلومی U266 میشود(شکل 4). در مطالعههای قبلی ما، سلولهای طبیعی منونوکلئار خون محیطی (PBMC) نیز با داروی MST-312 تیمار شدند، نتایج نشان داد که این دارو هیچ تأثیر سیتوتوکسیسیتی بر روی سلولهای طبیعی منونوکلئار خون محیطی ندارد. در واقع بعد از تیمار سلولهای PBMC با غلظتهای 5/0، 1 و 2 میکرومولار این دارو، آپوپتوز سلولی با اتصال به آنکسینV / PI مورد بررسی قرار گرفت. میزان آپوپتوز سلولی بعد از تیمار دارو با دوز 2 میکرومولار مساوی با گروه کنترل (سلولهای تیمار نشده با دارو) بود و افزایش در آپوپتوز سلولی مشاهده نشد؛ این نتایج نشان میدهد که این داروی مهارکننده تلومراز به صورت انتخابی بر روی سلولهای توموری که دارای فعالیت بالای تلومراز میباشند اثر میگذارد اما سلولهای طبیعی که فاقد تلومراز هستند متاثر نمیشوند(16).
در مطالعه شیراتسوچی و همکاران ، فعالیت تلومراز در سلولهای میلومی به عنوان فاکتور پیشآگهیدهنده مورد بررسی قرار گرفت؛ آنها یافتند که بقای بیمارانی که بیان بالایی از فعالیت تلومراز دارند، به طور قابل توجه بعد از نمونهگیری کوتاه میباشد. اندازهگیری فعالیت تلومراز در سلولهای میلومی مارکری قابل اعتماد برای نشان دادن ظرفیت پرولیفراسیون و توده توموری در بیماران مبتلا به میلوم مالتیپل است(17). در مطالعه ونگ، مهار شدن تلومراز به وسیله تیوفوسفورامیدات مکمل ناحیه الگوی تلومراز(GRN163) روی رده سلولی میلومی، رده سلولی لنفوم غیر هوچکین، سلولهای گرفته شده از بیماران مبتلا به میلوم مالتیپل(MM) و مدل زنوگرافت تومور بررسی شد. تیمار سلولها با GRN163 سطح تلومراز را در همه سلولها کاهش داد و کوتاه شدن تلومر را تسریع کرد. GRN163 رشد زنوگرافت MM و لنفوم غیر هوچکین ناشی از ردههای سلولی با طول کوتاه تلومر را مهار کرد و آپوپتوز سلولهای توموری را افزایش داد. هم چنین استفاده سیستمیک روزانه داخل پریتوئن GRN163 در مدل زنوگرافت میلوما با طول کوتاه تلومر، باعث کاهش سطح تلومراز و کاهش حجم تومور شد. این اطلاعات نشان داد که تلومراز با حفظ تلومر نقش مهمی در همانندسازی نئوپلاسمهای سلول B دارد و آنها پیشنهاد کردند که مهار تلومراز رویکرد درمانی جدید برای میلوم مالتیپل و لنفوم غیر هوچکین میباشد(18). در مطالعه ویس و همکاران ردههای سلولی میلومی و سلولهای گرفته شده از بیماران مبتلا به مالتیپل میلوما با داروی بورتزومیب(bortezomib) تیمار شدند و تأثیر آن روی فعالیت تلومراز و پرولیفراسیون سلولی بررسی گردید. بورتزومیب باعث تنطیم کاهشی فعالیت تلومراز در سلولهای میلومی هم در زمان رونویسی و هم بعد از رونویسی میشود(14). در مطالعه ژیهوآ سلولهای میلومی U266 با غلظتهای مختلف مهارکننده تلومراز زیدوودین(zidovudine) تیمار شدند و میزان بیان تلومراز با روش TRAP و فعالیت متابولیکی سلولی با روش MTT بررسی شد. بقای سلولهای میلومی U266 تیمار شده با زیدوودین در مقایسه با گروه کنترل به طور قابل توجه کاهش یافت. فعالیت تلومراز بعد از تیمار با غلظت 1000 میکرومـولار بـرای 72 ساعت به میزان 55% کاهش یافت.
زیدوودین به طور مؤثر فعالیت تلومراز را در میلوم مالتیپل مهار میکند و از پرولیفراسیون آنها جلوگیری مینماید(15). در مطالعه سیمیا و همکارانش، MST-312 به عنوان کاندیدی قابل اعتماد برای هدف قرار دادن تلومراز معرفی شده است (12). مطالعههای قبلی نشان دادهاند که استفاده از این دارو سلول را در مرحله G0-G1 نگه میدارد. تیمار کردن بعضی تومورها با این دارو با دو مکانیسم، موجب مهار عملکرد تلومراز میشود. تیمار مداوم تومور با دارو موجب کوتاهی طول تلومر و در نتیجه کاهش تکثیر میگردد، و تیمار کوتاه مدت با دارو باعث اثرات حاد در سلول شده، به طوری که باعث تخریب DNAو مهار حیات آن میشود(11). هم چنین نشان داده شده است که کاهش طول تلومر با استفاده از MST-312 ، 29 جفت باز بوده و بنابراین این ترکیب، باعث ایجاد اختلال در رونویسی قسمت انتهایی کروموزوم میشود. مطالعههای قبلی کاهش 67 درصدی فعالیت تلومراز را با استفاده از MST-312 در رده سلولی U937 نشان دادهاند(12). سیمیا و همکارانش ثابت کردند که استفاده از MST312 باعث القای پیری در 58% کل سلولهای کشت داده شده میشود، که این کار را با بررسی بیان SA-β-Gal activity که مارکری برای بررسی پیری است انجام دادند(19، 12). در مطالعه ونگ و همکاران، سلولهای تومور مغزی Ependymomas مورد بررسی قرار گرفت. در این تومور مغزی، بیان آنزیم تلومراز باعث پیش آگهی ضعیف بیماری میشود. در مطالعه آنها، بیان تلومراز اندازهگیری شد، سلولها نیز با غلظت 1 میکرومولار داروی MST-312به مدت 72 ساعت تیمار شدند و میزان آپوپتوز سلولی بررسی گردید. آنها مشاهده کردند که بیان تلومراز در این سلولها بالا میباشد و بعد از تیمار با MST-312 تعداد سلولها به شدت کاهش مییابد و آپوپتوز سلولی افزایش مییابد(20). در مطالعه چانگ و همکاران سلولهای سرطان روده بزرگ(کولون) HT-29 و سرطان پستان MDA-MB-231 به طور همزمان با داروی فلاوونویید مورین (flavonoid morin) به همراه مهارکننده تلومراز MST-312 تیمار شدند تا تعداد سلولهای بنیادی سرطانی را کاهش دهد. حجم توموری و توانایی هجوم سلولی با تیمار همزمان سلولها با این دو دارو کاهش یافت. مطالعه آنها، استفاده هم زمان از دو داروی فلاوونویید مورین و مهار کننده تلومراز MST-312 را به عنوان درمان هدفمند برای بهبود پیشآگهی سرطان کولون و پستان معرفی کردند(21). در مطالعههای گذشته بیان شده اسـت کـه پـرتوتابـی در سلولهـای بدخیـم باعث افزایش فعالیت تلومراز میشود و هم چنین باعث افزایش مقاومت به پرتو درمانی بعدی میشود. در این رابطه ونگ و همکارانش آنزیم تلومراز را با داروی MST-312 در رده سلولی کارسینوم کبد HepG2 مهار کردند و میزان حساسیت به پرتوتابی این سلولها را قبل و بعد از تیمار با دارو بررسی کردند. آنها یافتند که این دارو به طور مؤثر فعالیت تلومراز را مهار میکند و نشان دادند که غلظت 4 میکرومولار دارو، کشندگی ضعیفی روی سلولهای HepG2 دارد. در مقایسه با پرتوتابی به تنهایی، تیمار سلولها با غلظت 4 میکرومولار و به دنبال آن تیمار با اشعه X ، پتانسیل کلونزایی تومور را به طور قابل توجهی کاهش میدهد.
مطالعه آنها نشان داد که تداخل در عملکرد تلومراز میتواند حساسیت به پرتوتابی را در سلولهای HepG2 نسبت به اشعه X افزایش دهد و هم چنین MST-312 میتواند به عنوان درمان کمکی به همراه پرتوتابی در درمان بدخیمی مؤثر باشد(22). در مطالعه سرانو سلولهای سرطان ریه با داروی MST-312 تیمار شدند. در این مطالعه MST-312 تأثیر آنتی تلومرازی قوی روی سلولهای سرطان ریه دارد و باعث القای p21 و p27 و آپوپتوز در همه جمعیت سلولی میشود(13).
هم چنین در مطالعه گورانگ، تاثیر داروی MST-312 بر روی سلوهای توموری سرطان پستان نیز بررسی شده است. این دارو در زمان کوتاه(48 ساعت) با کاهش فعالیت تلومرازی و القای عملکرد بد تلومر باعث توقف رشد در سلولهای سرطانی پستان شد(23). مطابق با نتایج مطالعههای دیگر، نتایج مطالعه حاضر نشان داد که تیمار کوتاه مدت سلولهای میلومی با MST-312 باعث کاهش زنـدهمانی و فعالیـت متابولیـک سلـول و القـای آپــوپتوز
میشود.
نتیجهگیری
تیمار کوتاه مدت سلولهای سرطانی میلومی با MST-
312 باعـث کاهـش زندهمانـی، کاهش فعالیت متابولیک و
افزایش آپوپتوز سلولی میشود. با توجه نتایج مطالعه حاضر، این دارو با مهار تلومراز و القای آپوپتوز در سلولهای میلومی میتواند به عنوان کاندیدی جهت درمان میلوم مالتیپل پیشنهاد شود.
نوع مطالعه: پژوهشي |
موضوع مقاله:
خون و انكولوژي
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |



