جلد 15، شماره 1 - ( بهار 1397 )
جلد 15 شماره 1 صفحات 46-36 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Akbari Saeed T, Ahmadi ZeydAbadi M, Fatemi A, Farsinejad A. Gamma irradiation, an appropriate method for sterilization of the fibrin membrane while maintaining its biocompatibility characteristics. bloodj 2018; 15 (1) :36-46
URL: http://bloodjournal.ir/article-1-1098-fa.html
URL: http://bloodjournal.ir/article-1-1098-fa.html
اکبری سعید طاهر، احمدی زیدآبادی میثم، فاطمی احمد، فارسی نژاد علیرضا. پرتودهی با اشعه گاما، شیوهای مناسب جهت استریلیزاسیون غشای فیبرینی همراه با حفظ ویژگیهای زیست سازگاری آن
. فصلنامه پژوهشی خون. 1397; 15 (1) :36-46
استادیار دانشکده پیراپزشکی دانشگاه علوم پزشکی کرمان
متن کامل [PDF 724 kb]
(2010 دریافت)
| چکیده (HTML) (6409 مشاهده)
مقدمه
مهندسی بافت، علم طراحی و تولید بافتهای جدید برای ترمیم اندامهای آسیب دیده و جایگزینی قسمتهای از دست رفته میباشد(2، 1). در واقع، مهندسی بافت با کشت سلولهای زنده بیمار بر روی داربستهای زیستی تخریب پذیر سه بعدی و با شبیهسازی عملکرد فیزیولوژیکی بستر خارج سلولی(ECM)، اجزای قابل پیوند و یا ساختارهایی را ایجاد مینماید که منجر به بازسازی و بازگردانی عملکرد بافت میشود(5-3). افزایش کارایی و بهبود عملکرد کشت سلول و بافتهای مهندسی شده، نیازمند ایجاد داربستهای مناسب و کارا میباشد. از اینرو، استفاده از بیومتریالهای زیستی و ساختی به عنوان داربستهای سلولی در فرآیندهای ترمیم بافتی، گسترش فراوانی یافته است(8-6).
غشای فیبرینی از جمله بیومتریالهای زیستی است که پتانسیل بالایی برای استفاده در مهندسی بافت دارد(12-9). فیبرین از خون خود بیمار جداسازی شده و به عنوان یک داربست اتولوگ بدون خطر از نظر ایجاد واکنشهای ایمنی و همچنین انتقال عفونت مورد استفاده قرار میگیرد. کاربرد فیبرین در زمینههای مهمی همچون جراحیهای شکمی، ارتوپدی، اعصاب و دهان رایج است(13). استفاده از فیبرین به عنوان یک داربست بافتی، محیطی با عملکرد سلولی مناسب را فراهم آورده که امکان مهاجرت، رشد، تکثیر و تمایز سلولی را به طور مطلوب ایجاد مینماید(14).
مطالعههای انجام شده حاکی از آن است که فعالیت متابولیک، تکثیر و تمایز سلولی در داربستهای فیبرینی به ویژه غشای فیبرینی غنی از پلاکت به طور معناداری بیشتر از سایر بیومتریالهای زیستی است(15).
زیست سازگاری بالا، قابلیت تجزیهپذیری زیستی، ایمنوژنیسیتی کم، عدم سمیت سلولی، میل اتصالی بالا، تهیه آسان، خصوصیات فیزیکی و مکانیکی مناسب و پایداری مطلوب غشای فیبرینی را به یک بیومتریال مناسب در مهندسی بافت تبدیل کرده است. با این وجود، احتمال انتقال بیماریهای ویروسی خطرناک نظیر HCV ، HBV ، HIV و غیره هم چنین بیماریهای باکتریایی مختلف توسط غشای فیبرینی، استفاده از این بیومتریال را صرفاً به فرم اتولوگ محدود کرده است(23-16).
یافتن راهکاری مناسب برای استفاده از غشای فیبرینی به صورت آلوژن در مهندسی بافت و همچنین رفع محدودیتهای کاربردی آن، سبـب استفاده گستردهتر از این بیومتریال زیسـت سـازگار و بهرهمندی از مزایای آن میگردد (25، 24). از اینرو، روشهای مختلف استریلیزاسیون همانند اتوکلاو، اشعه فرابنفش، اشعه گاما و اتیلن اکساید جهت استریل کردن غشای فیبرینی میتوانند مؤثر واقع گردند. از آن جا که تاکنون هیچ کار پژوهشی در زمینه استریل کردن غشای فیبرینی انجام نشده، مطالعه حاضر با هدف بررسی تاثیر روشهای مختلف استریلیزاسیون بر ارزیابی سمیت سلولی در غشاهای فیبرینی استریل شده انجام گرفته است.
مواد و روشها
در یک مطالعه تجربی، ارزیابی سمیت سلولی غشاهای فیبرینی استریل شده بر سلولهای فیبروبلاستی رده 3T3 در 5 گروه تجربی و یک گروه کنترل و در زمانهای 24، 48 و 72 ساعت انجام گرفت. نتایج حاصل از تمامی آزمایشها حاصل میانگین چهار بار تکرار نمونهها به وسیله آزمایش MTT بود. مراحل انجام این مطالعه به قرار زیر است.
ساخت غشای فیبرینی:
پلاسمای تازه منجمد یا FFP (Fresh Frozen Plasma) از سازمان انتقال خون کرمان تهیه شد. سپس با استفاده از اتانول سرد، فیبرینوژن جداسازی شد و با استفاده از ترومبین انسانی در ون بشرهای استریل آزمایشگاهی پلیمریزه و به شکل ژل فیبرینی درآمد. این ژل فیبرینی پس از آبگیری توسط سانتریفیوژ به غشای فیبرینی به قطر 5 سانتیمتر تبدیل گردید. جهت تهیه ترومبین انسانی از بخشی از پلاسمای تازه منجمد شده استفاده شد که طی آن 5/1 میلیلیتر از کلسیم 10% با 5/1 میلیلیتر از اتانول مطلق مخلوط و در نهایت به 7 میلیلیتر از پلاسمای تازه افزوده گردید. پس از گذشت چند دقیقه و تشکیل لختـه،
سـرم حـاوی تـرومبین به عنوان منبعی از ترومبین انسانی
جدا و مورد استفاده قرار گرفت.
استریلیزاسیون غشای فیبرینی:
استریلیزاسیون غشای فیبرینی با به کارگیری 3 روش اتوکلاو، اشعه فرابنفش و اشعه گاما انجام شد. به منظور استریل کردن غشاهای فیبرینی با حرارت مرطوب تحت فشار از اتوکلاو استفاده شد. فرآیند استریلیزاسیون در اتوکلاو(پارس طب نوین، ایران) در فشار بخار 15 پوند بر اینچ مربع در دمای 121 درجه سانتیگراد و به مدت 15 دقیقه انجام شد(26).
به منظور استریل کردن غشاهای فیبرینی با اشعه فرابنفش از لامپ UV هود لامینار(ژال تجهیز، ایران) استفاده شد. بدین منظور، غشاها به مدت 30 و 60 دقیقه در زیر لامپ UV قرار گرفتند(27). جهت استریلیزاسیون با اشعه گاما، غشاهای ساخته شده در معرض 25 کیلوگری پروتوی گاما تولید شده توسط دستگاه گاماسل(کانادا) موجود در سازمان انتقال خون کرمان، قرار گرفتند(32-28).
کشت سلولهای فیبروبلاستی رده 3T3 :
در مطالعه تجربی حاضر، به منظور بررسی سمیت سلولی در غشاهای فیبرینی استریل شده، از سلولهای فیبروبلاستی رده 3T3 استفاده شد. این رده سلولی از انستیتو پاستور ایران تهیه گردید. کشت سلولی در محیط کشت DMEM (آمریکا، جیبکو) حاوی 10% FBS (آمریکا، جیبکو) و 1% آنتی بیوتیک پنیسیلین – استرپتومایسین(آمریکا، جیبکو) در انکوباتور با دمای 37 درجه سانتیگراد و در شرایط 5% 2CO و رطوبت 95% صورت گرفت. پاساژ سلولی به فواصل 3-2 روز انجام شد. زمانی که سلولها به پاساژ سوم رسیدند، حیات سلولی با استفاده از رنگ تریپان بلو 4/0% تایید گردیده و سلولها توسط لام نئوبار شمارش شدند.
با بررسیهای میکروسکوپی از شرایط مناسب سلولهای رده 3T3 اطمینان حاصل شد و این سلـــولها برای آزمایش سمیت سلولی به روش MTT مورد استفاده قرار گرفتند.
بررسی سمیت غشای فیبرینی بر سلولهای فیبروبلاستــی
رده 3T3 با روش MTT :
الف- قرارگیری غشای فیبرینی در مجاورت سلولهای فیبروبلاستی رده 3T3 :
آزمایش MTT ] 3-(4 و 5- دیمتیل تیازول-2- یل) 2- و 5- دی متیل تترازولیوم بروماید[ به منظور تعیین میزان سمیت سلولی غشای فیبرینی و تاثیر آن بر زندهمانی سلولهای رده 3T3 انجام شد. بدین منظور تعداد 103 × 100 سلول رده 3T3 به صورت یک لایه درون هر یک از چاهکهای پلیت 96 خانه قرار داده شد. 100 میکرولیتر محیط کشت DMEM کامل به هر یک از چاهکها اضافه شد و سلولها به مدت 24-18 ساعت (overnight) در دمای 37 درجه سانتیگراد و در حضور 5% CO2 و رطوبت 95% انکوبه گردیدند. در زیر هود لومینار و در شرایط استریل، غشاهای فیبرینی(استریل شده و استریل نشده) با استفاده از پانچ به شکل دایرههایی با قطر 3 میلیمتر برش داده شدند. روز بعد، پس از اطمینان از چسبیدن کامل سلولها و پر شدن کف چاهکها (confluency حدود 80%-70%)، محیط سلولها با احتیاط تعویض گشته و غشاهای فیبرینی برش داده شده با توجه به گروه آنها (در معرض اشعه فرابنفش به مدت 30 دقیقه، در معرض اشعه فرابنفش به مدت 60 دقیقه، اتوکلاو شده، در معرض اشعه گاما و غشای استریل نشده) به چاهکهای مربوطه اضافه گردیدند. برای هر یـک از 5 گروه غشاهای فیبرینی و گروه کنترل 4 چاهـک اختصاص داده شد. به چاهکهای گروه کنترل غشای فیبرینی اضافه نشد.
ب: ارزیابی درصد زندهمانی سلولهای فیبروبلاستی رده 3T3 :
در پایان درصد زندهمانی سلولهای فیبروبلاستی رده 3T3 در زمانهای 24، 48 و 72 ساعت پس از انتقال غشای فیبرینی با به کارگیری آزمایش MTT مورد سنجش قرار گرفت. بدین منظور، 12 ساعت پس از مجاورت با غشاها، غشاهای فیبرینی و محیط کشت به آرامی از چاهکها خارج شده و مقدار 20 میکرولیتر از محلول MTT با غلظت mg/mL 5 در محیط تاریک به هر یک از چاهکها اضافه شد. پلیت با فویل آلومینیومی پوشیده شده و به مدت 4 ساعت در دمای 37 درجه سانتیگراد انکوبه گردید. پس از انکوباسیون، محیطها تخلیه شده و به منظور حل کردن کریستالهای فورمازان، مقدار 100 میکرولیتر دی متیل سولفوکساید (DMSO) به چاهکها اضافه شده و پس از 15 دقیقه، جذب نوری سلولها با استفاده از دستگاه الایزا ریدر در طول موج 490 نانومتر و با فیلتر مرجع در 620 نانومتر خوانده شد.
آنالیزهای آماری:
آنالیز آماری دادههای به دست آمده با استفاده از نرمافزار 23 IBM SPSS Statistic و با به کارگیری آزمون Paired-Sample t-test انجام شد. سطح معناداری با ارزش 01/0 p< مشخص گردید.
یافتهها
نتایج حاصل از ارزیابی سمیت سلولی غشاهای فیبرینی استریل شده بر سلولهای فیبروبلاستی رده 3T3 در 5 گروه تجربی و یک گروه کنترل و در زمانهای 24، 48 و 72 ساعت جمعآوری گردید. تمامی نتایج موجود
در جداول و نمودارهای رسم شده، حاصل میانگین چهار بار تکرار نمونهها به وسیله آزمایش MTT میباشند. درصد بقا و سمیت سلولی(میانگین ± انحراف معیار) در گروههای آزمایش نسبت به گروه کنترل بر حسب زمانهای پیگیری ترسیم شد(نمودار 1). درصد بقای (حیات) سلولی از تقسیم میانگین میزان جذب نوری هر یک از گروههای آزمایش به میانگین جذب نوری گروه کنترل در همان زمان ضربدر 100 به دست آمده و با کم کردن این عدد از 100، میزان درصد سمیت سلولی به دست آمد(33). مقایسه درصد بقای سلولی در غشای استریل نشده (طبیعی) با غشاهای استریل شده تفاوت معناداری را نشان نداد. بررسیهای انجام شده نشان داد که غشاهای فیبرینی استریل شده و همچنین غشای فیبرینی استریل نشده، بقای سلولهای فیبروبلاستی را 24 و 48 ساعت پس از مجاورت با غشا به طور معناداری افزایش دادهاند(به ترتیب 004/0 p= و 006/0 p=).
به عبارتی، غشای فیبرینی بستری مناسب جهت رشد و تکثیر سلولهای فیبروبلاستی فراهم آورده است. ولی 72 ساعت پس از مجاورت با غشا، از مقدار تکثیر سلولی کاسته شده و شواهدی از مرگ سلولی دیده شده است(نمودار 1).
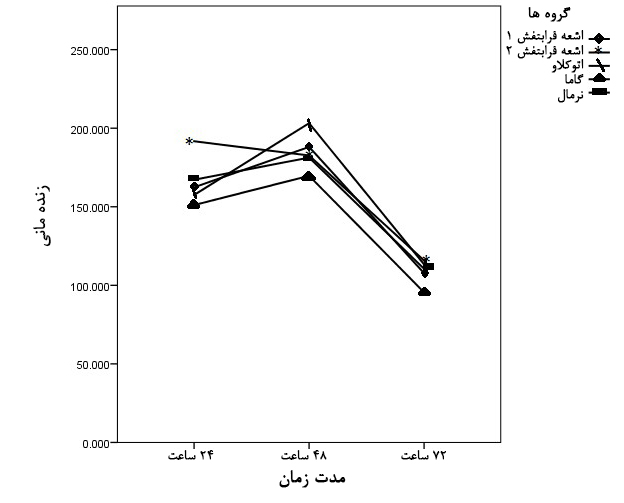
نمودار1: مقایسه درصد زندهمانی سلولهای رده 3T3 در غشاهای فیبرینی استریل شده و استریل نشده با گروه کنترل بر حسب زمانهای پیگیری
تفاوت معناداری در بقای سلولی در زمان 72 ساعت در غشاهای استریل شده مشاهده نشد ولی این تفاوت در غشای فیبرینی استریل نشده(طبیعی) معنادار بود(006/0 p=)(نمودار 2). بر اساس نتایج حاصله، تحریک رشد و افزایش بقای سلولی در 48 ساعت اول مجاورت با غشا دیده شده و پس از آن از میزان رشد و تکثیر سلولی کاسته شده است. بیشترین میزان بقای سلولی در غشای فیبرینی(استریل شده و استریل نشده) 48 ساعت پس از مجاورت با غشا دیده شد. یافته دیگر این بود که برخلاف سایر گروهها، غشای فیبرینی استریل شده با اشعه گاما 72 ساعت پس از مجاورت با غشا، برای سلولهای رده 3T3 توکسیک بوده و میزان بقای سلولی را به 5/95% کاهش داده است (جدول 1).
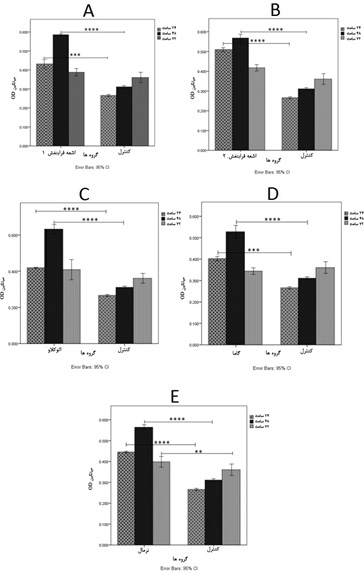
نمودار 2: مقایسه سمیت سلولی غشاهای فیبرینی استریل شده با گروه کنترل در زمانهای 24، 48 و 72 ساعت پس از مجاورت با غشا، A: سمیت سلولی غشای فیبرینی استریل شده با اشعه فرابنفش(به مدت 30 دقیقه) در مقایسه با گروه کنترل، B: سمیت سلولی غشای فیبرینی استریل شده با اشعه فرابنفش(به مدت 60 دقیقه) در مقایسه با گروه کنترل، C: سمیت سلولی غشای فیبرینی اتوکلاو شده در مقایسه با گروه کنترل، D: سمیت سلولی غشای فیبرینی استریل شده با اشعه گاما در مقایسه با گروه کنترل، E: سمیت سلولی غشای فیبرینی استریل نشده در مقایسه با گروه کنترل. در این نمودارها ** نشاندهنده 01/0 p ≤، *** نشاندهنده 001/0 p ≤ و **** نشاندهنده 0001/0 ≥ p است.
جدول 1: درصد بقا و سمیت سلولی در غشاهای فیبرینی استریل شده نسبت به گروه کنترل بر حسب زمانهای پیگیری
* از آن جایی که نه تنها سمیت سلولی وجود ندارد بلکه باعث القای رشد و تمایز شده است لذا بر اساس فرمول درصد سمیت سلولی منفی محاسبه میشود که نشاندهنده تاثیر مثبت و القای رشد و تکثیر سلولی است ولی از آنجایی که نمیتوان عدد منفی گزارش کرد، در محل مورد نظر خط فاصله قرار داده شده است که نشاندهنده عدم وجود سمیت سلولی میباشد.
بحث
یافتهها حاکی از آن است که غشای فیبرینی بقای سلولهای فیبروبلاستی را به میزان چشمگیری افزایش داده و فرآیندهای مختلف استریلیزاسیون تاثیری منفی بر پتانسیل تکثیری غشای فیبرینی نداشته است. از آن جایی که یکی از مهمترین جنبههای تاثیرگذار یک غشای زیستی در عملکرد آن، خصوصیات فیزیکی آن میباشد، لذا به نظر میرسد در کل ویژگیهای فیزیکی ماده زیستی مورد نظر در اثر اعمال روشهای مختلف استریلیزاسیون تحت تاثیر قرار نگرفته است، این یافتهها با نتایج حاصل از پژوهش رونی و همکاران که در سال 2008 بر روی پوست انجام شد، همراستا بود. در این پژوهش نیز پوست قرار گرفته در معرض اشعه گاما با دوز 25 کیلوگری با پوست دست نخورده تفاوتی از نظر قابلیتهای پیوند نداشت(28). بر اساس یافتهها درصد بقا و تکثیر سلولهای فیبروبلاستی 24 و 48 ساعت پس از مجاورت با غشای فیبرینی به طور معنادار و چشمگیری افزایش مییابد. با توجه به ساختار سه بعدی مناسب و هیدروفیل بودن غشای فیبرینی، این بیومتریال قادر است به عنوان یک ماده زمینه خارج سلولی، بستری مناسب جهت رشد سلولها فراهم آورد. به علاوه، آزاد شدن بسیاری از فاکتورهای زیست فعال از فیبرین میتواند در رشد و تمایز
سلولها نقش مهمی را ایفا نماید.
این نتایج با یافتههای احمد و همکاران مشابهت دارد. در این مطالعه نیز نتایج نشان داد فاکتورهای رشد موجود در چسب فیبرینی سبب تحریک رشد و همانندسازی سلولهای غضروفی در محل آسیب دیده میگردد. به گونهای که زمان ترمیم را به طور چشمگیری کاهش میدهد. همچنین افرادی و همکاران نیز در مطالعهای که بر روی اثر ترمیمی پلاسمای غنی از پلاکت بر روی زخمهای مزمن داشتند، دریافتند که فاکتورهای رشد موجود در این بیومتریال توانایی بالایی در القای رشد و تکثیر سلولی دارد(36-34).
برخلاف هیدروژلهای سنتتیک، فیبرین نه تنها یک ماتریکس سلولرسان است بلکه فعالیت زیستی فیبریـن آن را برای تمایز سلولهای بنیادی و مهندسی بافت مناسب میسازد (37). یافتههای چن و همکاران با نتایج حاصل از این پژوهش یکسان بود. این گروه در سال 2012 نشان دادند که تلفیق پلاکت انسانی بـا چسـب فیبرینـی، پتانسیل تمایزی و تکثیری کندروسیتها را در این داربست به میزان بالایی افزایش میبخشد(38). هم چنین کپسوله شدن سلولها درون داربست فیبرینی از دیگر عوامل مؤثر در حمایت از تکثیر سلولی است. از طرفی ، توالی اتصالی اینتگرینی آرژنین –گلیسین- آسپارتیک اسیـد
که یک عامل تحریککننده اتصال و رشد سلولی است، در فیبرین وجود دارد(39). در مطالعهای دیگر گزارش شده که در محیطهای برون و درون بدنی(in vitro و in vivo)، فیبرین امکان حمایت از رشد سلولهای فیبروبلاست و کراتینوسیت را فراهم آورده و سبب افزایش تحرک سلولی در محلهای زخم میگردد. چسب فیبرینی نیز از قابلیت خوبی در انتقال فاکتورهای رشد اگزوژنی برخوردار است، همین امر موجب بروز پیشرفتهایی در زمینه درمان زخم گردیده است(13).
از سویی، به نظر میرسد که تکثیر بسیار بالای سلولها در 48 ساعت اول پس از مجاورت با غشا، غلظت فاکتورهای رشد آزاد شده از غشای فیبرینی و هم چنین محرکهای رشد موجود در محیط کشت سلولها را کاهش داده و همین امر مانع تکثیر پیشرونده و بقای طولانی مدت سلولها در زمان 72 ساعت میگردد. به علاوه، گمان میرود که نقش رادیکالهای آزاد ایجاد شده در غشاهای فیبرینی که در معرض پرتوهای گاما قرار گرفتند، با کاهش عوامل محرک رشد در محیط پر رنگتر شده و کاهش بقای سلولی و همچنین مرگ سلولی را به دنبال دارد(29). همین امر توجیه کننده سمیت سلولی 5/4 درصدی غشاهای فیبرینی استریل شده با اشعه گاما در زمان 72 ساعت میباشد. پیش از این نیز، نقش فیبرین در تحریک رشد، تکثیر و بقای سلولی در گروهی از مطالعهها به اثبات رسیده بود. برای مثال، مطالعه آیوکی و همکارانش نشان داد که چسب فیبرینی سبب تحریک رشد و تکثیر سلولی میگردد(40). در مطالعه بن سعید و همکاران و لین و همکاران مشخص گردید که داربست فیبرینی سبب حفظ پتاسیل تکثیر و بقای سلولهای بنیادی مغز استخوان میشود(41). هم چنین گروهی از مطالعهها به نقش فیبرینوژن در تکثیر سلولی اشاره داشتهاند، به گونهای که دیده شده با افزایش استفاده از فیبرینوژن در داربست چسب فیبرینی، تکثیر سلولی به طور چشمگیری افزایش مییابد (42). هم چنین برتریهای فیبرین در مقایسه با سایر بیومتریالهای طبیعی برای استفاده در داربستهای ساخته شده برای کشت سلولهای مزانشیمی، مثال زدنی است(43). یافتههای گروهی از مطالعهها بیانگر این است که توانایی زندهماندن سلولهای بنیادی مزانشیمی مشتق از بافت چربی به طور معناداری در داربست فیبرینی نسبت به گروه کنترل بیشتر است. دلیل این امر را میتوان به قابلیت کپسوله کردن یکنواخت سلولها توسط فیبرین نسبت داد (44). مطالعه گیراندون و همکاران نیز نشان داد که سلولهای بنیادی مشتق از چربی قادر به تکثیر و بقا در داربست فیبرینی هستند(45). ژل فیبرینی نیز فرصت مناسبی را برای رشد سلولهای بنیادی مزانشیمی مشتق از چربی ایجاد مینماید. در پژوهشهای صورت گرفته در سالهای اخیر، چسب فیبرینی به عنوان کاندیدی مناسب جهت داربست طبیعی برای تمایز سلولهای چربی معرفی شد. به طوری که کشت سلولهای مزانشیمی مشتق از چربی در داربست چسب فیبرینی، سبب زنده ماندن طولانی مدت و افزایش بقای سلولها تا 84 روز گردید(40). در مطالعهای دیگر جانگ و همکارانش نشان دادند که درصد زندهمانی سلولهای مزانشیمی موش در داربست پلی لاکتیک اسید که دارای فیبرین و هیدروکسی آپاتیت بوده است، در روز اول به شدت کاهش یافته بود. این تیم تحقیقاتی بیان داشتند که با وجود سمیت بسیار بالای این داربست تلفیقی در روز اول، به تدریج سلولها در داربست تثبیت شده و کاهش در میزان سمیت سلولی این داربست از روز 17 قابل مشاهده بوده است(46). در مطالعهای نیز نشان داده شده که هیدروژل فیبرین به دست آمده از فیبرینوژن و ترومبین خون، از چرخه غضروفزایی حمایت نموده وسبب بهبود بقا، تکثیر و تمایز غضروف در شرایط آزمایشگاهی میگردد. به علاوه، این داربست توانایی ایجاد یک محیط مناسب جهت تمایز سلولهای بنیادی مزانشیمی به رده غضروفی را دارا میباشد(47). نتایج حاصل از تحقیق حاضر با یافتههای این دسته از مطالعهها همسو بوده و حاکی از تقویت قدرت رشد و تکثیر سلولی و افزایش بقای سلولها در داربست فیبرینی است. لازم به ذکر است که در اکثر مطالعههای قبلی، از فیبرین تجاری و تهیه شده از خون حیوانات استفاده شده ولی در این پژوهش از فیبرین با منشا انسانی جداسازی شده از FFP ، استفاده گردیـد کـه طـی روشی آسان و با هزینه بسیار اندک تهیه
میشود.
غشای فیبرینی از مهمترین بیومتریالهای زیستی است که به دلیل دارا بودن خصوصیات فیزیکی، مکانیکی و بیولوژیکی مناسب به ویژه زیست سازگاری و تخریبپذیری زیستی بالا، ایمونوژنیسیتی کم، عدم سمیت سلولی و میل اتصالی بالا، کاربرد گستردهای در مهندسی بافت دارد(48، 8). با این وجود، استفاده از غشای فیبرینی به صورت آلوژن به دلیل وجود خطر انتقال بیماریهای ویروسی و باکتریایی مختلف توسط این بیومتریال بسیار محدود میباشد(50، 49). شاید بتوان استریل کردن غشای فیبرینی را کلیدیترین راهکار برای رفع محدودیتهای کاربردی آن در مهندسی بافت دانست. نکته حائز اهمیت، پایداری و حفظ ویژگیهای این بیومتریال پس از فرآیندهای مختلف استریلیزاسیون است. بر اساس یافتههای به دست آمده از مطالعه تجربی حاضر، استریلیزاسیون غشای فیبرینی با اشعه فرابنفش، اتوکلاو و اشعه گاما نه تنها برای سلولهای فیبروبلاستی کشت داده شده بر این غشا سمیت نداشته، بلکه خواص بیولوژیکی این غشا را از نظر تحریک رشد و تکثیر و افزایش بقای این سلولها حفظ نموده است.
در مجمـوع مـیتوان نتیجـه گرفـت که تقویت قدرت
رشد و تکثیر سلولی از اصلیترین ویژگیهای غشای فیبرینی است و روشهای مختلف استریلیزاسیون(اشعه فرابنفش، اتوکلاو و اشعه گاما) قادر به تغییر آنها نمیباشند. یافتههای این پژوهش استفاده از روشهای استریلیزاسیون جهت کاهش خطرات احتمالی انتقال آلودگیها توسط غشای فیبرینی را در موارد استفاده به صورت آلوژن پیشنهاد مینماید.
نتیجهگیری
روش PCR-RFLP دارای حساسیت تشخیصی قابل مقایسهای با روشهای Real Time PCR و تعیین توالی بود. از دیگر مزایای این روش اصلاح شده میتوان به توانایی آن در افتراق انواع هموزیگوت و هتروزیگوت بیماران، وجود کنترل داخلی برای عملکرد آنزیم و هم چنین سهولت و صرفه اقتصادی آن اشاره کرد. این روش اصلاح شده میتواند به عنوان یک روش مناسب و مقرون بـه صرفه برای اجرا در آزمایشگاههای تشخیص مولکولی
پیشنهاد شود.
تشکر و قدردانی
با تشکر از مرکز سلولهای بنیادی دانشگاه علوم پزشکی کرمان که ما را در انجام این تحقیق یاری کردند.
متن کامل: (8091 مشاهده)
پرتودهی با اشعه گاما، شیوهای مناسب جهت استریلیزاسیون غشای فیبرینی همراه
با حفظ ویژگیهای زیست سازگاری آن
طاهر اکبری سعید1، میثم احمدی2، احمد فاطمی3، علیرضا فارسینژاد4
چکیده
سابقه و هدف
مهندسی بافت به عنوان یک روش بالقوه برای ترمیم بافتهای آسیبدیده ابداع گردید. پیش شرط لازم برای مهندسی بافت در شرایط آزمایشگاهی، رشد کافی سلولها بر روی داربست سلولی میباشد. یکی از بیومتریالهای جدید و مهم که از سال 2006 معرفی شد و هم اکنون فقط به صورت اتولوگ استفاده میشود، غشای فیبرینی است. با این وجود، استفاده از غشای فیبرینی به صورت آلوژن به دلیل خطر انتقال بیماریهای ویروسی و باکتریایی مختلف توسط آن بسیار محدود میباشد. شاید بتوان استریلیزه کردن غشای فیبرینی را کلیدیترین راهکار برای رفع محدودیتهای کاربردی آن در مهندسی بافت دانست.
مواد و روشها
در مطالعه تجربی حاضر، غشای فیبرینی از پلاسمای تازه منجمد(FFP) تهیه شده و با سه روش استریل گردید. میزان بقای سلولی و سمیت غشاهای فیبرینی استریل شده بر سلولهای فیبروبلاستی رده 3T3 با آزمایش MTT ارزیابی و تجزیه و تحلیل آماری دادههای به دست آمده با استفاده از آزمون Paired-Sample t-test انجام شد.
یافتهها
غشاهای فیبرینی استریل شده و نشده، بقای سلولهای فیبروبلاستی را 24 و 48 ساعت پس از مجاورت با غشا به طور معناداری افزایش دادند، ولی 72 ساعت پس از مجاورت با غشا، از مقدار تکثیر سلولی کاسته و شواهدی از مرگ سلولی دیده شد(به ترتیب 004/0 p= و 006/0 p=).
نتیجه گیری
بر اساس نتایج میتوان چنین استنباط کرد که غشای فیبرینی با فراهم نمودن بستری مناسب و آزادسازی فاکتورهای رشد، سبب تقویت پتانسیل تکثیر و افزایش بقای سلولها میگردد و استریلیزاسیون تاثیری بر این ویژگی غشای فیبرینی ندارد.
کلمات کلیدی: مهندسی بافت، فیبرینوژن، استریلیزاسیون، اشعه گاما
تاریخ دریافت: 20/9/95
تاریخ پذیرش: 20/9/96
1- کارشناس ارشد هماتولوژی و بانک خون ـ دانشکده علوم پزشکی سیرجان ـ دانشگاه علوم پزشکی کرمان ـ کرمان ـ ایران
2- دکترای بیوفیزیک ـ استادیار مرکز تحقیقات فیزیولوژی و علوم اعصاب دانشگاه علوم پزشکی کرمان ـ کرمان ـ ایران
3- PhD هماتولوژی آزمایشگاهی و بانک خون ـ استادیار دانشکده پیراپزشکی دانشگاه علوم پزشکی کرمان ـ کرمان ـ ایران
4- مؤلف مسئول: PhD هماتولوژی آزمایشگاهی و بانک خون ـ استادیار دانشکده پیراپزشکی دانشگاه علوم پزشکی کرمان ـ کرمان ـ ایران ـ کدپستی: 7619794435
با حفظ ویژگیهای زیست سازگاری آن
طاهر اکبری سعید1، میثم احمدی2، احمد فاطمی3، علیرضا فارسینژاد4
چکیده
سابقه و هدف
مهندسی بافت به عنوان یک روش بالقوه برای ترمیم بافتهای آسیبدیده ابداع گردید. پیش شرط لازم برای مهندسی بافت در شرایط آزمایشگاهی، رشد کافی سلولها بر روی داربست سلولی میباشد. یکی از بیومتریالهای جدید و مهم که از سال 2006 معرفی شد و هم اکنون فقط به صورت اتولوگ استفاده میشود، غشای فیبرینی است. با این وجود، استفاده از غشای فیبرینی به صورت آلوژن به دلیل خطر انتقال بیماریهای ویروسی و باکتریایی مختلف توسط آن بسیار محدود میباشد. شاید بتوان استریلیزه کردن غشای فیبرینی را کلیدیترین راهکار برای رفع محدودیتهای کاربردی آن در مهندسی بافت دانست.
مواد و روشها
در مطالعه تجربی حاضر، غشای فیبرینی از پلاسمای تازه منجمد(FFP) تهیه شده و با سه روش استریل گردید. میزان بقای سلولی و سمیت غشاهای فیبرینی استریل شده بر سلولهای فیبروبلاستی رده 3T3 با آزمایش MTT ارزیابی و تجزیه و تحلیل آماری دادههای به دست آمده با استفاده از آزمون Paired-Sample t-test انجام شد.
یافتهها
غشاهای فیبرینی استریل شده و نشده، بقای سلولهای فیبروبلاستی را 24 و 48 ساعت پس از مجاورت با غشا به طور معناداری افزایش دادند، ولی 72 ساعت پس از مجاورت با غشا، از مقدار تکثیر سلولی کاسته و شواهدی از مرگ سلولی دیده شد(به ترتیب 004/0 p= و 006/0 p=).
نتیجه گیری
بر اساس نتایج میتوان چنین استنباط کرد که غشای فیبرینی با فراهم نمودن بستری مناسب و آزادسازی فاکتورهای رشد، سبب تقویت پتانسیل تکثیر و افزایش بقای سلولها میگردد و استریلیزاسیون تاثیری بر این ویژگی غشای فیبرینی ندارد.
کلمات کلیدی: مهندسی بافت، فیبرینوژن، استریلیزاسیون، اشعه گاما
تاریخ دریافت: 20/9/95
تاریخ پذیرش: 20/9/96
1- کارشناس ارشد هماتولوژی و بانک خون ـ دانشکده علوم پزشکی سیرجان ـ دانشگاه علوم پزشکی کرمان ـ کرمان ـ ایران
2- دکترای بیوفیزیک ـ استادیار مرکز تحقیقات فیزیولوژی و علوم اعصاب دانشگاه علوم پزشکی کرمان ـ کرمان ـ ایران
3- PhD هماتولوژی آزمایشگاهی و بانک خون ـ استادیار دانشکده پیراپزشکی دانشگاه علوم پزشکی کرمان ـ کرمان ـ ایران
4- مؤلف مسئول: PhD هماتولوژی آزمایشگاهی و بانک خون ـ استادیار دانشکده پیراپزشکی دانشگاه علوم پزشکی کرمان ـ کرمان ـ ایران ـ کدپستی: 7619794435
مقدمه
مهندسی بافت، علم طراحی و تولید بافتهای جدید برای ترمیم اندامهای آسیب دیده و جایگزینی قسمتهای از دست رفته میباشد(2، 1). در واقع، مهندسی بافت با کشت سلولهای زنده بیمار بر روی داربستهای زیستی تخریب پذیر سه بعدی و با شبیهسازی عملکرد فیزیولوژیکی بستر خارج سلولی(ECM)، اجزای قابل پیوند و یا ساختارهایی را ایجاد مینماید که منجر به بازسازی و بازگردانی عملکرد بافت میشود(5-3). افزایش کارایی و بهبود عملکرد کشت سلول و بافتهای مهندسی شده، نیازمند ایجاد داربستهای مناسب و کارا میباشد. از اینرو، استفاده از بیومتریالهای زیستی و ساختی به عنوان داربستهای سلولی در فرآیندهای ترمیم بافتی، گسترش فراوانی یافته است(8-6).
غشای فیبرینی از جمله بیومتریالهای زیستی است که پتانسیل بالایی برای استفاده در مهندسی بافت دارد(12-9). فیبرین از خون خود بیمار جداسازی شده و به عنوان یک داربست اتولوگ بدون خطر از نظر ایجاد واکنشهای ایمنی و همچنین انتقال عفونت مورد استفاده قرار میگیرد. کاربرد فیبرین در زمینههای مهمی همچون جراحیهای شکمی، ارتوپدی، اعصاب و دهان رایج است(13). استفاده از فیبرین به عنوان یک داربست بافتی، محیطی با عملکرد سلولی مناسب را فراهم آورده که امکان مهاجرت، رشد، تکثیر و تمایز سلولی را به طور مطلوب ایجاد مینماید(14).
مطالعههای انجام شده حاکی از آن است که فعالیت متابولیک، تکثیر و تمایز سلولی در داربستهای فیبرینی به ویژه غشای فیبرینی غنی از پلاکت به طور معناداری بیشتر از سایر بیومتریالهای زیستی است(15).
زیست سازگاری بالا، قابلیت تجزیهپذیری زیستی، ایمنوژنیسیتی کم، عدم سمیت سلولی، میل اتصالی بالا، تهیه آسان، خصوصیات فیزیکی و مکانیکی مناسب و پایداری مطلوب غشای فیبرینی را به یک بیومتریال مناسب در مهندسی بافت تبدیل کرده است. با این وجود، احتمال انتقال بیماریهای ویروسی خطرناک نظیر HCV ، HBV ، HIV و غیره هم چنین بیماریهای باکتریایی مختلف توسط غشای فیبرینی، استفاده از این بیومتریال را صرفاً به فرم اتولوگ محدود کرده است(23-16).
یافتن راهکاری مناسب برای استفاده از غشای فیبرینی به صورت آلوژن در مهندسی بافت و همچنین رفع محدودیتهای کاربردی آن، سبـب استفاده گستردهتر از این بیومتریال زیسـت سـازگار و بهرهمندی از مزایای آن میگردد (25، 24). از اینرو، روشهای مختلف استریلیزاسیون همانند اتوکلاو، اشعه فرابنفش، اشعه گاما و اتیلن اکساید جهت استریل کردن غشای فیبرینی میتوانند مؤثر واقع گردند. از آن جا که تاکنون هیچ کار پژوهشی در زمینه استریل کردن غشای فیبرینی انجام نشده، مطالعه حاضر با هدف بررسی تاثیر روشهای مختلف استریلیزاسیون بر ارزیابی سمیت سلولی در غشاهای فیبرینی استریل شده انجام گرفته است.
مواد و روشها
در یک مطالعه تجربی، ارزیابی سمیت سلولی غشاهای فیبرینی استریل شده بر سلولهای فیبروبلاستی رده 3T3 در 5 گروه تجربی و یک گروه کنترل و در زمانهای 24، 48 و 72 ساعت انجام گرفت. نتایج حاصل از تمامی آزمایشها حاصل میانگین چهار بار تکرار نمونهها به وسیله آزمایش MTT بود. مراحل انجام این مطالعه به قرار زیر است.
ساخت غشای فیبرینی:
پلاسمای تازه منجمد یا FFP (Fresh Frozen Plasma) از سازمان انتقال خون کرمان تهیه شد. سپس با استفاده از اتانول سرد، فیبرینوژن جداسازی شد و با استفاده از ترومبین انسانی در ون بشرهای استریل آزمایشگاهی پلیمریزه و به شکل ژل فیبرینی درآمد. این ژل فیبرینی پس از آبگیری توسط سانتریفیوژ به غشای فیبرینی به قطر 5 سانتیمتر تبدیل گردید. جهت تهیه ترومبین انسانی از بخشی از پلاسمای تازه منجمد شده استفاده شد که طی آن 5/1 میلیلیتر از کلسیم 10% با 5/1 میلیلیتر از اتانول مطلق مخلوط و در نهایت به 7 میلیلیتر از پلاسمای تازه افزوده گردید. پس از گذشت چند دقیقه و تشکیل لختـه،
سـرم حـاوی تـرومبین به عنوان منبعی از ترومبین انسانی
جدا و مورد استفاده قرار گرفت.
استریلیزاسیون غشای فیبرینی:
استریلیزاسیون غشای فیبرینی با به کارگیری 3 روش اتوکلاو، اشعه فرابنفش و اشعه گاما انجام شد. به منظور استریل کردن غشاهای فیبرینی با حرارت مرطوب تحت فشار از اتوکلاو استفاده شد. فرآیند استریلیزاسیون در اتوکلاو(پارس طب نوین، ایران) در فشار بخار 15 پوند بر اینچ مربع در دمای 121 درجه سانتیگراد و به مدت 15 دقیقه انجام شد(26).
به منظور استریل کردن غشاهای فیبرینی با اشعه فرابنفش از لامپ UV هود لامینار(ژال تجهیز، ایران) استفاده شد. بدین منظور، غشاها به مدت 30 و 60 دقیقه در زیر لامپ UV قرار گرفتند(27). جهت استریلیزاسیون با اشعه گاما، غشاهای ساخته شده در معرض 25 کیلوگری پروتوی گاما تولید شده توسط دستگاه گاماسل(کانادا) موجود در سازمان انتقال خون کرمان، قرار گرفتند(32-28).
کشت سلولهای فیبروبلاستی رده 3T3 :
در مطالعه تجربی حاضر، به منظور بررسی سمیت سلولی در غشاهای فیبرینی استریل شده، از سلولهای فیبروبلاستی رده 3T3 استفاده شد. این رده سلولی از انستیتو پاستور ایران تهیه گردید. کشت سلولی در محیط کشت DMEM (آمریکا، جیبکو) حاوی 10% FBS (آمریکا، جیبکو) و 1% آنتی بیوتیک پنیسیلین – استرپتومایسین(آمریکا، جیبکو) در انکوباتور با دمای 37 درجه سانتیگراد و در شرایط 5% 2CO و رطوبت 95% صورت گرفت. پاساژ سلولی به فواصل 3-2 روز انجام شد. زمانی که سلولها به پاساژ سوم رسیدند، حیات سلولی با استفاده از رنگ تریپان بلو 4/0% تایید گردیده و سلولها توسط لام نئوبار شمارش شدند.
با بررسیهای میکروسکوپی از شرایط مناسب سلولهای رده 3T3 اطمینان حاصل شد و این سلـــولها برای آزمایش سمیت سلولی به روش MTT مورد استفاده قرار گرفتند.
بررسی سمیت غشای فیبرینی بر سلولهای فیبروبلاستــی
رده 3T3 با روش MTT :
الف- قرارگیری غشای فیبرینی در مجاورت سلولهای فیبروبلاستی رده 3T3 :
آزمایش MTT ] 3-(4 و 5- دیمتیل تیازول-2- یل) 2- و 5- دی متیل تترازولیوم بروماید[ به منظور تعیین میزان سمیت سلولی غشای فیبرینی و تاثیر آن بر زندهمانی سلولهای رده 3T3 انجام شد. بدین منظور تعداد 103 × 100 سلول رده 3T3 به صورت یک لایه درون هر یک از چاهکهای پلیت 96 خانه قرار داده شد. 100 میکرولیتر محیط کشت DMEM کامل به هر یک از چاهکها اضافه شد و سلولها به مدت 24-18 ساعت (overnight) در دمای 37 درجه سانتیگراد و در حضور 5% CO2 و رطوبت 95% انکوبه گردیدند. در زیر هود لومینار و در شرایط استریل، غشاهای فیبرینی(استریل شده و استریل نشده) با استفاده از پانچ به شکل دایرههایی با قطر 3 میلیمتر برش داده شدند. روز بعد، پس از اطمینان از چسبیدن کامل سلولها و پر شدن کف چاهکها (confluency حدود 80%-70%)، محیط سلولها با احتیاط تعویض گشته و غشاهای فیبرینی برش داده شده با توجه به گروه آنها (در معرض اشعه فرابنفش به مدت 30 دقیقه، در معرض اشعه فرابنفش به مدت 60 دقیقه، اتوکلاو شده، در معرض اشعه گاما و غشای استریل نشده) به چاهکهای مربوطه اضافه گردیدند. برای هر یـک از 5 گروه غشاهای فیبرینی و گروه کنترل 4 چاهـک اختصاص داده شد. به چاهکهای گروه کنترل غشای فیبرینی اضافه نشد.
ب: ارزیابی درصد زندهمانی سلولهای فیبروبلاستی رده 3T3 :
در پایان درصد زندهمانی سلولهای فیبروبلاستی رده 3T3 در زمانهای 24، 48 و 72 ساعت پس از انتقال غشای فیبرینی با به کارگیری آزمایش MTT مورد سنجش قرار گرفت. بدین منظور، 12 ساعت پس از مجاورت با غشاها، غشاهای فیبرینی و محیط کشت به آرامی از چاهکها خارج شده و مقدار 20 میکرولیتر از محلول MTT با غلظت mg/mL 5 در محیط تاریک به هر یک از چاهکها اضافه شد. پلیت با فویل آلومینیومی پوشیده شده و به مدت 4 ساعت در دمای 37 درجه سانتیگراد انکوبه گردید. پس از انکوباسیون، محیطها تخلیه شده و به منظور حل کردن کریستالهای فورمازان، مقدار 100 میکرولیتر دی متیل سولفوکساید (DMSO) به چاهکها اضافه شده و پس از 15 دقیقه، جذب نوری سلولها با استفاده از دستگاه الایزا ریدر در طول موج 490 نانومتر و با فیلتر مرجع در 620 نانومتر خوانده شد.
آنالیزهای آماری:
آنالیز آماری دادههای به دست آمده با استفاده از نرمافزار 23 IBM SPSS Statistic و با به کارگیری آزمون Paired-Sample t-test انجام شد. سطح معناداری با ارزش 01/0 p< مشخص گردید.
یافتهها
نتایج حاصل از ارزیابی سمیت سلولی غشاهای فیبرینی استریل شده بر سلولهای فیبروبلاستی رده 3T3 در 5 گروه تجربی و یک گروه کنترل و در زمانهای 24، 48 و 72 ساعت جمعآوری گردید. تمامی نتایج موجود
در جداول و نمودارهای رسم شده، حاصل میانگین چهار بار تکرار نمونهها به وسیله آزمایش MTT میباشند. درصد بقا و سمیت سلولی(میانگین ± انحراف معیار) در گروههای آزمایش نسبت به گروه کنترل بر حسب زمانهای پیگیری ترسیم شد(نمودار 1). درصد بقای (حیات) سلولی از تقسیم میانگین میزان جذب نوری هر یک از گروههای آزمایش به میانگین جذب نوری گروه کنترل در همان زمان ضربدر 100 به دست آمده و با کم کردن این عدد از 100، میزان درصد سمیت سلولی به دست آمد(33). مقایسه درصد بقای سلولی در غشای استریل نشده (طبیعی) با غشاهای استریل شده تفاوت معناداری را نشان نداد. بررسیهای انجام شده نشان داد که غشاهای فیبرینی استریل شده و همچنین غشای فیبرینی استریل نشده، بقای سلولهای فیبروبلاستی را 24 و 48 ساعت پس از مجاورت با غشا به طور معناداری افزایش دادهاند(به ترتیب 004/0 p= و 006/0 p=).
به عبارتی، غشای فیبرینی بستری مناسب جهت رشد و تکثیر سلولهای فیبروبلاستی فراهم آورده است. ولی 72 ساعت پس از مجاورت با غشا، از مقدار تکثیر سلولی کاسته شده و شواهدی از مرگ سلولی دیده شده است(نمودار 1).

نمودار1: مقایسه درصد زندهمانی سلولهای رده 3T3 در غشاهای فیبرینی استریل شده و استریل نشده با گروه کنترل بر حسب زمانهای پیگیری
تفاوت معناداری در بقای سلولی در زمان 72 ساعت در غشاهای استریل شده مشاهده نشد ولی این تفاوت در غشای فیبرینی استریل نشده(طبیعی) معنادار بود(006/0 p=)(نمودار 2). بر اساس نتایج حاصله، تحریک رشد و افزایش بقای سلولی در 48 ساعت اول مجاورت با غشا دیده شده و پس از آن از میزان رشد و تکثیر سلولی کاسته شده است. بیشترین میزان بقای سلولی در غشای فیبرینی(استریل شده و استریل نشده) 48 ساعت پس از مجاورت با غشا دیده شد. یافته دیگر این بود که برخلاف سایر گروهها، غشای فیبرینی استریل شده با اشعه گاما 72 ساعت پس از مجاورت با غشا، برای سلولهای رده 3T3 توکسیک بوده و میزان بقای سلولی را به 5/95% کاهش داده است (جدول 1).

نمودار 2: مقایسه سمیت سلولی غشاهای فیبرینی استریل شده با گروه کنترل در زمانهای 24، 48 و 72 ساعت پس از مجاورت با غشا، A: سمیت سلولی غشای فیبرینی استریل شده با اشعه فرابنفش(به مدت 30 دقیقه) در مقایسه با گروه کنترل، B: سمیت سلولی غشای فیبرینی استریل شده با اشعه فرابنفش(به مدت 60 دقیقه) در مقایسه با گروه کنترل، C: سمیت سلولی غشای فیبرینی اتوکلاو شده در مقایسه با گروه کنترل، D: سمیت سلولی غشای فیبرینی استریل شده با اشعه گاما در مقایسه با گروه کنترل، E: سمیت سلولی غشای فیبرینی استریل نشده در مقایسه با گروه کنترل. در این نمودارها ** نشاندهنده 01/0 p ≤، *** نشاندهنده 001/0 p ≤ و **** نشاندهنده 0001/0 ≥ p است.
جدول 1: درصد بقا و سمیت سلولی در غشاهای فیبرینی استریل شده نسبت به گروه کنترل بر حسب زمانهای پیگیری
| گروهها | 24 ساعت | 48 ساعت | 72 ساعت | |||
| بقای سلولی (درصد) | سمیت سلولی (درصد) | بقای سلولی (درصد) | سمیت سلولی (درصد) | بقای سلولی (درصد) | سمیت سلولی (درصد) | |
| اشعه UV (30 دقیقه) | 009/0 ± 4/162 | - | 010/0 ± 1/188 | - | 015/0 ± 7/107 | - |
| اشعه UV (60 دقیقه) | 007/0 ± 7/171 | - | 010/0 ± 6/182 | - | 012/0 ± 8/115 | - |
| اتوکلاو | 002/0 ± 5/157 | - | 009/0 ± 2/203 | - | 020/0 ± 3/113 | - |
| اشعه گاما | 006/0 ± 1/151 | - | 015/0 ± 7/169 | - | 011/0 ± 5/95 | 5/4 |
| غشای دست نخورده | 003/0 ± 2/167 | - | 018/0 ± 3/181 | - | 019/0 ± 5/110 | - |
بحث
یافتهها حاکی از آن است که غشای فیبرینی بقای سلولهای فیبروبلاستی را به میزان چشمگیری افزایش داده و فرآیندهای مختلف استریلیزاسیون تاثیری منفی بر پتانسیل تکثیری غشای فیبرینی نداشته است. از آن جایی که یکی از مهمترین جنبههای تاثیرگذار یک غشای زیستی در عملکرد آن، خصوصیات فیزیکی آن میباشد، لذا به نظر میرسد در کل ویژگیهای فیزیکی ماده زیستی مورد نظر در اثر اعمال روشهای مختلف استریلیزاسیون تحت تاثیر قرار نگرفته است، این یافتهها با نتایج حاصل از پژوهش رونی و همکاران که در سال 2008 بر روی پوست انجام شد، همراستا بود. در این پژوهش نیز پوست قرار گرفته در معرض اشعه گاما با دوز 25 کیلوگری با پوست دست نخورده تفاوتی از نظر قابلیتهای پیوند نداشت(28). بر اساس یافتهها درصد بقا و تکثیر سلولهای فیبروبلاستی 24 و 48 ساعت پس از مجاورت با غشای فیبرینی به طور معنادار و چشمگیری افزایش مییابد. با توجه به ساختار سه بعدی مناسب و هیدروفیل بودن غشای فیبرینی، این بیومتریال قادر است به عنوان یک ماده زمینه خارج سلولی، بستری مناسب جهت رشد سلولها فراهم آورد. به علاوه، آزاد شدن بسیاری از فاکتورهای زیست فعال از فیبرین میتواند در رشد و تمایز
سلولها نقش مهمی را ایفا نماید.
این نتایج با یافتههای احمد و همکاران مشابهت دارد. در این مطالعه نیز نتایج نشان داد فاکتورهای رشد موجود در چسب فیبرینی سبب تحریک رشد و همانندسازی سلولهای غضروفی در محل آسیب دیده میگردد. به گونهای که زمان ترمیم را به طور چشمگیری کاهش میدهد. همچنین افرادی و همکاران نیز در مطالعهای که بر روی اثر ترمیمی پلاسمای غنی از پلاکت بر روی زخمهای مزمن داشتند، دریافتند که فاکتورهای رشد موجود در این بیومتریال توانایی بالایی در القای رشد و تکثیر سلولی دارد(36-34).
برخلاف هیدروژلهای سنتتیک، فیبرین نه تنها یک ماتریکس سلولرسان است بلکه فعالیت زیستی فیبریـن آن را برای تمایز سلولهای بنیادی و مهندسی بافت مناسب میسازد (37). یافتههای چن و همکاران با نتایج حاصل از این پژوهش یکسان بود. این گروه در سال 2012 نشان دادند که تلفیق پلاکت انسانی بـا چسـب فیبرینـی، پتانسیل تمایزی و تکثیری کندروسیتها را در این داربست به میزان بالایی افزایش میبخشد(38). هم چنین کپسوله شدن سلولها درون داربست فیبرینی از دیگر عوامل مؤثر در حمایت از تکثیر سلولی است. از طرفی ، توالی اتصالی اینتگرینی آرژنین –گلیسین- آسپارتیک اسیـد
که یک عامل تحریککننده اتصال و رشد سلولی است، در فیبرین وجود دارد(39). در مطالعهای دیگر گزارش شده که در محیطهای برون و درون بدنی(in vitro و in vivo)، فیبرین امکان حمایت از رشد سلولهای فیبروبلاست و کراتینوسیت را فراهم آورده و سبب افزایش تحرک سلولی در محلهای زخم میگردد. چسب فیبرینی نیز از قابلیت خوبی در انتقال فاکتورهای رشد اگزوژنی برخوردار است، همین امر موجب بروز پیشرفتهایی در زمینه درمان زخم گردیده است(13).
از سویی، به نظر میرسد که تکثیر بسیار بالای سلولها در 48 ساعت اول پس از مجاورت با غشا، غلظت فاکتورهای رشد آزاد شده از غشای فیبرینی و هم چنین محرکهای رشد موجود در محیط کشت سلولها را کاهش داده و همین امر مانع تکثیر پیشرونده و بقای طولانی مدت سلولها در زمان 72 ساعت میگردد. به علاوه، گمان میرود که نقش رادیکالهای آزاد ایجاد شده در غشاهای فیبرینی که در معرض پرتوهای گاما قرار گرفتند، با کاهش عوامل محرک رشد در محیط پر رنگتر شده و کاهش بقای سلولی و همچنین مرگ سلولی را به دنبال دارد(29). همین امر توجیه کننده سمیت سلولی 5/4 درصدی غشاهای فیبرینی استریل شده با اشعه گاما در زمان 72 ساعت میباشد. پیش از این نیز، نقش فیبرین در تحریک رشد، تکثیر و بقای سلولی در گروهی از مطالعهها به اثبات رسیده بود. برای مثال، مطالعه آیوکی و همکارانش نشان داد که چسب فیبرینی سبب تحریک رشد و تکثیر سلولی میگردد(40). در مطالعه بن سعید و همکاران و لین و همکاران مشخص گردید که داربست فیبرینی سبب حفظ پتاسیل تکثیر و بقای سلولهای بنیادی مغز استخوان میشود(41). هم چنین گروهی از مطالعهها به نقش فیبرینوژن در تکثیر سلولی اشاره داشتهاند، به گونهای که دیده شده با افزایش استفاده از فیبرینوژن در داربست چسب فیبرینی، تکثیر سلولی به طور چشمگیری افزایش مییابد (42). هم چنین برتریهای فیبرین در مقایسه با سایر بیومتریالهای طبیعی برای استفاده در داربستهای ساخته شده برای کشت سلولهای مزانشیمی، مثال زدنی است(43). یافتههای گروهی از مطالعهها بیانگر این است که توانایی زندهماندن سلولهای بنیادی مزانشیمی مشتق از بافت چربی به طور معناداری در داربست فیبرینی نسبت به گروه کنترل بیشتر است. دلیل این امر را میتوان به قابلیت کپسوله کردن یکنواخت سلولها توسط فیبرین نسبت داد (44). مطالعه گیراندون و همکاران نیز نشان داد که سلولهای بنیادی مشتق از چربی قادر به تکثیر و بقا در داربست فیبرینی هستند(45). ژل فیبرینی نیز فرصت مناسبی را برای رشد سلولهای بنیادی مزانشیمی مشتق از چربی ایجاد مینماید. در پژوهشهای صورت گرفته در سالهای اخیر، چسب فیبرینی به عنوان کاندیدی مناسب جهت داربست طبیعی برای تمایز سلولهای چربی معرفی شد. به طوری که کشت سلولهای مزانشیمی مشتق از چربی در داربست چسب فیبرینی، سبب زنده ماندن طولانی مدت و افزایش بقای سلولها تا 84 روز گردید(40). در مطالعهای دیگر جانگ و همکارانش نشان دادند که درصد زندهمانی سلولهای مزانشیمی موش در داربست پلی لاکتیک اسید که دارای فیبرین و هیدروکسی آپاتیت بوده است، در روز اول به شدت کاهش یافته بود. این تیم تحقیقاتی بیان داشتند که با وجود سمیت بسیار بالای این داربست تلفیقی در روز اول، به تدریج سلولها در داربست تثبیت شده و کاهش در میزان سمیت سلولی این داربست از روز 17 قابل مشاهده بوده است(46). در مطالعهای نیز نشان داده شده که هیدروژل فیبرین به دست آمده از فیبرینوژن و ترومبین خون، از چرخه غضروفزایی حمایت نموده وسبب بهبود بقا، تکثیر و تمایز غضروف در شرایط آزمایشگاهی میگردد. به علاوه، این داربست توانایی ایجاد یک محیط مناسب جهت تمایز سلولهای بنیادی مزانشیمی به رده غضروفی را دارا میباشد(47). نتایج حاصل از تحقیق حاضر با یافتههای این دسته از مطالعهها همسو بوده و حاکی از تقویت قدرت رشد و تکثیر سلولی و افزایش بقای سلولها در داربست فیبرینی است. لازم به ذکر است که در اکثر مطالعههای قبلی، از فیبرین تجاری و تهیه شده از خون حیوانات استفاده شده ولی در این پژوهش از فیبرین با منشا انسانی جداسازی شده از FFP ، استفاده گردیـد کـه طـی روشی آسان و با هزینه بسیار اندک تهیه
میشود.
غشای فیبرینی از مهمترین بیومتریالهای زیستی است که به دلیل دارا بودن خصوصیات فیزیکی، مکانیکی و بیولوژیکی مناسب به ویژه زیست سازگاری و تخریبپذیری زیستی بالا، ایمونوژنیسیتی کم، عدم سمیت سلولی و میل اتصالی بالا، کاربرد گستردهای در مهندسی بافت دارد(48، 8). با این وجود، استفاده از غشای فیبرینی به صورت آلوژن به دلیل وجود خطر انتقال بیماریهای ویروسی و باکتریایی مختلف توسط این بیومتریال بسیار محدود میباشد(50، 49). شاید بتوان استریل کردن غشای فیبرینی را کلیدیترین راهکار برای رفع محدودیتهای کاربردی آن در مهندسی بافت دانست. نکته حائز اهمیت، پایداری و حفظ ویژگیهای این بیومتریال پس از فرآیندهای مختلف استریلیزاسیون است. بر اساس یافتههای به دست آمده از مطالعه تجربی حاضر، استریلیزاسیون غشای فیبرینی با اشعه فرابنفش، اتوکلاو و اشعه گاما نه تنها برای سلولهای فیبروبلاستی کشت داده شده بر این غشا سمیت نداشته، بلکه خواص بیولوژیکی این غشا را از نظر تحریک رشد و تکثیر و افزایش بقای این سلولها حفظ نموده است.
در مجمـوع مـیتوان نتیجـه گرفـت که تقویت قدرت
رشد و تکثیر سلولی از اصلیترین ویژگیهای غشای فیبرینی است و روشهای مختلف استریلیزاسیون(اشعه فرابنفش، اتوکلاو و اشعه گاما) قادر به تغییر آنها نمیباشند. یافتههای این پژوهش استفاده از روشهای استریلیزاسیون جهت کاهش خطرات احتمالی انتقال آلودگیها توسط غشای فیبرینی را در موارد استفاده به صورت آلوژن پیشنهاد مینماید.
نتیجهگیری
روش PCR-RFLP دارای حساسیت تشخیصی قابل مقایسهای با روشهای Real Time PCR و تعیین توالی بود. از دیگر مزایای این روش اصلاح شده میتوان به توانایی آن در افتراق انواع هموزیگوت و هتروزیگوت بیماران، وجود کنترل داخلی برای عملکرد آنزیم و هم چنین سهولت و صرفه اقتصادی آن اشاره کرد. این روش اصلاح شده میتواند به عنوان یک روش مناسب و مقرون بـه صرفه برای اجرا در آزمایشگاههای تشخیص مولکولی
پیشنهاد شود.
تشکر و قدردانی
با تشکر از مرکز سلولهای بنیادی دانشگاه علوم پزشکی کرمان که ما را در انجام این تحقیق یاری کردند.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |





