جلد 14، شماره 1 - ( بهار 1396 )
جلد 14 شماره 1 صفحات 64-53 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Nayebhashemi M, Mohammadi pour M, Fahimii H, Habibi Roudkenar M, Jalili M A. Isolation, cloning and expression of human stem cell factor using prokaryotic expression system . bloodj 2017; 14 (1) :53-64
URL: http://bloodjournal.ir/article-1-1060-fa.html
URL: http://bloodjournal.ir/article-1-1060-fa.html
نایب هاشمی مهسا، محمدی پور مهشید، فهیمی حسین، حبیبی رودکنار مهریار، جلیلی محمدعلی. جداسازی، همسانهسازی و بیان فاکتور سلول بنیادی با استفاده از سیستم بیانی پروکاریوتی. فصلنامه پژوهشی خون. 1396; 14 (1) :53-64
استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون
متن کامل [PDF 492 kb]
(2955 دریافت)
| چکیده (HTML) (5471 مشاهده)
مقدمه
خونسازی توسط تعدادی از سایتوکاینها تنظیم میشود که باعث بقا، تکثیر و تمایز سلولهای بنیادی خونساز میشوند. یکی از مهمترین این سایتوکاینها فاکتور سلول بنیادی(Stem Cell Factor: SCF) است که به رسپتور C-kit (CD117) با فعالیت تیروزین کینازی متصل میشود (5-1). SCF یک گلیکوپروتئین همودایمر با وزن مولکولی 40-28 کیلو دالتون و دارای 4 واحد سیستئین(Cys) است که در پیوندهـای دی سولفیدی درون مولکولی شرکت میکنند (8-6). این فاکتور رشد توسط سلولهای اندوتلیال، فیبروبلاست، سلولهای استرومایی مغز استخوان و سلولهای کراتینوسیت در پوست بیان میشود(10، 9). مطالعهها نشان دادهاند که SCF مکمل ضروری در کشت سلولهای بنیادی خونساز است(12، 11). فرم بالغ این پروتئین در انسان با حدود 189 آمینواسید است. SCF دارای دو ایزوفرم تراغشایی و محلول است. SCF به شکل محلول با داشتن 165 آمینو اسید در حدود 5/18کیلو دالتون وزن مولکولی دارد. SCF تراغشایی در حدود 220 تا 248 آمینواسید دارد(14، 13، 2، 1). حضور یا عدم حضور گلیکوزیلاسیون در فعالیتهای خاص فاکتور سلول بنیادی تاثیر نمیگذارد(6). از یک سو مشکلات عدیده در دسترسی و قیمت بالای این محصول به صورت تجاری و از سوی دیگر نیاز کشور در حوزه بهداشت و سلامت به این محصول، اهمیت تولید خودکفای این محصول را بر همگان آشکار میسازد. با در نظر گرفتن این نکته که به نظر میرسد گلیکوزیلاسیون در عملکرد این پروتئین نقش مهمی ندارد بنابراین استفاده از سیستمهای بیانی یوکاریوتی با توجه به نیاز به صرف وقت و هزینه زیاد توجیهپذیر نخواهد بود. بلکه اکثر انواع تجاری این پروتئین در سیستمهای بیانی پروکاریوتی مثل pET system و در میزبان بیانی Ecoli BL21 تولید میشوند. این سیستم بیانی علاوه بر این که تولید در مقیاس وسیع را فراهم میکند، میتواند تولید این محصول را با صرف زمان و هزینه کمتری نسبت به سیستمهای یوکاریوتی فراهم کند. در مطالعه حاضر از میزبان بیانی Rosetta استفاده شد که ضمن بهرهبرداری از تمامی مزایای یک سیستم بیانی پروکاریوتی مانند تولید مقادیر زیادی از پروتئین با هزینه نسبتاً کمتری نسبت به سایر سیستمهای بیانی از جمله سلولهای یوکاریوتی و امکان ارتقا به تولید در مقیاس وسیع و تجاریسازی را نیز فراهم میسازد. از سوی دیگر به دلیل وجود کدونهای نادری در توالی رمزکننده پروتئین SCF و با توجه به این که میزبان بیانی Rosetta تمام tRNA های کدونهای نادر را پشتیبانی میکند، برای تولید پروتئین SCF نوترکیب که توالی رمزکننده آن از منبع یوکاریوتی(رده سلولی Hela) جداسازی شده بود، از آن استفاده شد. استفاده از این میزبان برای تولید پروتئین فاکتور سلول بنیادی(SCF) تاکنون گزارش نشده است(23-15).
مواد و روشها
این مطالعه تجربی در مرکز تحقیقات سازمان انتقال خون تهران در سالهای 95-94 انجام شد.
پلاسمید pET-32a (آمریکا، نواژن) به عنوان وکتور کلونینگ و بیان، سویه باکتری E. coli TOP10به عنوان میزبان کلونینگ و سویه Rosetta (آمریکا، نواژن) به عنوان میزبان بیانی انتخاب شد .وکتور pET-32a حاوی ژن مقاومت به آمپیسیلین است که به منظور غربالگری کلونهای پایدار ترانسفکت شده در رده سلول پروکاریوتی استفاده گردید. این وکتور دارای دو برچسب هیستیدینی (His6-tag) در انتهای آمین و کربوکسیل برای شناسایی پروتئین در وسترن بلات و هم چنین یک برچسب تیوردوکسین(trx-tag) برای افزایش احتمال تشکیل پیوند دیسولفید در سیتوپلاسم باکتری میزبان است.
رده سلولی Hela با منشا سلولهای سرطانی دهانه رحم انسان)بانک سلولی انستیتو پاستور، ایران) در محیط کشتRPMI 1640 حاوی 10%FBS ، 1 % پنیسیلین و 1% استرپتومایسین در شرایط استریل و با استفاده از هود لامینار در انکوباتور با دمای 37 درجه سانتیگراد و 5% CO2 کشت داده شد.
جداسازی ژن فاکتور سلول بنیادی:
استخراج RNA از سلولهای Hela ، با استفاده از محلول تـرایزول TriPure Isolation Reagent محصـول شـرکت
جدول 1: آغازگر جهت ایجاد قطعه 221 جفت بازی از نواحی داخلی فاکتور سلول بنیادی و آغازگر جهت ایجاد قطعه 190 جفت بازی ژن بتا اکتین و آغازگر جهت ایجاد قطعه 516 جفت بازی از ژن فاکتور سلول بنیادی

شکل1: الکتروفورز محصول PCR بر روی ژل آگارز 2% در بافر TAE ؛ الف: در ستون اول شاخص اندازه مولکولی 100 جفت بازی، در ستون دوم و سوم باند 190 جفتبازی محصول تکثیر ژن خانهداری بتااکتین با آغازگرهای اختصاصی به عنوان کنترل نشان داده شده است. ب: در ستون اول شاخص اندازه مولکولی 100 جفت بازی، در ستون دوم و سوم باند 221 جفت بازی حاصل تکثیر بخشی از توالی SCF با آغازگرهای داخلی اختصاصی نشان داده شده است.


شکل3 : الف) الکتروفورز پلاسمید نوترکیب در مقایسه با پلاسمید pET-32 کنترل؛ الکتروفورز پلاسمید استخراج شده از کلونی مثبت(ستون 3) در کنار پلاسمید pET-32 به عنوان کنترل(ستون 2) با نشان دادن تأخیر در حرکت بر روی ژل آگارز 5/1%، نوترکیب ارزیابی شد. ستون 1 شاخص اندازه مولکولی 1 کیلوبازی است. ب) الکتروفورز محصول واکنش هضم آنزیمی وکتور نوترکیب؛ ستون 1 شاخص اندازه مولکولی 1 کیلو بازی، ستون 2 جدا شدن توالی رمزکننده SCF به طول 516 جفت باز از وکتور نوترکیب که با پیکان مشخص شده است را نشان میدهد.
بحث
بقا و تمایز انواع متعدد سلولهای میلوئید، اریتروئید، مگاکاریوسیت، لنفاوی، سلول زایا و اجداد ملانوسیت به حضور فاکتور سلول بنیادی وابسته است. فاکتور سلول بنیادی(SCF) به طور گستردهای در تحقیقات سلولهای بنیادی و نیز در تحقیقات مربوط به بررسی روند مولکولی بیماریزایی سرطانهایی از جمله لوسمی حاد و مزمن میلوبلاستی، نوروبلاستوما، سرطان تخمدان و پروستات و لنفوما، هم چنین در مطالعههای مهاجرت سلولهای بنیادی سرطانی و مطالعههای مولکولی در انواع کم خونیها و حتـی ایجاد روشهای درمانی جدید استفاده میشود. نقش بارز پروتئین فاکتور سلول بنیادی درکشت و توسعه سلولهای بنیادی خونساز و جنینی، اهمیت مطالعه و تولید فاکتور سلول بنیادی(SCF) را نشان میدهد.
در تحقیق حاضر ابتدا از سلولهای Hela کشت داده شده در آزمایشگاه، RNA کل استخراج شد و پس از ساخت cDNA ، ژن کدکننده فاکتور سلول بنیادی به طول 516 جفت باز تکثیر گردید. قطعه ژنی هدف به حامل مناسب منتقل و صحت کلونسازی و ایجاد حامل نوترکیب با استفاده از روشهای PCR ، الگوی هضم توسط آنزیمهای محدودکننده و توالییابی تایید شد. در مرحله بعد ژن رمزکننده فاکتور سلول بنیادی در میزبان بیانی Rosetta تولید شد. بیان پروتئین حاصل متصل به بر چسب هیستیدینی و trx ، از نظر وزن مولکولی(36 کیلو دالتون) تایید شد. هم چنین ماهیت پروتئین بیان شده به عنوان فاکتور سلول بنیادی به روش لکهگذاری وسترن و با استفاده از آنتیبادیهای مونوکلونال His-Tag Anti متصل به آنزیم HRP تایید شد.
ژن کدکننده فاکتور سلول بنیادی با منشا انسانی دارای 13 کدون نادر(rare codon) است، در مطالعه حاضر از میزبان بیانی Rosetta برای بیان پروتئین نوترکیب فاکتور سلول بنیادی انسانی استفاده شد. این میزبان ضمن این که تمامی مزایای یک سیستم بیانی پروکاریوتی مانند تولید مقادیر زیادی از پروتئین با هزینه نسبتاً کمتر نسبت به سایر سیستمهای بیانی را دارد، امکان افزایش میزان تولید محصول را نیز فراهم میکند. میزبان بیانی Rosetta یک سویه مهندسی شده است که امکان تولید پروتئینهای یوکاریوتی با کدونهای نادر مثل AGG ، AGA ، AUA ، CUA ، CCC و GGA وجود دارد. بنابراین مشکل تولید فاکتور سلول بنیادی با کدونهای نادر نیز مرتفع شده و نیازی به بهینهسازی توالی و سنتز ژن با کدونهای متناسب با سیستم بیانی پروکاریوتی وجود ندارد.
در تحقیق حاضر ابتدا از سلولهای Hela کشت داده شده در آزمایشگاه، RNA کل استخراج شد و پس از ساخت cDNA ، ژن کدکننده فاکتور سلول بنیادی به طول 516 جفت باز تکثیر گردید. قطعه ژنی هدف به حامل مناسب منتقل و صحت کلون سازی و ایجاد حامل نوترکیب با استفاده از روشهای PCR ، الگوی هضم توسط آنزیمهای محدود کننده و توالییابی تایید شد. در مرحله بعد ژن رمزکننده فاکتور سلول بنیادی در سلولهای Rosetta بیان گردید. بیان پروتئین حاصل متصل به برچسب هیستیدینی و trx ، از نظر وزن مولکولی (36 کیلو دالتون) تایید شد. هم چنین ماهیت پروتئین بیان شده به عنوان فاکتور سلول بنیادی به روش لکهگذاری وسترن و با استفاده از آنتیبادیهای مونوکلونـال His-Tag Anti متصـل
به آنزیم HRP تایید شد.
هن و همکاران در سال 2003 فاکتور سلول بنیادی نوترکیب انسانی را با استفاده از سیستم بیانی یوکاریوتی در سلولهای حشره تولید کردند. به این منظور توالی رمزکننده فاکتور سلول بنیادی محلول(165 آمینواسید) را به فرم کوتاه شده آن (145 آمینواسید) به وسیله یک لینکر 12 آمینو اسیدی متصل کرده، در وکتور pAcSecG2T همسانهسازی نموده و در سیستم بیانی باکلوویروس بیان کردند. این سیستم از نظر هزینه و زمان نسبت به سیستم بیانی پروکاریوتی پرهزینهتر و زمانبر است(24).
در سال 2013 عسگری و همکاران فاکتور سلول بنیادی محلول را در وکتور pET-26b همسانهسازی کردند. اما گزارشی از بیان و تخلیص این پروتئین ارائه نکردند(25).
در سال 2013 فرهادی و همکاران فاکتور سلول بنیادی محلول را با استفاده از یک شاتل وکتور(مورد استفاده در سیستم بیانی پروکاریوتی و هم یوکاریوتی) به نام pPIC9 در سیستم بیانی یوکاریوتی مخمر Picha pastoris همسانهسازی و بیان کردند. این سیستم نیز از نظر هزینه نسبت به سیستم بیانی پروکاریوتی معمولاً در اولویت انتخاب قرار نمیگیرد(26).
لو و همکاران در سال 2005، ابتدا توالی رمز کننده فاکتور سلول بنیادی نوترکیب انسانی را به صورت دایمر (که کدکننده 165 آمینواسید بود)(rdhSCF) تکثیر کرده، به فرم کوتاه شده آن(145 آمینواسید) به وسیله یک لینکر 12 آمینواسیدی متصل نموده و در وکتور pET-22b همسانهسازی کردند و سپس در سیستم بیانیEcoli BL21 بیان نمودند(27).
در سال 2015، آکوتا و همکاران فاکتور سلول بنیادی محلول را با استفاده از وکتور pET-3b همسانهسازی کرده و در میزبان بیانیEcoli BL21 تولید کردند(28).
در سال 2016، یوادا و همکاران بیان و تخلیص فاکتور سلول بنیادی محلول نوترکیب انسانی را در میزبان بیانیEcoli BL21 عاری از اندوتوکسین به وسیله مخلوط کردن سولفید با پرسولفید بهبود بخشیدند. آنها نشان دادند که بیان هم زمان پروتئین با تیوردوکسین، تولید فاکتور سلـول بنیـادی نوترکیب انسانی به شکل محلول را افزایش
میدهد(29).
در این مطالعه پروتئین SCF نوترکیب انسانی در اتصال با برچسب هیستیدینی و trx ، در سویه Rosetta که به صورت مهندسی شده میتواند کدونهای نادر مربوط به پروتئینهای یوکاریوتی را پشتیبانی کند، تولید شد.
نتیجهگیری
حاصل این مطالعه جداسازی موفقیتآمیز توالی رمزکننده فاکتور سلول بنیادی(SCF) از سلولهای Hela و همسانهسازی در وکتور بیانی pET-32aبود که به دنبال آن پروتئین نوترکیب در میزبان بیانی Rosettaبیان شد. در این سیستم بیانی امکان تولید پروتئینهای یوکاریوتی با کدونهای نادر مثل AGG ،AGA ،AUA ، CUA ، CCC
و GGA وجود دارد بنابراین به میزان بالایی پروتئین فاکتور سلول بنیادی تولید شد.
تشکر و قدردانی
این مقاله حاصل پایان نامه دانشجویی دوره کارشناسی ارشد رشته بیوتکنولوژی پزشکی مرکز تحقیقات مؤسسه عالی آموزشی و پژوهشی طب انتقال خون میباشد. بودجه این تحقیق توسط مؤسسه عالی آموزشی و پژوهشی طب انتقال خون تأمین گردیده و همه مراحل عملی پروژه در مرکز تحقیقات سازمان انتقال خون ایران انجام شده است.
متن کامل: (5261 مشاهده)
جداسازی، همسانهسازی و بیان فاکتور سلول بنیادی با استفاده از
سیستم بیانی پروکاریوتی
مهسا نایبهاشمی1، مهشید محمدیپور2، حسین فهیمی3، مهریار حبیبی رودکنار4، محمد علی جلیلی5
چکیده
سابقه و هدف
فاکتور سلول بنیادی(SCF)، یک گلیکوپروتئین 28 تا 40 کیلودالتونی است که نقش مهمی را در تکثیر و تمایز سلولهای بنیادی خونساز(HSCs) بازی میکند. هدف این مطالعه جداسازی، کلونینگ و بیان SCF در میزبان بیانیRosetta بود. Rosetta علاوه بر ویژگیهای میزبان بیانی پروکاریوتی، انتظار میرفت با فراهم کردن کدونهای نادر پروتئینهای یوکاریوتی، سطح بیان پروتئین نوترکیب را افزایش دهد.
مواد و روشها
مطالعه انجام از نوع تجربی بود. RNA تام از سلولهای Hela استخراج و به دنبال آن cDNA ساخته شد. توالی رمزکننده SCF ، به وسیله آغازگرهای اختصاصی جداسازی و تکثیر شد و با استفاده از وکتور بیانی pET-32a در E.coli TOP 10 همسانهسازی شد. سازه نوترکیب به وسیله PCR ، هضم آنزیمی و تعیین توالی تایید شد. وکتور نوترکیب در میزبان بیانی Rosetta تراریخت شد. بیان SCF نوترکیب در حضور IPTG القا شد. بیان فاکتور سلول بنیادی انسانی(hSCF) با SDS-PAGE و وسترن بلات ارزیابی و تایید شد.
یافتهها
توالی رمزکننده SCF با موفقیت از سلولهای Hela جداسازی و در وکتور بیانی pET-32a همسانهسازی و بیان پروتئین نوترکیب در میزبان بیانی Rosetta انجام شد.
نتیجهگیری
در سیستم بیانی Rosetta ، امکان تولید پروتئینهای یوکاریوتی با کدونهای نادر مثل AGG ، AGA ، AUA ، CUA ، CCC و GGA وجود دارد بنابراین به میزان بالایی پروتئین فاکتور سلول بنیادی تولید میشود.
کلمات کلیدی: گلیکوزیلاسیون، سلول بنیادی، PCR
تاریخ دریافت: 24/5/95
تاریخ پذیرش : 25/8/95
1- کارشناس ارشد بیوتکنولوژی پزشکی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
2- PhD ژنتیک مولکولی ـ استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
3- PhD ژنتیک مولکولی ـ استادیار گروه علوم سلولی و مولکولی ـ دانشکده علوم و فناوریهای نوین ـ دانشگاه آزاد اسلامی واحد علوم دارویی ـ تهران ـ ایران
4- PhD فرآوردههای بیولوژیک ـ مرکز تحقیقات بیوتکنولوژی ـ دانشکده پزشکی دانشگاه گیلان ـ رشت ـ ایران
5- مؤلف مسئول: PhD شیمی دارویی ـ استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
سیستم بیانی پروکاریوتی
مهسا نایبهاشمی1، مهشید محمدیپور2، حسین فهیمی3، مهریار حبیبی رودکنار4، محمد علی جلیلی5
چکیده
سابقه و هدف
فاکتور سلول بنیادی(SCF)، یک گلیکوپروتئین 28 تا 40 کیلودالتونی است که نقش مهمی را در تکثیر و تمایز سلولهای بنیادی خونساز(HSCs) بازی میکند. هدف این مطالعه جداسازی، کلونینگ و بیان SCF در میزبان بیانیRosetta بود. Rosetta علاوه بر ویژگیهای میزبان بیانی پروکاریوتی، انتظار میرفت با فراهم کردن کدونهای نادر پروتئینهای یوکاریوتی، سطح بیان پروتئین نوترکیب را افزایش دهد.
مواد و روشها
مطالعه انجام از نوع تجربی بود. RNA تام از سلولهای Hela استخراج و به دنبال آن cDNA ساخته شد. توالی رمزکننده SCF ، به وسیله آغازگرهای اختصاصی جداسازی و تکثیر شد و با استفاده از وکتور بیانی pET-32a در E.coli TOP 10 همسانهسازی شد. سازه نوترکیب به وسیله PCR ، هضم آنزیمی و تعیین توالی تایید شد. وکتور نوترکیب در میزبان بیانی Rosetta تراریخت شد. بیان SCF نوترکیب در حضور IPTG القا شد. بیان فاکتور سلول بنیادی انسانی(hSCF) با SDS-PAGE و وسترن بلات ارزیابی و تایید شد.
یافتهها
توالی رمزکننده SCF با موفقیت از سلولهای Hela جداسازی و در وکتور بیانی pET-32a همسانهسازی و بیان پروتئین نوترکیب در میزبان بیانی Rosetta انجام شد.
نتیجهگیری
در سیستم بیانی Rosetta ، امکان تولید پروتئینهای یوکاریوتی با کدونهای نادر مثل AGG ، AGA ، AUA ، CUA ، CCC و GGA وجود دارد بنابراین به میزان بالایی پروتئین فاکتور سلول بنیادی تولید میشود.
کلمات کلیدی: گلیکوزیلاسیون، سلول بنیادی، PCR
تاریخ دریافت: 24/5/95
تاریخ پذیرش : 25/8/95
1- کارشناس ارشد بیوتکنولوژی پزشکی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
2- PhD ژنتیک مولکولی ـ استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
3- PhD ژنتیک مولکولی ـ استادیار گروه علوم سلولی و مولکولی ـ دانشکده علوم و فناوریهای نوین ـ دانشگاه آزاد اسلامی واحد علوم دارویی ـ تهران ـ ایران
4- PhD فرآوردههای بیولوژیک ـ مرکز تحقیقات بیوتکنولوژی ـ دانشکده پزشکی دانشگاه گیلان ـ رشت ـ ایران
5- مؤلف مسئول: PhD شیمی دارویی ـ استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
مقدمه
خونسازی توسط تعدادی از سایتوکاینها تنظیم میشود که باعث بقا، تکثیر و تمایز سلولهای بنیادی خونساز میشوند. یکی از مهمترین این سایتوکاینها فاکتور سلول بنیادی(Stem Cell Factor: SCF) است که به رسپتور C-kit (CD117) با فعالیت تیروزین کینازی متصل میشود (5-1). SCF یک گلیکوپروتئین همودایمر با وزن مولکولی 40-28 کیلو دالتون و دارای 4 واحد سیستئین(Cys) است که در پیوندهـای دی سولفیدی درون مولکولی شرکت میکنند (8-6). این فاکتور رشد توسط سلولهای اندوتلیال، فیبروبلاست، سلولهای استرومایی مغز استخوان و سلولهای کراتینوسیت در پوست بیان میشود(10، 9). مطالعهها نشان دادهاند که SCF مکمل ضروری در کشت سلولهای بنیادی خونساز است(12، 11). فرم بالغ این پروتئین در انسان با حدود 189 آمینواسید است. SCF دارای دو ایزوفرم تراغشایی و محلول است. SCF به شکل محلول با داشتن 165 آمینو اسید در حدود 5/18کیلو دالتون وزن مولکولی دارد. SCF تراغشایی در حدود 220 تا 248 آمینواسید دارد(14، 13، 2، 1). حضور یا عدم حضور گلیکوزیلاسیون در فعالیتهای خاص فاکتور سلول بنیادی تاثیر نمیگذارد(6). از یک سو مشکلات عدیده در دسترسی و قیمت بالای این محصول به صورت تجاری و از سوی دیگر نیاز کشور در حوزه بهداشت و سلامت به این محصول، اهمیت تولید خودکفای این محصول را بر همگان آشکار میسازد. با در نظر گرفتن این نکته که به نظر میرسد گلیکوزیلاسیون در عملکرد این پروتئین نقش مهمی ندارد بنابراین استفاده از سیستمهای بیانی یوکاریوتی با توجه به نیاز به صرف وقت و هزینه زیاد توجیهپذیر نخواهد بود. بلکه اکثر انواع تجاری این پروتئین در سیستمهای بیانی پروکاریوتی مثل pET system و در میزبان بیانی Ecoli BL21 تولید میشوند. این سیستم بیانی علاوه بر این که تولید در مقیاس وسیع را فراهم میکند، میتواند تولید این محصول را با صرف زمان و هزینه کمتری نسبت به سیستمهای یوکاریوتی فراهم کند. در مطالعه حاضر از میزبان بیانی Rosetta استفاده شد که ضمن بهرهبرداری از تمامی مزایای یک سیستم بیانی پروکاریوتی مانند تولید مقادیر زیادی از پروتئین با هزینه نسبتاً کمتری نسبت به سایر سیستمهای بیانی از جمله سلولهای یوکاریوتی و امکان ارتقا به تولید در مقیاس وسیع و تجاریسازی را نیز فراهم میسازد. از سوی دیگر به دلیل وجود کدونهای نادری در توالی رمزکننده پروتئین SCF و با توجه به این که میزبان بیانی Rosetta تمام tRNA های کدونهای نادر را پشتیبانی میکند، برای تولید پروتئین SCF نوترکیب که توالی رمزکننده آن از منبع یوکاریوتی(رده سلولی Hela) جداسازی شده بود، از آن استفاده شد. استفاده از این میزبان برای تولید پروتئین فاکتور سلول بنیادی(SCF) تاکنون گزارش نشده است(23-15).
مواد و روشها
این مطالعه تجربی در مرکز تحقیقات سازمان انتقال خون تهران در سالهای 95-94 انجام شد.
پلاسمید pET-32a (آمریکا، نواژن) به عنوان وکتور کلونینگ و بیان، سویه باکتری E. coli TOP10به عنوان میزبان کلونینگ و سویه Rosetta (آمریکا، نواژن) به عنوان میزبان بیانی انتخاب شد .وکتور pET-32a حاوی ژن مقاومت به آمپیسیلین است که به منظور غربالگری کلونهای پایدار ترانسفکت شده در رده سلول پروکاریوتی استفاده گردید. این وکتور دارای دو برچسب هیستیدینی (His6-tag) در انتهای آمین و کربوکسیل برای شناسایی پروتئین در وسترن بلات و هم چنین یک برچسب تیوردوکسین(trx-tag) برای افزایش احتمال تشکیل پیوند دیسولفید در سیتوپلاسم باکتری میزبان است.
رده سلولی Hela با منشا سلولهای سرطانی دهانه رحم انسان)بانک سلولی انستیتو پاستور، ایران) در محیط کشتRPMI 1640 حاوی 10%FBS ، 1 % پنیسیلین و 1% استرپتومایسین در شرایط استریل و با استفاده از هود لامینار در انکوباتور با دمای 37 درجه سانتیگراد و 5% CO2 کشت داده شد.
جداسازی ژن فاکتور سلول بنیادی:
استخراج RNA از سلولهای Hela ، با استفاده از محلول تـرایزول TriPure Isolation Reagent محصـول شـرکت
جدول 1: آغازگر جهت ایجاد قطعه 221 جفت بازی از نواحی داخلی فاکتور سلول بنیادی و آغازگر جهت ایجاد قطعه 190 جفت بازی ژن بتا اکتین و آغازگر جهت ایجاد قطعه 516 جفت بازی از ژن فاکتور سلول بنیادی
| آغازگر | توالی | دمای اتصال | اندازه محصول | |
| Beta-actin | جلوبرنده | 5'-tcatgaagatcctcaccgag-3' | 55 درجه سانتیگراد | 190 جفت باز |
| معکوس | 5'-ttgccaatggtgatgacctg-3' | |||
| SCF-internal | جلوبرنده | 5'- cgggatggatgttttgccaa-3' | 55 درجه سانتیگراد | 221 جفت باز |
| معکوس | 5'- tgggttctgggctcttgaat-3' | |||
| SCF-total | جلوبرنده | 5' agtcaccatggaagggatctgcaggaatcg-3' | 59 درجه سانتیگراد | 516 جفت باز |
| معکوس | 5' ttaatctcgagggctgcaacagggggtaac-3' | |||
رُوش طبق دستورالعمل شرکت سازنده انجام شد. کمیت و کیفیت RNA استخراج شده با دستگاه اسپکتروفتومتری نانودراپ بررسی و با الکتروفورز بر روی ژل آگارز 1% تایید گردید.
ساخت cDNA بهروش نسخهبرداری معکوس از RNAرده سلولی(Hela) با استفاده از کیت محصول بیونیر با 5/2 میکروگرم RNA در 20 میکرولیتر آب مقطر حاوی DEPC در ترمال سایکلر بیوراد به تعداد 12 دور انجام شد. پیش از این مرحله، آغازگرهای اختصاصی برای ژن بتااکتین و نواحی داخلی ژن SCF به وسیله نرمافزار primer3 طراحی شد. سپس واکنش PCR با استفاده از آغازگرهای اختصاصی ژن خانهداری بتااکتین بهعنوان کنترل و آغازگرهای اختصاصی نواحی داخلی ژن SCF به طور جداگانه در 35 چرخه انجام شد. به منظور بررسی کیفیت cDNA ، ژن β- actin(ژنی که به صورت عمومی در تمام سلولها وجود دارد و جزو ژنهای خانهدار است) به عنوان کنترل انتخاب شد. جهت طراحی آغازگرهای اختصاصی توالی رمزکننده SCF ، ابتدا توالی mRNA فاکتور سلول بنیادی از بانک ژن NCBI به دست آمد و پس از انتخاب توالی رمزکننده پروتئین بالغ SCF به فرم محلول به طول 495 جفت باز، برای طراحی آغازگر رفت (Forward) 20 نوکلئوتید از ابتدای این توالی انتخاب و به '5 آن، توالی جایگاه برش اختصاصی با آنزیم NcoI اضافه شد. برای طراحی آغازگر برگشت(Reverse) ، 20 نوکلئوتید ابتدایی مکمل معکوس توالی یاد شده انتخاب و به '5 آن توالی جایگاه برش با آنزیم XhoI اضافه شد. توالیهای اختصاصی برش با NcoI و XhoI در جایگاه کلونینگ وکتور وجود دارد. واکنش PCR با استفاده از آغازگرهای اختصاصی ژن SCF در 35 چرخه انجام شد (جدول 1).
بعد از الکتروفورز محصول PCR برروی ژل آگارز 2% در بافر TAE، برای حذف ترکیبات اضافی شامل پروتئینها و نوکلئوتیدها و آغازگر دایمرهای احتمالی و به دست آوردن محصول خالص واکنش PCR ، تخلیص از ژل با استفاده از کیت High Pure PCR Product Purification مطابق دستورالعمل شرکت سازنده(آلمان، رُوش) انجام شد. کمیت و کیفیت DNA استخراج شده با دستگاه اسپکتروفتومتری نانودراپ مورد ارزیابی قرار گرفت.
همسانهسازی توالی رمزکننده SCF :
یک کلونی از پلیت کشت باکتری Ecoli DH5α دارای وکتور pET-32 (حامل ژن مقاومت به آنتیبیوتیک آمپیسیلین) انتخاب و در محیط LB حاوی آنتیبیوتیک آمپیسیلین به غلظت نهایی 100 میکروگرم در میلیلیتر کشت داده شد. استخراج پلاسمید با استفاده از کیت (ایران، یکتـا تجهیز عظما) به روش Miniprep انجام شد. کمیت و کیفیت پلاسمید استخراج شده با دستگاه اسپکتروفتومتری نانودراپ سنجیده شد. به منظور همسانهسازی قطعه ژنی رمزکننده فاکتور سلول بنیادی در وکتور pET-32a ، که در مرحله قبل با استفاده از PCR و آغازگرهای اختصاصی تکثیر شده بود و با توجه به وجود جایگاههای برش اختصاصی با آنزیمهای محدودکننده XhoI و NcoI در انتهای '5 این دو آغازگر، وکتور و قطعه هدف هر دو تحت اثر این دو آنزیم برش داده شدند .وکتور و قطعه ژنی برش خورده پس از تخلیص و تعیین غلظت، به نسبت مولی 1:4 به وسیله آنزیم T4 DNA ligase به هم متصل شدند. بعد از آمادهسازی سلولهای E. coli TOP10 جهت پذیرش پلاسمید، تراریختی سلولهای مستعد(competent cells) انجام شد. جهت انتخاب کلونیهای حاوی وکتور نوترکیب از آنتیبیوتیک آمپیسیلین( µg/mL100) استفاده شد و صحت انجام کلونینگ به وسیله colony-PCR،Digestion pattern و sequencing تأیید شد.
پس از تعیین توالی، 13 کدون نادر مربوط به پروتئین یوکاریوتی به وسیله نرمافزار Rare Codon Analysis یافت شد. سپس باکتری Rosetta دارای ژن مقاومت به آنتیبیوتیک کلرامفنیکل در محیط LB (Lysogeny broth) حاوی این آنتیبیوتیک کشت داده و به مدت 18 ساعت در دمای 37 درجه سانتیگراد در انکوباتور شیکردار گرماگذاری شد. پس از تهیه سلولهای مستعد برای پذیرش وکتور نوترکیب و تراریختی آنها، باکتریهای تراریخته بر روی محیط کشت انتخابی شامل آنتیبیوتیکهای کلرامفنیکل (که ژن مقامت به آن در Rosetta وجود دارد) و هم چنین آمپیسیلین(که ژن مقامت به آن بر روی وکتور نوترکیب pET32-SCF قرار دارد)، رشد کرده و کلونی تشکیل دادند که نشاندهنده ورود وکتور نوترکیب به سلولهای باکتری بود.
بیان پروتئین نوترکیب فاکتور سلول بنیادی:
یک کلونی از باکتری Rosetta تراریخته حاوی وکتور نوترکیب در محیط LB حاوی 100 میکروگرم در میلیلیتر آنتیبیوتیک آمپیسیلین و 34 میکروگرم در میلیلیتر آنتیبیوتیک کلرامفنیکل کشت و به مدت 18 ساعت در انکوباتور با دمای 37 درجه سانتیگراد با چرخش 200 دور در دقیقه(rpm) نگهداری شد. از کشت شبانه باکتری، کشت تازه تهیه شده تا دانسیته جذب نوری(OD) رشد باکتری در طول موج 600 نانومتر به حدود 4/0 رسید. 2 میلیلیتر از سوسپانسیون کشت باکتری به عنوان کنترل قبل از القای بیان پروتئین برداشت شد. جهت القای بیان پروتئین، IPTG با غلظت نهایی یک میلیمولار اضافه شد. سپس به منظور تعیین زمان مناسب برای بیان پروتئین در فواصل 2 و 4 ساعت، 2 میلیلیتر نمونه از سوسپانسیون باکتری برداشت شد. پس از تهیه عصاره سلولی از نمونههای 2 و 4 ساعته باکتریهای القا شده، بیان پروتئین با الکتروفورز عصاره سلولهای باکتری بر روی ژل پلیآکریل امید 12% و سپس رنگآمیزی با رنگ کوماسی بلو R-250 مورد ارزیابی قرار گرفت. هم چنین در نتیجه بهینهسازی بیان پروتئین، 4 ساعت القا با IPTG زمان مناسب ارزیابی شد.
آزمایش SDS-PAGE و وسترن بلات (Western Blot) :
الکتروفورز پروتئینها با استفاده از روش SDS-PAGE در سیستم بافری ناپیوسته شامل ژل متراکمکننده و ژل جداکننده انجام شد. 20 میکرولیتر از نمونهها پس از سانتریفیوژ، همراه با شاخص وزن مولکولی به وسیله سرنگ همیلتون به چاهکهای ژل منتقل شدند. بعد از اتمام الکتروفورز به مدت 4 ساعت در اختلاف پتانسیل 150 ولت، کاست حاوی ژل باز شد و بخش بالایی ژل (متراکمکننده) جدا شد. سپس با استفاده از رنگ کوماسی به مدت 2 ساعت رنگ شده و پس از رنگزدایی با محلول رنگبری به مدت 2 ساعت روی شیکر مورد بررسی قرار گرفت.
برای تأیید اختصاصیت پروتئین نوترکیب، آزمایش وسترن بلات طبق روش استاندارد انجام شد. به طور خلاصه پس از الکتروفورز پروتئین بر روی ژل پلیآکریلآمید به روش SDS-PAGE ، عمل انتقال باندهای تفکیک شده پروتئینها به غشای PVDF (رُوش، آلمان) با روش الکتروبلاتینگ نیمه خشک انجام شد. برای کنترل انتقال پروتئین از رنگ پانسواس استفاده شد. مسدود سازی غشای PVDF با محلول شیرخشک بدون چربی(skim milk) 5% در PBS انجام گرفت و پس از شستشو با PBS در محلول آنتیبادی مونوکلونال His-Tag Antiمتصل به HRP (سیتومتین ژن، ایران) با رقت 1:1000 به مدت 2 ساعت قرار گرفت. شستشو با بافر PBS حاوی 05/0% توئین 20 به منظور حذف اتصالات غیر اختصاصی آنتیبادیها و کاهش پس زمینه غیر اختصاصی انجام شد. غشاء پس از شستشو با محلول سوبسترای رنگزای دی-آمینوبنزیدین (DAB) به مدت یک دقیقه مجاور شده و باندهای مربوطه پس از ظهور، عکس برداری گردید.
یافتهها
جداسازی توالی رمزکننده فاکتور سلول بنیادی از سلول Hela :
پس از استخراج RNA از سلولهای Hela و ساخت cDNA و به دنبال آن PCR با آغازگرهای اختصاصی بتا اکتین، مشاهده باند 190 جفت بازی در نتیجه الکتروفورز محصول واکنش تکثیر ژن بتااکتین بر روی ژل آگارز 2 درصد در بافر TAE نشاندهنده کیفیت cDNA ساخته شده میباشد(شکل 1ـ الف)
در نتیجه واکنش PCR و الکتروفورز بر روی ژل آگارز 2%، وجود یک باند 221 جفت بازی محصول تکثیر نواحی داخلی ژن SCF با استفاده از آغازگرهای داخلی نشان داده کـه سلولهـای اپیتلیالی Hela منبع مناسبی برای جداسازی
ژن فاکتور سلول بنیادی است(شکل 1ـ ب).
بخش رمزکننده پروتئین محلول بالغ به طول 165 اسیـد آمینه از cDNA رده سلولی Hela با استفاده از آغازگرهای اختصاصی طراحی شده برای ژن مذکور به وسیله آنزیم pfu DNA polymerase که دارای قدرت تصحیح خطای همانندسازی است، به وسیله PCR تکثیر شد. مشاهده قطعهای به طول 516 جفت باز به عنوان محصول نهایی PCR پس از الکتروفورز بر روی ژل آگارز 2% ، جداسازی توالی رمزکننده SCF محلول را تأیید کرد(شکل 2).
همسانهسازی توالی رمزکننده فاکتور سلول بنیادی در وکتور pET32 :
توالی رمزکننده SCF پس از برش با آنزیمهای محدودالاثر اختصاصی به درون وکتور pET-32a ، کلون شد و به درون باکتری E.coli TOP10 انتقال یافت و کلونهای باکتری با رشد در محیط حاوی آنتیبیوتیک آمپیسیلین و کلرامفنیکل غربالگری شد.
ساخت cDNA بهروش نسخهبرداری معکوس از RNAرده سلولی(Hela) با استفاده از کیت محصول بیونیر با 5/2 میکروگرم RNA در 20 میکرولیتر آب مقطر حاوی DEPC در ترمال سایکلر بیوراد به تعداد 12 دور انجام شد. پیش از این مرحله، آغازگرهای اختصاصی برای ژن بتااکتین و نواحی داخلی ژن SCF به وسیله نرمافزار primer3 طراحی شد. سپس واکنش PCR با استفاده از آغازگرهای اختصاصی ژن خانهداری بتااکتین بهعنوان کنترل و آغازگرهای اختصاصی نواحی داخلی ژن SCF به طور جداگانه در 35 چرخه انجام شد. به منظور بررسی کیفیت cDNA ، ژن β- actin(ژنی که به صورت عمومی در تمام سلولها وجود دارد و جزو ژنهای خانهدار است) به عنوان کنترل انتخاب شد. جهت طراحی آغازگرهای اختصاصی توالی رمزکننده SCF ، ابتدا توالی mRNA فاکتور سلول بنیادی از بانک ژن NCBI به دست آمد و پس از انتخاب توالی رمزکننده پروتئین بالغ SCF به فرم محلول به طول 495 جفت باز، برای طراحی آغازگر رفت (Forward) 20 نوکلئوتید از ابتدای این توالی انتخاب و به '5 آن، توالی جایگاه برش اختصاصی با آنزیم NcoI اضافه شد. برای طراحی آغازگر برگشت(Reverse) ، 20 نوکلئوتید ابتدایی مکمل معکوس توالی یاد شده انتخاب و به '5 آن توالی جایگاه برش با آنزیم XhoI اضافه شد. توالیهای اختصاصی برش با NcoI و XhoI در جایگاه کلونینگ وکتور وجود دارد. واکنش PCR با استفاده از آغازگرهای اختصاصی ژن SCF در 35 چرخه انجام شد (جدول 1).
بعد از الکتروفورز محصول PCR برروی ژل آگارز 2% در بافر TAE، برای حذف ترکیبات اضافی شامل پروتئینها و نوکلئوتیدها و آغازگر دایمرهای احتمالی و به دست آوردن محصول خالص واکنش PCR ، تخلیص از ژل با استفاده از کیت High Pure PCR Product Purification مطابق دستورالعمل شرکت سازنده(آلمان، رُوش) انجام شد. کمیت و کیفیت DNA استخراج شده با دستگاه اسپکتروفتومتری نانودراپ مورد ارزیابی قرار گرفت.
همسانهسازی توالی رمزکننده SCF :
یک کلونی از پلیت کشت باکتری Ecoli DH5α دارای وکتور pET-32 (حامل ژن مقاومت به آنتیبیوتیک آمپیسیلین) انتخاب و در محیط LB حاوی آنتیبیوتیک آمپیسیلین به غلظت نهایی 100 میکروگرم در میلیلیتر کشت داده شد. استخراج پلاسمید با استفاده از کیت (ایران، یکتـا تجهیز عظما) به روش Miniprep انجام شد. کمیت و کیفیت پلاسمید استخراج شده با دستگاه اسپکتروفتومتری نانودراپ سنجیده شد. به منظور همسانهسازی قطعه ژنی رمزکننده فاکتور سلول بنیادی در وکتور pET-32a ، که در مرحله قبل با استفاده از PCR و آغازگرهای اختصاصی تکثیر شده بود و با توجه به وجود جایگاههای برش اختصاصی با آنزیمهای محدودکننده XhoI و NcoI در انتهای '5 این دو آغازگر، وکتور و قطعه هدف هر دو تحت اثر این دو آنزیم برش داده شدند .وکتور و قطعه ژنی برش خورده پس از تخلیص و تعیین غلظت، به نسبت مولی 1:4 به وسیله آنزیم T4 DNA ligase به هم متصل شدند. بعد از آمادهسازی سلولهای E. coli TOP10 جهت پذیرش پلاسمید، تراریختی سلولهای مستعد(competent cells) انجام شد. جهت انتخاب کلونیهای حاوی وکتور نوترکیب از آنتیبیوتیک آمپیسیلین( µg/mL100) استفاده شد و صحت انجام کلونینگ به وسیله colony-PCR،Digestion pattern و sequencing تأیید شد.
پس از تعیین توالی، 13 کدون نادر مربوط به پروتئین یوکاریوتی به وسیله نرمافزار Rare Codon Analysis یافت شد. سپس باکتری Rosetta دارای ژن مقاومت به آنتیبیوتیک کلرامفنیکل در محیط LB (Lysogeny broth) حاوی این آنتیبیوتیک کشت داده و به مدت 18 ساعت در دمای 37 درجه سانتیگراد در انکوباتور شیکردار گرماگذاری شد. پس از تهیه سلولهای مستعد برای پذیرش وکتور نوترکیب و تراریختی آنها، باکتریهای تراریخته بر روی محیط کشت انتخابی شامل آنتیبیوتیکهای کلرامفنیکل (که ژن مقامت به آن در Rosetta وجود دارد) و هم چنین آمپیسیلین(که ژن مقامت به آن بر روی وکتور نوترکیب pET32-SCF قرار دارد)، رشد کرده و کلونی تشکیل دادند که نشاندهنده ورود وکتور نوترکیب به سلولهای باکتری بود.
بیان پروتئین نوترکیب فاکتور سلول بنیادی:
یک کلونی از باکتری Rosetta تراریخته حاوی وکتور نوترکیب در محیط LB حاوی 100 میکروگرم در میلیلیتر آنتیبیوتیک آمپیسیلین و 34 میکروگرم در میلیلیتر آنتیبیوتیک کلرامفنیکل کشت و به مدت 18 ساعت در انکوباتور با دمای 37 درجه سانتیگراد با چرخش 200 دور در دقیقه(rpm) نگهداری شد. از کشت شبانه باکتری، کشت تازه تهیه شده تا دانسیته جذب نوری(OD) رشد باکتری در طول موج 600 نانومتر به حدود 4/0 رسید. 2 میلیلیتر از سوسپانسیون کشت باکتری به عنوان کنترل قبل از القای بیان پروتئین برداشت شد. جهت القای بیان پروتئین، IPTG با غلظت نهایی یک میلیمولار اضافه شد. سپس به منظور تعیین زمان مناسب برای بیان پروتئین در فواصل 2 و 4 ساعت، 2 میلیلیتر نمونه از سوسپانسیون باکتری برداشت شد. پس از تهیه عصاره سلولی از نمونههای 2 و 4 ساعته باکتریهای القا شده، بیان پروتئین با الکتروفورز عصاره سلولهای باکتری بر روی ژل پلیآکریل امید 12% و سپس رنگآمیزی با رنگ کوماسی بلو R-250 مورد ارزیابی قرار گرفت. هم چنین در نتیجه بهینهسازی بیان پروتئین، 4 ساعت القا با IPTG زمان مناسب ارزیابی شد.
آزمایش SDS-PAGE و وسترن بلات (Western Blot) :
الکتروفورز پروتئینها با استفاده از روش SDS-PAGE در سیستم بافری ناپیوسته شامل ژل متراکمکننده و ژل جداکننده انجام شد. 20 میکرولیتر از نمونهها پس از سانتریفیوژ، همراه با شاخص وزن مولکولی به وسیله سرنگ همیلتون به چاهکهای ژل منتقل شدند. بعد از اتمام الکتروفورز به مدت 4 ساعت در اختلاف پتانسیل 150 ولت، کاست حاوی ژل باز شد و بخش بالایی ژل (متراکمکننده) جدا شد. سپس با استفاده از رنگ کوماسی به مدت 2 ساعت رنگ شده و پس از رنگزدایی با محلول رنگبری به مدت 2 ساعت روی شیکر مورد بررسی قرار گرفت.
برای تأیید اختصاصیت پروتئین نوترکیب، آزمایش وسترن بلات طبق روش استاندارد انجام شد. به طور خلاصه پس از الکتروفورز پروتئین بر روی ژل پلیآکریلآمید به روش SDS-PAGE ، عمل انتقال باندهای تفکیک شده پروتئینها به غشای PVDF (رُوش، آلمان) با روش الکتروبلاتینگ نیمه خشک انجام شد. برای کنترل انتقال پروتئین از رنگ پانسواس استفاده شد. مسدود سازی غشای PVDF با محلول شیرخشک بدون چربی(skim milk) 5% در PBS انجام گرفت و پس از شستشو با PBS در محلول آنتیبادی مونوکلونال His-Tag Antiمتصل به HRP (سیتومتین ژن، ایران) با رقت 1:1000 به مدت 2 ساعت قرار گرفت. شستشو با بافر PBS حاوی 05/0% توئین 20 به منظور حذف اتصالات غیر اختصاصی آنتیبادیها و کاهش پس زمینه غیر اختصاصی انجام شد. غشاء پس از شستشو با محلول سوبسترای رنگزای دی-آمینوبنزیدین (DAB) به مدت یک دقیقه مجاور شده و باندهای مربوطه پس از ظهور، عکس برداری گردید.
یافتهها
جداسازی توالی رمزکننده فاکتور سلول بنیادی از سلول Hela :
پس از استخراج RNA از سلولهای Hela و ساخت cDNA و به دنبال آن PCR با آغازگرهای اختصاصی بتا اکتین، مشاهده باند 190 جفت بازی در نتیجه الکتروفورز محصول واکنش تکثیر ژن بتااکتین بر روی ژل آگارز 2 درصد در بافر TAE نشاندهنده کیفیت cDNA ساخته شده میباشد(شکل 1ـ الف)
در نتیجه واکنش PCR و الکتروفورز بر روی ژل آگارز 2%، وجود یک باند 221 جفت بازی محصول تکثیر نواحی داخلی ژن SCF با استفاده از آغازگرهای داخلی نشان داده کـه سلولهـای اپیتلیالی Hela منبع مناسبی برای جداسازی
ژن فاکتور سلول بنیادی است(شکل 1ـ ب).
بخش رمزکننده پروتئین محلول بالغ به طول 165 اسیـد آمینه از cDNA رده سلولی Hela با استفاده از آغازگرهای اختصاصی طراحی شده برای ژن مذکور به وسیله آنزیم pfu DNA polymerase که دارای قدرت تصحیح خطای همانندسازی است، به وسیله PCR تکثیر شد. مشاهده قطعهای به طول 516 جفت باز به عنوان محصول نهایی PCR پس از الکتروفورز بر روی ژل آگارز 2% ، جداسازی توالی رمزکننده SCF محلول را تأیید کرد(شکل 2).
همسانهسازی توالی رمزکننده فاکتور سلول بنیادی در وکتور pET32 :
توالی رمزکننده SCF پس از برش با آنزیمهای محدودالاثر اختصاصی به درون وکتور pET-32a ، کلون شد و به درون باکتری E.coli TOP10 انتقال یافت و کلونهای باکتری با رشد در محیط حاوی آنتیبیوتیک آمپیسیلین و کلرامفنیکل غربالگری شد.

شکل1: الکتروفورز محصول PCR بر روی ژل آگارز 2% در بافر TAE ؛ الف: در ستون اول شاخص اندازه مولکولی 100 جفت بازی، در ستون دوم و سوم باند 190 جفتبازی محصول تکثیر ژن خانهداری بتااکتین با آغازگرهای اختصاصی به عنوان کنترل نشان داده شده است. ب: در ستون اول شاخص اندازه مولکولی 100 جفت بازی، در ستون دوم و سوم باند 221 جفت بازی حاصل تکثیر بخشی از توالی SCF با آغازگرهای داخلی اختصاصی نشان داده شده است.

|
شکل 2: الکتروفورز محصول PCR توالی رمزکننده فاکتور سلول بنیادی بر روی ژل آگارز 2% در بافر TAE؛ در ستون اول شاخص اندازه مولکولی 100 جفت بازی و در ستون دوم باند 516 جفت بازی محصول تکثیر توالی رمزکننده SCF به وسیله آنزیم pfu DNA polymerase و در حضور آغازگرهای اختصاصی با پیکان نشان داده شده است.
|
در نتیجه الکتروفورز پلاسمیدهای نوترکیب pET32a-SCF استخراج شده از کلونیهای مثبت در کنار پلاسمید pET-32a به عنوان شاخص، پلاسمیدهای نوترکیب با نشان دادن تأخیر در حرکت بر روی ژل آگارز 5/1% از لحاظ وجود قطعه همسانهسازی شده، مثبت ارزیابی شدند(شکل3 - الف). به منظور بررسی صحت همسانهسازی ژن هدف در حامل pET-32a از روش تعیین الگوی هضم آنزیمی استفاده شد. بعد از هضم پلاسمید نوترکیب pET32a-SCF استخراج شده از یک کلونی مثبت با دو آنزیم محدودکننده NcoI و XhoI و الکتروفورز بر روی ژل آگارز 1%، دو باند مجزا مربوط به پلاسمید خطی به طول 9/5 کیلو باز و قطعه هدف به طول 516 جفت باز به دست آمد. مقایسه اندازه قطعات حاصل از هضم آنزیمی با شاخص اندازه مولکولی 1 کیلو جفت بازی، نتیجه همسانهسازی را تأیید کرد(شکل 3 ـ ب). سپس وکتورهای نوترکیب حاوی ژن SCF با PCR جداسازی و انتخاب گردید و به منظور اطمینان از صحت توالی رمزکننده فاکتور سلول بنیادی کلون شده در وکتور نوترکیب، تعیین توالی با استفاده از آغازگرهای عمومیT7 promoter و T7 terminator انجام شد. نتایج هم ردیفی توالی SCF کلون شده با توالی ژن فاکتور سلول بنیادی موجود در بانک ژن NCBI و نیز نتایج BLAST نوکلئوتیدی توالیها، صحت همسانهسازی را تاییدکرد. مقایسه نتایج توالی یابی با توالیهای مرجع نشان داد هیچ گونه تغییر و جهشی در این قطعه ژن کلون شده روی نداده است. پس از تعیین توالی، کدونهای نادر به وسیله نرمافزار Rare Codon Analysis شامل 3 کدون AGG،AGA و CGAمربوط به آمینو اسید آرژنین، کدون CTA مربوط به آمینواسید لوسین، کدون ATA مربوط به آمینو اسید ایزولوسین و کدون CCC مربوط به آمینو اسید پرولین یافت شد. در مجموع کدونهای نادر موجود در توالی رمزکننده فاکتور سلول بنیادی کلون شده در پلاسمید pET-32 ، شامل 5 کدون نادر مربوط به آمینواسید آرژنین در موقعیت 5 و 108 (AGG)، در موقعیت 117، 121 و 151 (AGA) و در موقعیت 28، 43، 74و80، چهار کدون ATA مربوط به آمینو اسید ایزولوسین، در موقعیت 34 ، 107 و 131، سه کدون CCC مربوط به آمینواسید پرولین و هم چنین در موقعیت 96 کدون CTAمربوط به آمینو اسید لوسین یافت شد.
بیان فاکتور سلول بنیادی در میزبان بیانی Rosetta:
پس از تراریختی سلولهای باکتری Rosetta برای پذیرش وکتور نوترکیب، باکتریها بر روی محیط کشت انتخابی شامل آنتیبیوتیکهای کلرامفنیکل(که ژن مقامت به آن در Rosetta وجود دارد) و هم چنین آمپیسیلین(که ژن مقامـت بـه آن بـر روی وکتور نوترکیب pET32-SCF قرار
بیان فاکتور سلول بنیادی در میزبان بیانی Rosetta:
پس از تراریختی سلولهای باکتری Rosetta برای پذیرش وکتور نوترکیب، باکتریها بر روی محیط کشت انتخابی شامل آنتیبیوتیکهای کلرامفنیکل(که ژن مقامت به آن در Rosetta وجود دارد) و هم چنین آمپیسیلین(که ژن مقامـت بـه آن بـر روی وکتور نوترکیب pET32-SCF قرار

شکل3 : الف) الکتروفورز پلاسمید نوترکیب در مقایسه با پلاسمید pET-32 کنترل؛ الکتروفورز پلاسمید استخراج شده از کلونی مثبت(ستون 3) در کنار پلاسمید pET-32 به عنوان کنترل(ستون 2) با نشان دادن تأخیر در حرکت بر روی ژل آگارز 5/1%، نوترکیب ارزیابی شد. ستون 1 شاخص اندازه مولکولی 1 کیلوبازی است. ب) الکتروفورز محصول واکنش هضم آنزیمی وکتور نوترکیب؛ ستون 1 شاخص اندازه مولکولی 1 کیلو بازی، ستون 2 جدا شدن توالی رمزکننده SCF به طول 516 جفت باز از وکتور نوترکیب که با پیکان مشخص شده است را نشان میدهد.
دارد)، رشد کرده و کلونی تشکیل دادند که نشاندهنده ورود وکتور نوترکیب به سلولهای میزبان Rosetta بود. بعد از القاء بیان پروتئین به وسیله IPTG ، الکتروفورز پروتئینها با استفاده از روش SDS-PAGE در سیستم بافری ناپیوسته شامل ژل متراکمکننده و ژل جداکننده انجام شد.
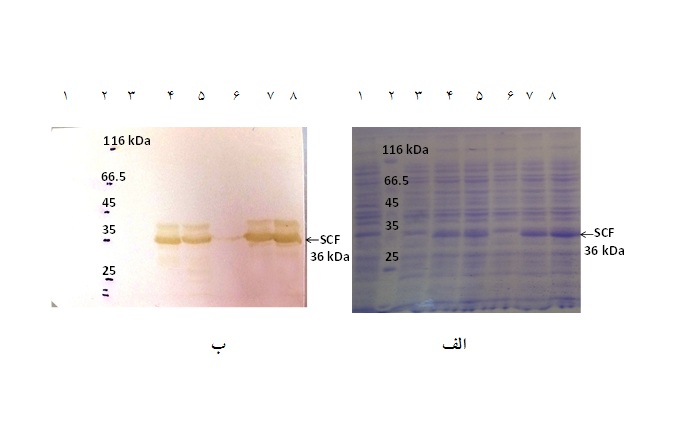
نتایج الکتروفورز ژل پلی آکریل امید، بیان یک پروتئین در محدوده میان باندهای 35 الی 45 کیلودالتونی شاخص وزن مولکولی را نشان میدهد که با وزن مولکولی حدود 36 کیلودالتون پیشبینی شده هم خوانی دارد. عدم وجود باند 36 کیلودالتون در نمونه سلولهای Rosetta خالی و باکتریهای قبل از القا با IPTG و وجود باند 36 کیلودالتون در نمونه سلولهای Rosetta دارای وکتور نوترکیب بعد از القا، تأییدکننده بیان پروتئین فاکتور سلول بنیادی در سیستم بیانی Rosetta بود. لازم به ذکر است بیان پروتئینها در مدت زمان 4 ساعت القا بهتر از مدت زمان 2 ساعت القا با IPTG ارزیابی شد(شکل4 ـ الف).
برای تایید وجود پروتئین، آزمایش وسترن بلات طبق روش استاندارد انجام شد. پس از الکتروفورز پروتئین به روش SDS-PAGE و انتقال باندهای تفکیک شده پروتئینها به غشایPVDF ، سنجش ایمنی به وسیله آنتیبادی مونوکلونال His-Tag Anti متصل به HRP انجام شد. نتایج وسترن بلات نشان میدهد برچسب هیستیدینی متصل به فاکتور سلول بنیادی نوترکیب (pET32a- SCF)، توسط آنتیبادی مونوکلونال His-Tag Antiمتصل به HRP قابل شناسائی میباشد.
مشاهده باند پروتئین نوترکیب فاکتور سلول بنیادی با 324 آمینواسید با وزن مولکولی 36 کیلو دالتون که از مجموع وزن مولکولی SCF با 165 آمینو اسید و His6-tag و trx-tag با 159 آمینواسید تشکیل شده است، نشاندهنده بیان پروتئین نوترکیب بود. مطابق انتظار، بیـان پـروتئین فاکتـور سلـول بنیـادی در سلولهای کنترل مشاهده نشد، اما همه سلولهای تراآلوده بعد از القاء با IPTG ، بیان این پروتئین را نشان داد (شکل 4 ـ ب).
نتایج الکتروفورز ژل پلی آکریل امید، بیان یک پروتئین در محدوده میان باندهای 35 الی 45 کیلودالتونی شاخص وزن مولکولی را نشان میدهد که با وزن مولکولی حدود 36 کیلودالتون پیشبینی شده هم خوانی دارد. عدم وجود باند 36 کیلودالتون در نمونه سلولهای Rosetta خالی و باکتریهای قبل از القا با IPTG و وجود باند 36 کیلودالتون در نمونه سلولهای Rosetta دارای وکتور نوترکیب بعد از القا، تأییدکننده بیان پروتئین فاکتور سلول بنیادی در سیستم بیانی Rosetta بود. لازم به ذکر است بیان پروتئینها در مدت زمان 4 ساعت القا بهتر از مدت زمان 2 ساعت القا با IPTG ارزیابی شد(شکل4 ـ الف).
برای تایید وجود پروتئین، آزمایش وسترن بلات طبق روش استاندارد انجام شد. پس از الکتروفورز پروتئین به روش SDS-PAGE و انتقال باندهای تفکیک شده پروتئینها به غشایPVDF ، سنجش ایمنی به وسیله آنتیبادی مونوکلونال His-Tag Anti متصل به HRP انجام شد. نتایج وسترن بلات نشان میدهد برچسب هیستیدینی متصل به فاکتور سلول بنیادی نوترکیب (pET32a- SCF)، توسط آنتیبادی مونوکلونال His-Tag Antiمتصل به HRP قابل شناسائی میباشد.
مشاهده باند پروتئین نوترکیب فاکتور سلول بنیادی با 324 آمینواسید با وزن مولکولی 36 کیلو دالتون که از مجموع وزن مولکولی SCF با 165 آمینو اسید و His6-tag و trx-tag با 159 آمینواسید تشکیل شده است، نشاندهنده بیان پروتئین نوترکیب بود. مطابق انتظار، بیـان پـروتئین فاکتـور سلـول بنیـادی در سلولهای کنترل مشاهده نشد، اما همه سلولهای تراآلوده بعد از القاء با IPTG ، بیان این پروتئین را نشان داد (شکل 4 ـ ب).

شکل 4 ـ الف: SDS-PAGE فاکتور سلول بنیادی )ژل پلیآکریل آمید 12%(؛ ستون 1 عصاره سلولی Rosetta به عنوان کنترل منفی است که عدم بیان پروتئین فاکتور سلول بنیادی را نشان میدهد. ستون 2: شاخص وزن مولکولی، ستونهای بعدی بهترتیب؛ عصاره سلولهای کلونی شماره 1 قبل از القاء(ستون 3)، 2 ساعت پس از القاء(ستون 4) و 4 ساعت بعد از القاء(ستون 5)، عصاره سلولهای کلونی شماره 2 قبل از القاء (ستون 6)، 2 ساعت پس از القاء (ستون 7) و 4 ساعت بعد از القاء(ستون 8)؛ در ستونهای 4، 5، 7 و 8 پروتئین SCF نوترکیب با وزن مولکولی حدود 36 کیلودالتون با پیکان نشان داده شده است. ب) آزمایش وسترن بلات پروتئین فاکتور سلول بنیادی؛ ستون 1: عصاره سلولهای کنترل Rosetta، ستون 2: شاخص وزن مولکولی پروتئین، ستونهای بعدی بهترتیب؛ عصاره سلولهای کلونی شماره 1 قبل از القاء (ستون 3)، 2 ساعت پس از القاء (ستون 4) و 4 ساعت بعد از القاء (ستون 5)، عصاره سلولهای کلونی شماره 2 قبل از القاء (ستون 6)، 2 ساعت پس از القاء (ستون 7) و 4 ساعت بعد از القاء (ستون 8)؛ در ستونهای 4، 5، 7 و 8 باند مربوط به پروتئین SCF با وزن مولکولی حدود 36 کیلودالتون با پیکان نشان داده شده است.
بحث
بقا و تمایز انواع متعدد سلولهای میلوئید، اریتروئید، مگاکاریوسیت، لنفاوی، سلول زایا و اجداد ملانوسیت به حضور فاکتور سلول بنیادی وابسته است. فاکتور سلول بنیادی(SCF) به طور گستردهای در تحقیقات سلولهای بنیادی و نیز در تحقیقات مربوط به بررسی روند مولکولی بیماریزایی سرطانهایی از جمله لوسمی حاد و مزمن میلوبلاستی، نوروبلاستوما، سرطان تخمدان و پروستات و لنفوما، هم چنین در مطالعههای مهاجرت سلولهای بنیادی سرطانی و مطالعههای مولکولی در انواع کم خونیها و حتـی ایجاد روشهای درمانی جدید استفاده میشود. نقش بارز پروتئین فاکتور سلول بنیادی درکشت و توسعه سلولهای بنیادی خونساز و جنینی، اهمیت مطالعه و تولید فاکتور سلول بنیادی(SCF) را نشان میدهد.
در تحقیق حاضر ابتدا از سلولهای Hela کشت داده شده در آزمایشگاه، RNA کل استخراج شد و پس از ساخت cDNA ، ژن کدکننده فاکتور سلول بنیادی به طول 516 جفت باز تکثیر گردید. قطعه ژنی هدف به حامل مناسب منتقل و صحت کلونسازی و ایجاد حامل نوترکیب با استفاده از روشهای PCR ، الگوی هضم توسط آنزیمهای محدودکننده و توالییابی تایید شد. در مرحله بعد ژن رمزکننده فاکتور سلول بنیادی در میزبان بیانی Rosetta تولید شد. بیان پروتئین حاصل متصل به بر چسب هیستیدینی و trx ، از نظر وزن مولکولی(36 کیلو دالتون) تایید شد. هم چنین ماهیت پروتئین بیان شده به عنوان فاکتور سلول بنیادی به روش لکهگذاری وسترن و با استفاده از آنتیبادیهای مونوکلونال His-Tag Anti متصل به آنزیم HRP تایید شد.
ژن کدکننده فاکتور سلول بنیادی با منشا انسانی دارای 13 کدون نادر(rare codon) است، در مطالعه حاضر از میزبان بیانی Rosetta برای بیان پروتئین نوترکیب فاکتور سلول بنیادی انسانی استفاده شد. این میزبان ضمن این که تمامی مزایای یک سیستم بیانی پروکاریوتی مانند تولید مقادیر زیادی از پروتئین با هزینه نسبتاً کمتر نسبت به سایر سیستمهای بیانی را دارد، امکان افزایش میزان تولید محصول را نیز فراهم میکند. میزبان بیانی Rosetta یک سویه مهندسی شده است که امکان تولید پروتئینهای یوکاریوتی با کدونهای نادر مثل AGG ، AGA ، AUA ، CUA ، CCC و GGA وجود دارد. بنابراین مشکل تولید فاکتور سلول بنیادی با کدونهای نادر نیز مرتفع شده و نیازی به بهینهسازی توالی و سنتز ژن با کدونهای متناسب با سیستم بیانی پروکاریوتی وجود ندارد.
در تحقیق حاضر ابتدا از سلولهای Hela کشت داده شده در آزمایشگاه، RNA کل استخراج شد و پس از ساخت cDNA ، ژن کدکننده فاکتور سلول بنیادی به طول 516 جفت باز تکثیر گردید. قطعه ژنی هدف به حامل مناسب منتقل و صحت کلون سازی و ایجاد حامل نوترکیب با استفاده از روشهای PCR ، الگوی هضم توسط آنزیمهای محدود کننده و توالییابی تایید شد. در مرحله بعد ژن رمزکننده فاکتور سلول بنیادی در سلولهای Rosetta بیان گردید. بیان پروتئین حاصل متصل به برچسب هیستیدینی و trx ، از نظر وزن مولکولی (36 کیلو دالتون) تایید شد. هم چنین ماهیت پروتئین بیان شده به عنوان فاکتور سلول بنیادی به روش لکهگذاری وسترن و با استفاده از آنتیبادیهای مونوکلونـال His-Tag Anti متصـل
به آنزیم HRP تایید شد.
هن و همکاران در سال 2003 فاکتور سلول بنیادی نوترکیب انسانی را با استفاده از سیستم بیانی یوکاریوتی در سلولهای حشره تولید کردند. به این منظور توالی رمزکننده فاکتور سلول بنیادی محلول(165 آمینواسید) را به فرم کوتاه شده آن (145 آمینواسید) به وسیله یک لینکر 12 آمینو اسیدی متصل کرده، در وکتور pAcSecG2T همسانهسازی نموده و در سیستم بیانی باکلوویروس بیان کردند. این سیستم از نظر هزینه و زمان نسبت به سیستم بیانی پروکاریوتی پرهزینهتر و زمانبر است(24).
در سال 2013 عسگری و همکاران فاکتور سلول بنیادی محلول را در وکتور pET-26b همسانهسازی کردند. اما گزارشی از بیان و تخلیص این پروتئین ارائه نکردند(25).
در سال 2013 فرهادی و همکاران فاکتور سلول بنیادی محلول را با استفاده از یک شاتل وکتور(مورد استفاده در سیستم بیانی پروکاریوتی و هم یوکاریوتی) به نام pPIC9 در سیستم بیانی یوکاریوتی مخمر Picha pastoris همسانهسازی و بیان کردند. این سیستم نیز از نظر هزینه نسبت به سیستم بیانی پروکاریوتی معمولاً در اولویت انتخاب قرار نمیگیرد(26).
لو و همکاران در سال 2005، ابتدا توالی رمز کننده فاکتور سلول بنیادی نوترکیب انسانی را به صورت دایمر (که کدکننده 165 آمینواسید بود)(rdhSCF) تکثیر کرده، به فرم کوتاه شده آن(145 آمینواسید) به وسیله یک لینکر 12 آمینواسیدی متصل نموده و در وکتور pET-22b همسانهسازی کردند و سپس در سیستم بیانیEcoli BL21 بیان نمودند(27).
در سال 2015، آکوتا و همکاران فاکتور سلول بنیادی محلول را با استفاده از وکتور pET-3b همسانهسازی کرده و در میزبان بیانیEcoli BL21 تولید کردند(28).
در سال 2016، یوادا و همکاران بیان و تخلیص فاکتور سلول بنیادی محلول نوترکیب انسانی را در میزبان بیانیEcoli BL21 عاری از اندوتوکسین به وسیله مخلوط کردن سولفید با پرسولفید بهبود بخشیدند. آنها نشان دادند که بیان هم زمان پروتئین با تیوردوکسین، تولید فاکتور سلـول بنیـادی نوترکیب انسانی به شکل محلول را افزایش
میدهد(29).
در این مطالعه پروتئین SCF نوترکیب انسانی در اتصال با برچسب هیستیدینی و trx ، در سویه Rosetta که به صورت مهندسی شده میتواند کدونهای نادر مربوط به پروتئینهای یوکاریوتی را پشتیبانی کند، تولید شد.
نتیجهگیری
حاصل این مطالعه جداسازی موفقیتآمیز توالی رمزکننده فاکتور سلول بنیادی(SCF) از سلولهای Hela و همسانهسازی در وکتور بیانی pET-32aبود که به دنبال آن پروتئین نوترکیب در میزبان بیانی Rosettaبیان شد. در این سیستم بیانی امکان تولید پروتئینهای یوکاریوتی با کدونهای نادر مثل AGG ،AGA ،AUA ، CUA ، CCC
و GGA وجود دارد بنابراین به میزان بالایی پروتئین فاکتور سلول بنیادی تولید شد.
تشکر و قدردانی
این مقاله حاصل پایان نامه دانشجویی دوره کارشناسی ارشد رشته بیوتکنولوژی پزشکی مرکز تحقیقات مؤسسه عالی آموزشی و پژوهشی طب انتقال خون میباشد. بودجه این تحقیق توسط مؤسسه عالی آموزشی و پژوهشی طب انتقال خون تأمین گردیده و همه مراحل عملی پروژه در مرکز تحقیقات سازمان انتقال خون ایران انجام شده است.
نوع مطالعه: پژوهشي |
موضوع مقاله:
بيوتكنولوژي
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |





