جلد 13، شماره 3 - ( پاييز 1395 )
جلد 13 شماره 3 صفحات 242-233 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Khalilzadeh S, Vatandoost J. The efficiency of secretion and γ-carboxylation of recombinant human factor IX in stable drosophila cells. Sci J Iran Blood Transfus Organ 2016; 13 (3) :233-242
URL: http://bloodjournal.ir/article-1-1004-fa.html
URL: http://bloodjournal.ir/article-1-1004-fa.html
خلیل زاده سمیرا، وطن دوست جعفر. کارآیی ترشح و گاماکربوکسیلاسیون فاکتور IX نوترکیب انسانی در سلولهای پایدار دروزوفیلا. فصلنامه پژوهشی خون. 1395; 13 (3) :233-242
سبزوار ـ ایران
متن کامل [PDF 619 kb]
(1371 دریافت)
| چکیده (HTML) (5858 مشاهده)
مقدمه
یکی از مشخصترین تغییرات پس از ترجمه در پروتئینهای وابسته به ویتامین K ( Vitamin K-dependent, VKD)، گاماکربوکسیلاسیون ناحیه غنی از اسیدآمینههای گلوتامات (Glu) و تبدیل آنها به گاما کربوکسی گلوتامات یا گلا (Gla) میباشد(1). ایجاد این رزیدوهای گاماکربوکسی گلوتامیک اسید، برعهده آنزیم گاما کربوکسیلاز است. تا پیش از این اعتقاد بر این بود که این آنزیم تنها در سیستمهای بیانی پستاندارن وجود دارد و سلولهای حشرات از جمله سلولهای S2 دروزوفیلایی، فاقد فعالیت گاما کربوکسیلازی هستند و یا آنزیم گاما کربوکسیلاز قابلیت شناسایی پروپپتید پروتئینهای VKD را ندارد. بررسیهای بعدی نشان داد که آنزیم گاما کربوکسیلاز علاوه بر مهره داران، در دو بیمهره دروزوفیلا ملانوگاستر و نوعی حلزون Molluscs متعلق به جنس Conus نیز وجود دارد(4-2).
یک تفاوت اصلی بین آنزیم دروزوفیلایی و انسانی این است که از انتهای کربوکسی، 86 اسید آمینه کمتر از آنزیم انسانی دارد اما حذف آن اثری بر فعالیت آنزیم انسانی ندارد. هر چند سوبستراهای طبیعی آنزیم گاما کربوکسیلاز دروزوفیلایی تاکنون مشخص نشده است اما این آنزیم میتواند پروپپتید فاکتور IX و پروترومبین انسانی را به عنوان سوبسترا شناسایی و ناحیه گلای آنها را کربوکسیله کند. حتی آنزیم گاماکربوکسیلاز دروزوفیلایی در شرایط in vitro دارای تمایل بالاتری برای شناسایی سوبستراهای واجد پروپپتید فاکتور IX و پروترومبین نسبت به حالت بدون پروپپتید است(5). از طرفی نشان داده شده است که در شرایط و مقادیر یکسان، محصول کربوکسیله به دست آمده از آنزیم گاما کربوکسیلاز دروزوفیلا (dγC) حدود 5 برابر آنزیم گاما کربوکسیلاز انسانی(hγC) است(5). لذا به نظر میرسد گاما کربوکسیلاز از نظر خواص و مکانیسم کربوکسیلازی در مهرهداران و بیمهرهها مشابه است و هر دو قادرند که سوبستراهای همدیگر را کربوکسیله کنند. هم چنین موتاسیون F16A باعث حذف کربوکسیلاسیون (کاهش 90٪) به وسیله هر دو آنزیم کربوکسیلاز دروزوفیلا و انسانی میشود(5). انتظار میرود سامانه بیانی S2 از کارآیی بالایی برای کربوکسیلاسیون، ترشح و بازیافت فاکتورهای خونی وابسته به ویتامین K برخوردار باشد. هدف از انجام این مطالعه، بررسی توانایی و کارآیی گاما کربوکسیلاسیون فاکتور IX انعقادی در سلولهای 2S نسبت به سیستمهای بیانی پستانداران بود.
مواد و روشها
سوش باکتری، پلاسمیدها، سلولهای S2 :
در یک مطالعه تجربی، سوش DH5α باکتری E.coli (استراتژن - آمریکا) برای مراحل کلونینگ استفاده شد. کتابخانه cDNA کبدی برای جداسازی cDNAانسانی از شرکت MRC (انگلستان) خریداری گردید. پلاسمیدهای pMT-V5-HisA ، pCoHygro و سلولهای دروزوفیلایی اشنایدر 2 (S2) از شرکت اینویتروژن(آمریکا) تهیه گردید.
محیط کشت، آنزیمها، مواد شیمیایی و کیتها:
محیط کشت LB (Luria-Bertani) به عنوان محیط کشت باکتری استفاده شد و آمپیسیلین(µg/mL 100 محیط کشت) در صورت نیاز به وجود محیط کشت انتخابی استفاده شد. محیط کشت دروزوفیلایی (Schneider's Drosophila Medium)، پنیسیلین G ، استرپتومایسین، هایگرومایسین و میتومایسین از شرکت سیگما (آلمان) خریداری گردید. اولیگونوکلئوتیدها به وسیله شرکت بیونر (کره) ساخته شدند. همه آنزیمهای مورد استفاده در هضم برشی و PCR و هم چنین کیتهای تخلیص PCR ، تخلیص پلاسمید و تهیه RNA از شرکت رُوش(آلمان) خریداری شد. کیت InsT/Aclone از شرکت فرمنتاز، کیت الایزای مخصوص فاکتور IX و مواد مربوط به آزمون انعقاد یک مرحلهای از شرکت دیاگنوستیک(فرانسه) فراهم گردید. ویتامین K برای القا نیز از شرکت رُوش(آلمان) تهیه شد. هم چنین مارکر DNA و مارکر پروتئین از فرمنتاز خریداری گردید.
ساخت سازههای بیانی:
به منظور ساخت پلاسمید بیانکننده فاکتور IX انسانی که به صورت اختصاصی در سلولهای دروزوفیلا بیان گردد، از پلاسمید pMT-V5-His A با طول 3538 جفت باز استفاده شد. برای انتقال cDNA فاکتور IX به داخل این وکتور بیانی لازم بود که جایگاههای برشی مناسب در دو انتهایcDNA قرار داده شود. لذا با استفاده از دو آغازگر hFIX-KpnI (5'GGG GTAC/ CGC CAC CAT GCA GCG CGT GAAC 3') و hFIX-XhoI (5'CCGC/ TCG AGA TCC ATC TTT CAT TAA GTG AGC3')، cDNA فاکتور IX با انتهاهای دلخواه از کتابخانه cDNA کبد، pfu-PCR گردید. محصول cDNA به دست آمده بعد از استخراج از ژل و آدنیله کردن، در T- وکتور کلون شد. به دنبال واکنش الحاق محصول PCR به T- وکتور، سلولهای پذیرای DH5α با پلاسمید نوترکیب ترانسفورم شدند. بعد از استخراج و برش پلاسمید حاصله(T.V-hFIX) با آنزیمهای XhoI و KpnI، خروج cDNAفاکتور IX ، تخلیص از ژل و هم چنین برش پلاسمیدpMT-V5-His A با آنزیمهای XhoI و KpnI ، عمل اتصال بینcDNA و پلاسمید pMT-V5-His A صورت گرفت که منجر به ساخت پلاسمید pMT-hFIX گردید.
کشت سلول و تراآلایی:
کشت سلولهای S2 در محیط کشت اختصاصی آن با تراکم 1 تا 2 میلیون سلول به ازای هر میلیلیتر از محیط کشت انجام شد. سلولها در دمای 28 درجه سانتیگراد و بدون CO2 قرار داده شدند و هر چهار الی پنج روز، پاساژ داده میشد. تراآلایی سلولهای S2 با روش کلسیم فسفات انجام شد. 24 ساعت قبل از تراآلایی، 3 میلیلیتر از سلولها با تراکم سلولی 106 سلول برای هر میلیلیتر به ظرف کشت 6 خانهای منتقل و به مدت 24 ساعت در دمای 8 درجه سانتیگراد در انکوباتور قرار داده شد. قبل از تراآلایی، 300 میکرولیتر از مخلوط تراآلایی شامل 36 میکرولیتر از CaCl2 دو مولار، 10-5 میکروگرم از DNA و آب تزریقی در یک لوله استریل فراهم شد. سپس یک حجم از این مخلوط با یک حجم از HEPES 2x قطره قطره خوب مخلوط و تا 20 دقیقه در دمای آزمایشگاه قرار داده شد. به ازای هر 1 میلیلیتر از محیط کشت، 2/0 میلیلیتر از مخلوط تراآلایی به محیط کشت سلولی اضافه شد و به آرامی حرکت داده تا خوب مخلوط شود. پس از انجام تراآلایی سلول ها به مدت 16-6 ساعت در دمای 28 درجه سانتیگراد انکوبه و پس از آن محیط سلولها با محیط تازه و گرم تعویض شد.
تهیه کلونهای پایدار:
برای دستیابی به رده سلولی پایدار از سلولهای S2 ، پلاسمید مورد نظر همراه با پلاسمید انتخابی pCoHygro که ژن مقاومت به هایگرومایسین را دارد تراآلایی شد. به منظور انتخاب سلولهای نوترکیب، 48 ساعت پس از تراآلایی، هایگرومایسین با غلظت μg/mL 300 به محیط کشت سلولها افزوده شد. 10-7 روز پس از تیمار با هایگرومایسین در سلولهای تراآلوده شده، کلنیهای مقاوم از طریق استفاده از میتومایسین جدا شدند. در این روش حدود 150 میلیون سلول عادی تراآلوده نشده به مدت 4 ساعت در مجاورت با میتومایسین قرار داده شدند. میتومایسین به طور کوالانتی به DNA متصل شده و از تکثیر آن جلوگیری میکند هر چند که سلولها زنده میمانند(7، 6). پس از سانتریفوژ و شستشو باPBS (Phosphate buffered Saline)، این سلولها با تراکم cell/mL 106 * 3 در پلیتهای 24 خانه منتقل شدند. از طرفی سلولهای تراآلوده شده مخلوط سلولی پایدار به گونهای رقیقسازی شدند که در هر 100 میکرولیتر، به طور میانگین تنها یک سلول وجود داشته باشد. این مقدار به سلولهای عادی تراآلوده نشده و تیمار شده با میتومایسین در پلیت 24 خانه اضافه میشوند. بعد از 2 هفته از کشت سلولها در محیط واجد هایگرومایسین، سلولهای پایدار که از یک کلون رشد کردهاند از نظر بیان و فعالیت فاکتور IX بررسی و به پلیت 12 و 6 خانه منتقل شدند.
ارزیابی بیان و فعالیت فاکتور IX نوترکیب:
به منظور بررسی وجود فاکتور IX در محیط کشت سلولهای تراآلوده شده، محیط کشت سلولها در روزهای اول، دوم و سوم پس از افزودن ویتامین K1 (µg/mL 500) و القا با سولفات مس(µg/mL 500)، جمعآوری شد و پس از سانتریفوژ، محلول رویی در 20- درجه سانتیگراد فریز گردید. آنتیژن فاکتور IX نوترکیب انسانی بیان شده در محیط کشت سلولهای تراآلوده شده با روش ساندویچی الایزا بر روی میکروپلیتها که با آنتیبادیهای پلیکلونال ضد فاکتور IX که در کیت الایزا مهیا شده بود، آشکار شد. برای بررسی فعالیت بیولوژیکی فاکتور IX در محیط کشت، از آزمایش aPTTاستفاده گردید. برای تعیین فعالیت بیولوژیک فاکتور IX بیان شده توسط سلولهای تراآلوده شده، 100 میکرولیتر از محیط کشت جمعآوری شده از هر نمونه با 100 میکرولیتر از پلاسمای فاقد فاکتور IX و 100 میکرولیتر از PTT فعال شده مخلوط و دقیقاً 3 دقیقه در درجه حرارت 37 درجه سانتیگراد قرار داده شد. سپس 100 میکرولیتر کلسیم کلرید mM 25 از قبل گرم شده در 37 درجه سانتیگراد به آن اضافه و زمان انعقاد اندازهگیری گردید. فعالیت انعقادی هر نمونه بر اساس نمودار استاندارد تعیین شد. منحنی استاندارد انعقاد با استفاده از رسم زمان انعقاد علیه فعالیت انعقادی رقتهای مختلف از پلاسمای طبیعی سیتراته روی نمودار log-log ترسیم شد.
رسوبدهی پروتئینهای محیط کشت به وسیله باریوم سیترات:
برای بررسی کربوکسیلاسیون فاکتور IX در سلولهای S2 ، از روش جذب پروتئینهای وابسته به ویتامین K کربوکسیله به نمک باریوم سیترات استفاده شد. در این روش به محیط کشت سلولی 4/0% سدیم سیترات و 5% باریوم کلراید اضافه شد و به مدت یک ساعت در 4 درجه سانتیگراد بر روی شیکر قرار داده شد. بعد از سانتریفوژ، رسوب و محلول رویی به ترتیب برای بررسی فاکتور IX جذب شده و جذب نشده نگهداری شد. رسوب حاصل با mM 5 کلرید باریوم سرد شستشو داده شد و سانتریفوژ گردید. نهایتاً رسوب در M 1/0 سدیم سیترات و 10% آمونیوم سولفات حل گردید. بعد از سانتریفوژ، محلول نهایی برای بررسی فاکتور IX کربوکسیله در 20- درجه سانتیگراد نگهداری شد. برای بررسی درصد بازیافت فاکتور IX نسبت به مقدار اولیه، مقدار فاکتور IX قبل و بعد از رسوب به وسیله الایزا اندازهگیری شد.
آنالیز آماری:
همه آزمایشها در سه تکرار انجام شد و مقایسه میانگینها با استفاده از آنالیز واریانس(ANOVA) و آزمون دانکن در سطح 5% انجام شد.
یافتهها
ساخت سازههای بیانی:
بعد از کلونینگ cDNA فاکتور IX در T- وکتور و ساب کلونینگ آن در وکتور pMT-V5-His A ، پلاسمید نوترکیب pMT-hFIX ایجاد شد. پلاسمید نوترکیب حاصل به شکل سوپرکویل سنگینتر از pMT-V5-His A حرکت میکند که مؤید کلون شدن قطعه مذکور درpMT-V5-His A است.
صحت کلون شدن قطعه مذکور با استفاده از برش پلاسمید pMT-hFIX با آنزیمهای DraI وHind III نیز تایید شد(نمودار 1). برای بررسی عدم وجود جهش در فاکتور IX کلون شده در pMT-V5-His A ، این پلاسمید با استفاده از یک جفت آغازگر عمومی T7 promoter و BGH-r از داخل وکتور تعیین توالی گردید. بررسی توالی نشاندهنده صحت کلونینگ و عدم وجود جهش در فاکتور IX بود.

نمودار 1: تایید کلون شدن قطعه cDNA فاکتور IX با استفاده از برش پلاسمید pMT-hFIX با آنزیمهای DraI (ردیف 1) و Hind III (ردیف 2). الگوی حرکتی پلاسمید pMT-V5-His A (ردیف 3) و پلاسمید نوترکیب pMT-hFIX (ردیف 4). M : مارکر Kb1.
بررسی بیان فاکتور IX در سلولهای S2-hFIX :
برای ارزیابی بیان دایم فاکتور IX در سلولهای S2-hFIX ، محیط کشت و همچنین لیز سلولی سلولهای پایدار و القا شده و نمونههای کنترل برای آزمون الایزا مورد استفاده قرار گرفتند. مقدار فاکتور IX ترشح شده در محیط کشت در روز اول، دوم و سوم بعد از القا با سولفات مس و اضافه کردن ویتامین K1 به ترتیب ng/mL 290 ، ng/mL 720 و ng/mL 890 بود. این در حالی است که مقدار فاکتور IX درون سلولهای S2-hFIX در تمام دوره بعد از القا در سطح حداقل و حدود ng/mL 250 بود (نمودار 2).

نمودار 2: بررسی بیان فاکتور IX پایدار در سلولهای نوترکیب S2-hFIX ، در زمانهای مختلف بعد از القا، بر اساس آزمایش الایزا بر روی نمونههای گرفته شده از محیط کشت(Media) و لیز سلولی(lys Cell).
بررسی فعالیت فاکتور IX نوترکیب در سلولهای S2-hFIX:
فعالیت انعقادی فاکتور IX در محیط سلولهای پایدار S2-hFIX در مقایسه با کنترل در زمانهای 24، 48 و 72 ساعت پس از القا با سولفات مس و افزودن ویتامین K1 ، بررسی گردید.
میانگین فعالیت انعقادی فاکتور IX ترشح شده از سلولهای S2-hFIX در روز اول، دوم و سوم به ترتیب mU/mL 90 ، mU/mL 109 و mU/mL 153 بود (جدول 1). همان طور که در نمودار 3 مشاهده میشود، بیشترین فعالیت بیولوژیک در 72 ساعت بعد از القای سلولهای پایدار مشاهده گردید. فعالیت در هر دو حالت کنترل در سلولهای ترانسفکت نشده صفر و در سلولهای پایدار القا نشده حدود mU/mL 5 میباشد.
جدول 1: مقادیر میانگین فعالیت انعقادی فاکتور IX در دو گروه کنترل و مترشحه از سلولهای نوترکیب پایدار S2-hFIX


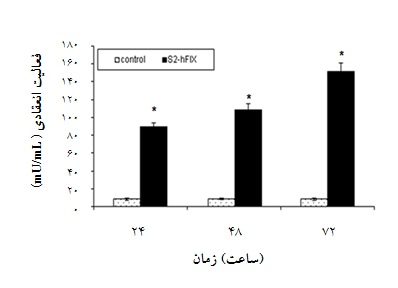
نمودار 3: مقایسه فعالیت انعقادی فاکتور مترشحه از سلولهای نوترکیب پایدار S2-hFIX با سلولهای S2 پایدار القا نشده به عنوان نمونه کنترل(کنترل)، در زمانهای مختلف بعد از القا. ستارهها نشاندهنده معناداری نمونهها در مقایسه با کنترل با استفاده از آنالیز واریانس است(05/0 p<).
رسوب فاکتور IX :
قبل و بعد از تیمار محیط کشت سلولهای پایدار S2 تولیدکننده فاکتور IX با نمک باریوم سیترات، الگوی حرکتی فاکتور IX ترشح شده در مقایسه با فاکتور IX استاندارد تخلیص شده از پلاسمای نرمال(µg 1 در چاهک) در SDS-PAGE بررسی شد. همان طور که از نمودار 4 مشخص است، این روش برای جذب پروتئینهای کربوکسیله کارا بود. هم چنین نتایج نشان داد فاکتور IX مترشحه از سلولهای نوترکیب به عنوان یک پروتئین کربوکسیله توسط سیترات باریوم جذب و از سایر پروتئینهای محیط کشت جدا شد.
مقدار فاکتور IX بازیابی شده از رسوب سیترات باریوم که با الایزا تایید شد، نشان داد که در زمانهای 24، 48 و 72، درصد بازیافت فاکتور IX به ترتیب 29، 31 و 45 درصد است. بر اساس این نتایج حدود نیمی از فاکتور IX بیان شده به وسیله سلولهای S2-hFIX رسوب نگردید.

نمودار 4: الگوی حرکتی فاکتور IX ترشح شده از سلولهای نوترکیب S2-hFIX در SDS-PAGE قبل(3) و بعد از رسوب(2). ردیف 1 فاکتور IX استاندارد. M : مارکر.

نمودار 5 : کارآیی ترشح فاکتور IX در سلولهای S2
کارآیی ترشح:
کارآیی ترشح یک پروتئین با نسبت بخش ترشح شده و
مقدار کلی بیان شده آن پروتئین تعریف میشود(8). بر اساس این تعریف، کارآیی ترشح فاکتور IX در سلولهای S2 در روزهای اول، دوم و سوم بعد از القا به ترتیب 53 ، 74 و 78 درصد بود(نمودار 5). این بدان معناست که فاکتور IX به دام افتاده در داخل سلول در طول دوره کشت سلولی آزاد میشود.
بحث
با توجه به مشکلات سلولهای پستانداران از جمله آهستگی رشد، پایین بودن بقای سلولی و ناپایداری آنها، سامانههای بیانی حشرات و به ویژه سلولهای دروزوفیلایی S2 میتوانند جایگزین مناسبی برای تولید پروتئینهای نوترکیب در سطح بالا باشند. یکی از مزایای اصلی این سامانه در مقایسه با سیستمهای پروکاریوتی، توانایی آنها در تولید انبوه پروتئینهای یوکاریوتی است که نیاز به تغییرات پس از ترجمه دارند. مزیت دیگر این سامانه، توانایی آنها در تولید پروتئینها در مقیاس وسیع و در زمانی نسبتاً کوتاه(برخلاف سیستمهای پستانداران) است (9). هم چنین از آن جایی که تراکم ردههای سلولی حشرات نسبت به سلولهای پستانداران بیشتر است، به همین منظور حجم کوچکی از محیط کشت هم برای رشد آنها کافی به نظر میرسد(10).
از مزایای قابل توجه سامانه بیانی S2 میتوان به قدرت بیان بیشتر نسبت به سلولهای حشرات دیگر از قبیل Sf9 (10 تا 20 برابر)، تغییرات بعد از ترجمه یوکاریوتی از جمله گاما کربوکسیلاسیون، عدم لیز سلولها، عدم تداخل و میانکنش بین پروتئین بیانی با پروتئینهای رده سلولی، زمان کوتاه تهیه رده سلولی پایدار(حدود 2-3 هفته)، رشد با دانسیته بالا، رشد در دمای اتاق و عدم نیاز به CO2 اشاره کرد(14-11، 9، 5، 2).
سلولهای S2 نسبت به سایر ردههای سلولی حشرات و سلولهای پستانداران در برابر تغییرات pH ، دما، اکسیـژن و اسمولالیته مقـاوم میباشند لذا ممکن است سلول S2 برای بیش از یک ماه بدون تغییر محیط، کشت شوند(15). هم چنین این سامانه بیانی یک سامانه غیرلیتیک و برپایه وکتورهای پلاسمیدی است(13). بررسیها نشان دادهاند که وکتورهای بیانی این نوع سامانه به صورت چند نسخه به داخل کروموزوم سلولهای S2 دروزوفیلا وارد میشوند و این سلولها توانایی ورود بالغ بر 100 نسخه از یک کاست بیانی را به ژنوم خود در یک رخداد تراآلایی دارند(17، 16). به این ترتیب برای تثبیت رده سلولی پایدار با سطح بیان بالا، نیاز به دوره زمانی طولانی تکثیر پلاسمید نیست (9). با توجه به مزایای زیاد این سیستم، برخلاف محصولات موجود در پستانداران و سیستمهای بیانی آنها که به طور معمول در انتها دارای گالاکتوز و اسید سیالیک میباشند، محصولات گلیکوزیلاسیونی در حشرات و سیستمهای بیانی آنها به صورت انتهایی با واحد مانوزی کم یا انتهایی با واحد مانوزی زیاد و هیبرید با انتهای N- استیل گلوکز آمین دار میباشد(18، 8).
یکی از اولین گزارشها در به کارگیری این سامانه، بیان دوپامین بتا هیدروکسیلاز (DBH) به میزان mg/L 16 در مقیاس زیاد و اینترلوکین 5 انسانی به میزان mg/L 22 در سلولهای S2 در فلاسکهای 1 لیتری بوده است(20، 19). میزان بازدهی و تولید اریتروپویتین نوترکیب انسانی نیز در سیستم بیانی S2 پس از کشت در فلاسکهای mL 500 به مقدار mg/L 18 گزارش شده است(8). هم چنین پلاسمینوژن انسانی در سلولهای S2 در فلاسکهای 1 لیتری به میزان mg/L 10 تولید شد(21). تاکنون بیان پروتئینهای نوترکیب وابسته به ویتامین K که برای فعالیت خود نیازمند کربوکسیلاسیون اسید آمینههای گلوتامیک در انتهای آمینوی خود هستند، در این سامانه صورت نگرفته است. زیرا تصور میشد سلولهای حشرات از جمله سلولهای S2 دروزوفیلایی فاقد فعالیت گاما کربوکسیلازی هستند و یا آنزیم گاما کربوکسیلاز قابلیت شناسایی پروپپتید این نوع پروتئینها را ندارد(2). به دنبال آزمایشهای باندیوپادیای در شرایط in vitro و مطالعههای قبلی ما، مشخص گردید که نه تنها سلولهای S2 برخلاف سایر حشرات واجد فعالیت گاما کربوکسیلازیاند بلکه آنزیم گاماکربوکسیلاز دروزوفیلایی 5 برابر، محصول گاماکربوکسیله بیشتری تولید میکند(12، 5). نتایج این تحقیق نیز این مطلب را تایید میکند. بررسی غلظت فاکتور IX نوترکیب ترشح شده از سلولهای S2 ، حاکی از بیان حدود mg/L 9/0 است که در مقایسه با گزارشهای بیان در سلولهای CHO و سلولهای MSCs_hAM بسیار بیشتر است(23، 22). هم چنین فعالیت بالای فاکتور IX (mU/mL 153) نشاندهنده فعالیت بالای آنزیم گاما کربوکسیلاز در دروزوفیلا نسبت به این آنزیم در پستانداران است.
چندین روش مختلف برای بررسی و تشخیص فاکتور IX نوترکیب فعال از فاکتور IX غیرفعال استفاده میشود که همه آنها برپایه تغییرات کونفورماسیونی دومین گلا میباشد(24). رسوب باریوم سیترات یکی از اولین روشهای استفاده شده است که به عنوان روش تقریباً کارآمد در جداسازی پروتئینهای کربوکسیله و فعال از جمعیت غیرفعال مورد توجه است(24). در این روش، از خاصیت پروتیئنهای وابسته به ویتامین K در جذب نمک باریوم سیترات از طریق اسیدآمینه های گاما کربوکسی گلوتامیک استفاده میشود و مولکولهایی که به طور ضعیف یا اصلاً کربوکسیله نشدهاند، نمیتوانند به وسیله یونهای باریوم جذب و رسوب گردند، بنابراین به صورت محلول در سوپرناتانت باقی میمانند.
ارزیابی کمی فاکتور IX رسوب داده شده نشان داد که حدود 45-30 درصد از فاکتور IX مترشحه از سلولهای S2 جذب و رسوب شدهاند و بنابراین به احتمال زیاد به طور کامل کربوکسیله هستند. براین اساس حدود 70-55 درصد از فاکتور IX بیان شده جذب و رسوب نگردیده که ممکن است این قسمت از فاکتور IX ساخته شده به طور جزیی یا اصلاً کربوکسیله نشده باشد. هر چند که هم فعالیت انعقادی و هم رسوب با باریوم سیترات نشان میدهد که قسمتی از فاکتور IX انسانی مترشحه از سلولهای S2 به طور صحیح گاماکربوکسیله شدهاند اما تاکنون تعریف دقیقی از کربوکسیلاسیون صحیح پروتئینهای وابسته به ویتامین K ارایه نشده است. نتایج تحقیقات و پژوهشها نشان داده است که تمام واحدهای اسیدگلوتامیک در ناحیه گلا نقش کلیدی و اساسی ندارند. فاکتور 9 دارای 12 واحد اسیدآمینه گلوتامیک در دومین گلای خود است و اسیدهای آمینه شماره 7، 8، 15، 17، 20، 21، 26، 27، 30، 33، 36 و40 ، واحدهای اسیدآمینه گلوتامیک هستند. جهش در اسیدهای آمینه گلوتامیک در موقعیتهای 7، 15، 20، 27، 33 باعث کاهش شدید در فعالیت بیولوژیک فاکتور 9 میشود، اما جهش در سایر موقعیتها تاثیر چندانی روی فعالیت بیولوژیک این فاکتور ندارد(25).
بنابراین از آن جایی که تنها 5 اسیدآمینه گلوتامیک از 12 اسیدآمینه گلوتامیک موجود در دومین گلا برای فعالیت بیولوژیک فاکتور IX کافی است، لذا به نظر میرسد که فاکتور IX که به طور ناقص کربوکسیله شده ولی واجد فعالیتاند، در سوپرناتانت وجود داشته باشد. این فرض با نتایج کارآیی ترشح نیز تایید میشود. کارآیی حدود 80 درصدی ترشح فاکتور IX به وسیله سلولهای S2 نشان میدهد که حدود 20% فاکتور IX بیان شده در داخل سلول نگه داشته میشود. لذا بسیاری از پروتئینهای فاکتور IX در محیط کشت ممکن است به طور کامل کربوکسیله نشدهاند اما بدلیل کربوکسیلاسیون حداقل 5 اسید آمینه در ناحیه گلا، قادر به ترشح شدهاند.
نتیجهگیری
دادههای این مطالعه نشان میدهد که سلولهای S2 ، فـاکتـور IX فعـال بیولوژیکـی را بیان میکنند و لذا پیشنهاد میکند که سلولهای S2 قادر به کربوکسیلاسیون فاکتور IX انسانی میباشند. در واقع فعالیت انعقادی فاکتور IX مترشحه از سلولهای S2 ، شواهد متقاعد کنندهای را فراهم میکند که سلولهای S2 دروزوفیلایی، گاما کربوکسیلاسیون لازم را که برای فعالیت انعقادی لازم اسـت انجام میدهند.
تشکر و قدردانی
بدینوسیله از معاونت پژوهشی دانشگاه حکیم سبزواری به خاطر حمایت مالی پروژه، هم چنین آقای دکتر زمردیپور(پژوهشگاه ملی مهندسی ژنتیک و زیست فناوری) و خانم دکتر Mettine Bos (مرکز پزشکی دانشگاه لیدن هلند) به دلیل در اختیار قرار دادن برخی سلولها و مواد، کمال تشکر را داریم.
متن کامل: (3216 مشاهده)
کارآیی ترشح و گاماکربوکسیلاسیون فاکتور IX نوترکیب انسانی
در سلولهای پایدار دروزوفیلا
سمیرا خلیلزاده1، جعفر وطندوست2
چکیده
سابقه و هدف
فاکتور IX طی بلوغ خود در کبد، نیازمند کربوکسیلاسیون اسیدآمینههای گلوتامیک در ناحیه گلا میباشد که در ترشح و فعالیت آن نقش دارد. با توجه به ناکارآمدی سیستم بیانی پستانداران در ترشح و گاماکربوکسیلاسیون کامل فاکتورهای انعقادی نوترکیب و فعالیت بالاتر آنزیم گاماکربوکسیلاز در سامانه دروزوفیلا (S2)، مطالعه حاضر با هدف بررسی قابلیت این سامانه در گاماکربوکسیلاسیون و لذا ترشح و فعالیت فاکتور IX انجام شد.
مواد و روشها
در این پژوهش تجربی، به دنبال تراآلایی سلولهای S2 با وکتور pMT-hFIX، برای ارزیابی کمی بیان و فعالیت فاکتور IX از روش الایزا و aPTT و برای بررسی گاماکربوکسیلاسیون فاکتور IX از روش رسوبدهی پروتئینهای محیط کشت به وسیله باریوم سیترات استفاده شد. نمونهها در سه روز متوالی و با سه تکرار و توسط آزمونهای واریانت آنوا و دانکن در سطح 5% بررسی شدند.
یافتهها
نتایج آزمون انعقاد، ترشح فاکتور IX فعال توسط سلولهای S2 پایدار را نشان داد. هم چنین ارزیابی کمی فاکتور IX در محیط کشت و لیز سلولی با الایزا، کارآیی 94 درصدی ترشح را نشان داد. نتایج الایزا نیز در ارزیابی کمی فاکتور IX رسوب داده شده با باریوم سیترات نشان داد که حدود 45% از فاکتور IX مترشحه از سلولهای S2، کاملاً کربوکسیلهاند.
نتیجه گیری
فعالیت فاکتور IX و رسوب آن توسط باریوم سیترات موید قابلیت سلولهای S2 برخلاف سایر سلولهای حشرات در گاماکربوکسیلاسیون فاکتور IX است. نتایج تحقیق، شواهد متقاعد کنندهای را فراهم میکند که گاماکربوکسیلاز دروزوفیلا، گاماکربوکسیلاسیون لازم که برای ترشح و فعالیت انعقادی فاکتور IX لازم است را انجام میدهد.
کلمات کلیدی: فاکتور IX انعقادی، هموفیلی B ، گاما گلوتامیل کربوکسیلار، پپتیدگلا
تاریخ دریافت : 4 /9/94
تاریخ پذیرش : 17/1/95
1- دانشجوی کارشناسی ارشد زیستشناسی سلولی و مولکولی ـ گروه زیستشناسی ـ دانشگاه حکیم سبزواری ـ سبزوار ـ ایران
2- مؤلف مسؤول: PhD ژنتیک مولکولی ـ استادیار دانشکده علوم پایه دانشگاه حکیم سبزواری ـ سبزوار ـ ایران
در سلولهای پایدار دروزوفیلا
سمیرا خلیلزاده1، جعفر وطندوست2
چکیده
سابقه و هدف
فاکتور IX طی بلوغ خود در کبد، نیازمند کربوکسیلاسیون اسیدآمینههای گلوتامیک در ناحیه گلا میباشد که در ترشح و فعالیت آن نقش دارد. با توجه به ناکارآمدی سیستم بیانی پستانداران در ترشح و گاماکربوکسیلاسیون کامل فاکتورهای انعقادی نوترکیب و فعالیت بالاتر آنزیم گاماکربوکسیلاز در سامانه دروزوفیلا (S2)، مطالعه حاضر با هدف بررسی قابلیت این سامانه در گاماکربوکسیلاسیون و لذا ترشح و فعالیت فاکتور IX انجام شد.
مواد و روشها
در این پژوهش تجربی، به دنبال تراآلایی سلولهای S2 با وکتور pMT-hFIX، برای ارزیابی کمی بیان و فعالیت فاکتور IX از روش الایزا و aPTT و برای بررسی گاماکربوکسیلاسیون فاکتور IX از روش رسوبدهی پروتئینهای محیط کشت به وسیله باریوم سیترات استفاده شد. نمونهها در سه روز متوالی و با سه تکرار و توسط آزمونهای واریانت آنوا و دانکن در سطح 5% بررسی شدند.
یافتهها
نتایج آزمون انعقاد، ترشح فاکتور IX فعال توسط سلولهای S2 پایدار را نشان داد. هم چنین ارزیابی کمی فاکتور IX در محیط کشت و لیز سلولی با الایزا، کارآیی 94 درصدی ترشح را نشان داد. نتایج الایزا نیز در ارزیابی کمی فاکتور IX رسوب داده شده با باریوم سیترات نشان داد که حدود 45% از فاکتور IX مترشحه از سلولهای S2، کاملاً کربوکسیلهاند.
نتیجه گیری
فعالیت فاکتور IX و رسوب آن توسط باریوم سیترات موید قابلیت سلولهای S2 برخلاف سایر سلولهای حشرات در گاماکربوکسیلاسیون فاکتور IX است. نتایج تحقیق، شواهد متقاعد کنندهای را فراهم میکند که گاماکربوکسیلاز دروزوفیلا، گاماکربوکسیلاسیون لازم که برای ترشح و فعالیت انعقادی فاکتور IX لازم است را انجام میدهد.
کلمات کلیدی: فاکتور IX انعقادی، هموفیلی B ، گاما گلوتامیل کربوکسیلار، پپتیدگلا
تاریخ دریافت : 4 /9/94
تاریخ پذیرش : 17/1/95
1- دانشجوی کارشناسی ارشد زیستشناسی سلولی و مولکولی ـ گروه زیستشناسی ـ دانشگاه حکیم سبزواری ـ سبزوار ـ ایران
2- مؤلف مسؤول: PhD ژنتیک مولکولی ـ استادیار دانشکده علوم پایه دانشگاه حکیم سبزواری ـ سبزوار ـ ایران
مقدمه
یکی از مشخصترین تغییرات پس از ترجمه در پروتئینهای وابسته به ویتامین K ( Vitamin K-dependent, VKD)، گاماکربوکسیلاسیون ناحیه غنی از اسیدآمینههای گلوتامات (Glu) و تبدیل آنها به گاما کربوکسی گلوتامات یا گلا (Gla) میباشد(1). ایجاد این رزیدوهای گاماکربوکسی گلوتامیک اسید، برعهده آنزیم گاما کربوکسیلاز است. تا پیش از این اعتقاد بر این بود که این آنزیم تنها در سیستمهای بیانی پستاندارن وجود دارد و سلولهای حشرات از جمله سلولهای S2 دروزوفیلایی، فاقد فعالیت گاما کربوکسیلازی هستند و یا آنزیم گاما کربوکسیلاز قابلیت شناسایی پروپپتید پروتئینهای VKD را ندارد. بررسیهای بعدی نشان داد که آنزیم گاما کربوکسیلاز علاوه بر مهره داران، در دو بیمهره دروزوفیلا ملانوگاستر و نوعی حلزون Molluscs متعلق به جنس Conus نیز وجود دارد(4-2).
یک تفاوت اصلی بین آنزیم دروزوفیلایی و انسانی این است که از انتهای کربوکسی، 86 اسید آمینه کمتر از آنزیم انسانی دارد اما حذف آن اثری بر فعالیت آنزیم انسانی ندارد. هر چند سوبستراهای طبیعی آنزیم گاما کربوکسیلاز دروزوفیلایی تاکنون مشخص نشده است اما این آنزیم میتواند پروپپتید فاکتور IX و پروترومبین انسانی را به عنوان سوبسترا شناسایی و ناحیه گلای آنها را کربوکسیله کند. حتی آنزیم گاماکربوکسیلاز دروزوفیلایی در شرایط in vitro دارای تمایل بالاتری برای شناسایی سوبستراهای واجد پروپپتید فاکتور IX و پروترومبین نسبت به حالت بدون پروپپتید است(5). از طرفی نشان داده شده است که در شرایط و مقادیر یکسان، محصول کربوکسیله به دست آمده از آنزیم گاما کربوکسیلاز دروزوفیلا (dγC) حدود 5 برابر آنزیم گاما کربوکسیلاز انسانی(hγC) است(5). لذا به نظر میرسد گاما کربوکسیلاز از نظر خواص و مکانیسم کربوکسیلازی در مهرهداران و بیمهرهها مشابه است و هر دو قادرند که سوبستراهای همدیگر را کربوکسیله کنند. هم چنین موتاسیون F16A باعث حذف کربوکسیلاسیون (کاهش 90٪) به وسیله هر دو آنزیم کربوکسیلاز دروزوفیلا و انسانی میشود(5). انتظار میرود سامانه بیانی S2 از کارآیی بالایی برای کربوکسیلاسیون، ترشح و بازیافت فاکتورهای خونی وابسته به ویتامین K برخوردار باشد. هدف از انجام این مطالعه، بررسی توانایی و کارآیی گاما کربوکسیلاسیون فاکتور IX انعقادی در سلولهای 2S نسبت به سیستمهای بیانی پستانداران بود.
مواد و روشها
سوش باکتری، پلاسمیدها، سلولهای S2 :
در یک مطالعه تجربی، سوش DH5α باکتری E.coli (استراتژن - آمریکا) برای مراحل کلونینگ استفاده شد. کتابخانه cDNA کبدی برای جداسازی cDNAانسانی از شرکت MRC (انگلستان) خریداری گردید. پلاسمیدهای pMT-V5-HisA ، pCoHygro و سلولهای دروزوفیلایی اشنایدر 2 (S2) از شرکت اینویتروژن(آمریکا) تهیه گردید.
محیط کشت، آنزیمها، مواد شیمیایی و کیتها:
محیط کشت LB (Luria-Bertani) به عنوان محیط کشت باکتری استفاده شد و آمپیسیلین(µg/mL 100 محیط کشت) در صورت نیاز به وجود محیط کشت انتخابی استفاده شد. محیط کشت دروزوفیلایی (Schneider's Drosophila Medium)، پنیسیلین G ، استرپتومایسین، هایگرومایسین و میتومایسین از شرکت سیگما (آلمان) خریداری گردید. اولیگونوکلئوتیدها به وسیله شرکت بیونر (کره) ساخته شدند. همه آنزیمهای مورد استفاده در هضم برشی و PCR و هم چنین کیتهای تخلیص PCR ، تخلیص پلاسمید و تهیه RNA از شرکت رُوش(آلمان) خریداری شد. کیت InsT/Aclone از شرکت فرمنتاز، کیت الایزای مخصوص فاکتور IX و مواد مربوط به آزمون انعقاد یک مرحلهای از شرکت دیاگنوستیک(فرانسه) فراهم گردید. ویتامین K برای القا نیز از شرکت رُوش(آلمان) تهیه شد. هم چنین مارکر DNA و مارکر پروتئین از فرمنتاز خریداری گردید.
ساخت سازههای بیانی:
به منظور ساخت پلاسمید بیانکننده فاکتور IX انسانی که به صورت اختصاصی در سلولهای دروزوفیلا بیان گردد، از پلاسمید pMT-V5-His A با طول 3538 جفت باز استفاده شد. برای انتقال cDNA فاکتور IX به داخل این وکتور بیانی لازم بود که جایگاههای برشی مناسب در دو انتهایcDNA قرار داده شود. لذا با استفاده از دو آغازگر hFIX-KpnI (5'GGG GTAC/ CGC CAC CAT GCA GCG CGT GAAC 3') و hFIX-XhoI (5'CCGC/ TCG AGA TCC ATC TTT CAT TAA GTG AGC3')، cDNA فاکتور IX با انتهاهای دلخواه از کتابخانه cDNA کبد، pfu-PCR گردید. محصول cDNA به دست آمده بعد از استخراج از ژل و آدنیله کردن، در T- وکتور کلون شد. به دنبال واکنش الحاق محصول PCR به T- وکتور، سلولهای پذیرای DH5α با پلاسمید نوترکیب ترانسفورم شدند. بعد از استخراج و برش پلاسمید حاصله(T.V-hFIX) با آنزیمهای XhoI و KpnI، خروج cDNAفاکتور IX ، تخلیص از ژل و هم چنین برش پلاسمیدpMT-V5-His A با آنزیمهای XhoI و KpnI ، عمل اتصال بینcDNA و پلاسمید pMT-V5-His A صورت گرفت که منجر به ساخت پلاسمید pMT-hFIX گردید.
کشت سلول و تراآلایی:
کشت سلولهای S2 در محیط کشت اختصاصی آن با تراکم 1 تا 2 میلیون سلول به ازای هر میلیلیتر از محیط کشت انجام شد. سلولها در دمای 28 درجه سانتیگراد و بدون CO2 قرار داده شدند و هر چهار الی پنج روز، پاساژ داده میشد. تراآلایی سلولهای S2 با روش کلسیم فسفات انجام شد. 24 ساعت قبل از تراآلایی، 3 میلیلیتر از سلولها با تراکم سلولی 106 سلول برای هر میلیلیتر به ظرف کشت 6 خانهای منتقل و به مدت 24 ساعت در دمای 8 درجه سانتیگراد در انکوباتور قرار داده شد. قبل از تراآلایی، 300 میکرولیتر از مخلوط تراآلایی شامل 36 میکرولیتر از CaCl2 دو مولار، 10-5 میکروگرم از DNA و آب تزریقی در یک لوله استریل فراهم شد. سپس یک حجم از این مخلوط با یک حجم از HEPES 2x قطره قطره خوب مخلوط و تا 20 دقیقه در دمای آزمایشگاه قرار داده شد. به ازای هر 1 میلیلیتر از محیط کشت، 2/0 میلیلیتر از مخلوط تراآلایی به محیط کشت سلولی اضافه شد و به آرامی حرکت داده تا خوب مخلوط شود. پس از انجام تراآلایی سلول ها به مدت 16-6 ساعت در دمای 28 درجه سانتیگراد انکوبه و پس از آن محیط سلولها با محیط تازه و گرم تعویض شد.
تهیه کلونهای پایدار:
برای دستیابی به رده سلولی پایدار از سلولهای S2 ، پلاسمید مورد نظر همراه با پلاسمید انتخابی pCoHygro که ژن مقاومت به هایگرومایسین را دارد تراآلایی شد. به منظور انتخاب سلولهای نوترکیب، 48 ساعت پس از تراآلایی، هایگرومایسین با غلظت μg/mL 300 به محیط کشت سلولها افزوده شد. 10-7 روز پس از تیمار با هایگرومایسین در سلولهای تراآلوده شده، کلنیهای مقاوم از طریق استفاده از میتومایسین جدا شدند. در این روش حدود 150 میلیون سلول عادی تراآلوده نشده به مدت 4 ساعت در مجاورت با میتومایسین قرار داده شدند. میتومایسین به طور کوالانتی به DNA متصل شده و از تکثیر آن جلوگیری میکند هر چند که سلولها زنده میمانند(7، 6). پس از سانتریفوژ و شستشو باPBS (Phosphate buffered Saline)، این سلولها با تراکم cell/mL 106 * 3 در پلیتهای 24 خانه منتقل شدند. از طرفی سلولهای تراآلوده شده مخلوط سلولی پایدار به گونهای رقیقسازی شدند که در هر 100 میکرولیتر، به طور میانگین تنها یک سلول وجود داشته باشد. این مقدار به سلولهای عادی تراآلوده نشده و تیمار شده با میتومایسین در پلیت 24 خانه اضافه میشوند. بعد از 2 هفته از کشت سلولها در محیط واجد هایگرومایسین، سلولهای پایدار که از یک کلون رشد کردهاند از نظر بیان و فعالیت فاکتور IX بررسی و به پلیت 12 و 6 خانه منتقل شدند.
ارزیابی بیان و فعالیت فاکتور IX نوترکیب:
به منظور بررسی وجود فاکتور IX در محیط کشت سلولهای تراآلوده شده، محیط کشت سلولها در روزهای اول، دوم و سوم پس از افزودن ویتامین K1 (µg/mL 500) و القا با سولفات مس(µg/mL 500)، جمعآوری شد و پس از سانتریفوژ، محلول رویی در 20- درجه سانتیگراد فریز گردید. آنتیژن فاکتور IX نوترکیب انسانی بیان شده در محیط کشت سلولهای تراآلوده شده با روش ساندویچی الایزا بر روی میکروپلیتها که با آنتیبادیهای پلیکلونال ضد فاکتور IX که در کیت الایزا مهیا شده بود، آشکار شد. برای بررسی فعالیت بیولوژیکی فاکتور IX در محیط کشت، از آزمایش aPTTاستفاده گردید. برای تعیین فعالیت بیولوژیک فاکتور IX بیان شده توسط سلولهای تراآلوده شده، 100 میکرولیتر از محیط کشت جمعآوری شده از هر نمونه با 100 میکرولیتر از پلاسمای فاقد فاکتور IX و 100 میکرولیتر از PTT فعال شده مخلوط و دقیقاً 3 دقیقه در درجه حرارت 37 درجه سانتیگراد قرار داده شد. سپس 100 میکرولیتر کلسیم کلرید mM 25 از قبل گرم شده در 37 درجه سانتیگراد به آن اضافه و زمان انعقاد اندازهگیری گردید. فعالیت انعقادی هر نمونه بر اساس نمودار استاندارد تعیین شد. منحنی استاندارد انعقاد با استفاده از رسم زمان انعقاد علیه فعالیت انعقادی رقتهای مختلف از پلاسمای طبیعی سیتراته روی نمودار log-log ترسیم شد.
رسوبدهی پروتئینهای محیط کشت به وسیله باریوم سیترات:
برای بررسی کربوکسیلاسیون فاکتور IX در سلولهای S2 ، از روش جذب پروتئینهای وابسته به ویتامین K کربوکسیله به نمک باریوم سیترات استفاده شد. در این روش به محیط کشت سلولی 4/0% سدیم سیترات و 5% باریوم کلراید اضافه شد و به مدت یک ساعت در 4 درجه سانتیگراد بر روی شیکر قرار داده شد. بعد از سانتریفوژ، رسوب و محلول رویی به ترتیب برای بررسی فاکتور IX جذب شده و جذب نشده نگهداری شد. رسوب حاصل با mM 5 کلرید باریوم سرد شستشو داده شد و سانتریفوژ گردید. نهایتاً رسوب در M 1/0 سدیم سیترات و 10% آمونیوم سولفات حل گردید. بعد از سانتریفوژ، محلول نهایی برای بررسی فاکتور IX کربوکسیله در 20- درجه سانتیگراد نگهداری شد. برای بررسی درصد بازیافت فاکتور IX نسبت به مقدار اولیه، مقدار فاکتور IX قبل و بعد از رسوب به وسیله الایزا اندازهگیری شد.
آنالیز آماری:
همه آزمایشها در سه تکرار انجام شد و مقایسه میانگینها با استفاده از آنالیز واریانس(ANOVA) و آزمون دانکن در سطح 5% انجام شد.
یافتهها
ساخت سازههای بیانی:
بعد از کلونینگ cDNA فاکتور IX در T- وکتور و ساب کلونینگ آن در وکتور pMT-V5-His A ، پلاسمید نوترکیب pMT-hFIX ایجاد شد. پلاسمید نوترکیب حاصل به شکل سوپرکویل سنگینتر از pMT-V5-His A حرکت میکند که مؤید کلون شدن قطعه مذکور درpMT-V5-His A است.
صحت کلون شدن قطعه مذکور با استفاده از برش پلاسمید pMT-hFIX با آنزیمهای DraI وHind III نیز تایید شد(نمودار 1). برای بررسی عدم وجود جهش در فاکتور IX کلون شده در pMT-V5-His A ، این پلاسمید با استفاده از یک جفت آغازگر عمومی T7 promoter و BGH-r از داخل وکتور تعیین توالی گردید. بررسی توالی نشاندهنده صحت کلونینگ و عدم وجود جهش در فاکتور IX بود.

نمودار 1: تایید کلون شدن قطعه cDNA فاکتور IX با استفاده از برش پلاسمید pMT-hFIX با آنزیمهای DraI (ردیف 1) و Hind III (ردیف 2). الگوی حرکتی پلاسمید pMT-V5-His A (ردیف 3) و پلاسمید نوترکیب pMT-hFIX (ردیف 4). M : مارکر Kb1.
بررسی بیان فاکتور IX در سلولهای S2-hFIX :
برای ارزیابی بیان دایم فاکتور IX در سلولهای S2-hFIX ، محیط کشت و همچنین لیز سلولی سلولهای پایدار و القا شده و نمونههای کنترل برای آزمون الایزا مورد استفاده قرار گرفتند. مقدار فاکتور IX ترشح شده در محیط کشت در روز اول، دوم و سوم بعد از القا با سولفات مس و اضافه کردن ویتامین K1 به ترتیب ng/mL 290 ، ng/mL 720 و ng/mL 890 بود. این در حالی است که مقدار فاکتور IX درون سلولهای S2-hFIX در تمام دوره بعد از القا در سطح حداقل و حدود ng/mL 250 بود (نمودار 2).

نمودار 2: بررسی بیان فاکتور IX پایدار در سلولهای نوترکیب S2-hFIX ، در زمانهای مختلف بعد از القا، بر اساس آزمایش الایزا بر روی نمونههای گرفته شده از محیط کشت(Media) و لیز سلولی(lys Cell).
بررسی فعالیت فاکتور IX نوترکیب در سلولهای S2-hFIX:
فعالیت انعقادی فاکتور IX در محیط سلولهای پایدار S2-hFIX در مقایسه با کنترل در زمانهای 24، 48 و 72 ساعت پس از القا با سولفات مس و افزودن ویتامین K1 ، بررسی گردید.
میانگین فعالیت انعقادی فاکتور IX ترشح شده از سلولهای S2-hFIX در روز اول، دوم و سوم به ترتیب mU/mL 90 ، mU/mL 109 و mU/mL 153 بود (جدول 1). همان طور که در نمودار 3 مشاهده میشود، بیشترین فعالیت بیولوژیک در 72 ساعت بعد از القای سلولهای پایدار مشاهده گردید. فعالیت در هر دو حالت کنترل در سلولهای ترانسفکت نشده صفر و در سلولهای پایدار القا نشده حدود mU/mL 5 میباشد.
جدول 1: مقادیر میانگین فعالیت انعقادی فاکتور IX در دو گروه کنترل و مترشحه از سلولهای نوترکیب پایدار S2-hFIX
| زمان | تکرار 1 | تکرار 2 | تکرار 3 | میانگین فعالیت | انحراف معیار |
| 24 | 93 | 91 | 88 | 6/90 | 5/2 |
| 48 | 108 | 106 | 113 | 109 | 6/3 |
| 72 | 158 | 150 | 151 | 153 | 3/4 |
| کنترل | 6 | 8 | 9 | 6/7 | 5/1 |


نمودار 3: مقایسه فعالیت انعقادی فاکتور مترشحه از سلولهای نوترکیب پایدار S2-hFIX با سلولهای S2 پایدار القا نشده به عنوان نمونه کنترل(کنترل)، در زمانهای مختلف بعد از القا. ستارهها نشاندهنده معناداری نمونهها در مقایسه با کنترل با استفاده از آنالیز واریانس است(05/0 p<).
رسوب فاکتور IX :
قبل و بعد از تیمار محیط کشت سلولهای پایدار S2 تولیدکننده فاکتور IX با نمک باریوم سیترات، الگوی حرکتی فاکتور IX ترشح شده در مقایسه با فاکتور IX استاندارد تخلیص شده از پلاسمای نرمال(µg 1 در چاهک) در SDS-PAGE بررسی شد. همان طور که از نمودار 4 مشخص است، این روش برای جذب پروتئینهای کربوکسیله کارا بود. هم چنین نتایج نشان داد فاکتور IX مترشحه از سلولهای نوترکیب به عنوان یک پروتئین کربوکسیله توسط سیترات باریوم جذب و از سایر پروتئینهای محیط کشت جدا شد.
مقدار فاکتور IX بازیابی شده از رسوب سیترات باریوم که با الایزا تایید شد، نشان داد که در زمانهای 24، 48 و 72، درصد بازیافت فاکتور IX به ترتیب 29، 31 و 45 درصد است. بر اساس این نتایج حدود نیمی از فاکتور IX بیان شده به وسیله سلولهای S2-hFIX رسوب نگردید.

نمودار 4: الگوی حرکتی فاکتور IX ترشح شده از سلولهای نوترکیب S2-hFIX در SDS-PAGE قبل(3) و بعد از رسوب(2). ردیف 1 فاکتور IX استاندارد. M : مارکر.

نمودار 5 : کارآیی ترشح فاکتور IX در سلولهای S2
کارآیی ترشح:
کارآیی ترشح یک پروتئین با نسبت بخش ترشح شده و
مقدار کلی بیان شده آن پروتئین تعریف میشود(8). بر اساس این تعریف، کارآیی ترشح فاکتور IX در سلولهای S2 در روزهای اول، دوم و سوم بعد از القا به ترتیب 53 ، 74 و 78 درصد بود(نمودار 5). این بدان معناست که فاکتور IX به دام افتاده در داخل سلول در طول دوره کشت سلولی آزاد میشود.
بحث
با توجه به مشکلات سلولهای پستانداران از جمله آهستگی رشد، پایین بودن بقای سلولی و ناپایداری آنها، سامانههای بیانی حشرات و به ویژه سلولهای دروزوفیلایی S2 میتوانند جایگزین مناسبی برای تولید پروتئینهای نوترکیب در سطح بالا باشند. یکی از مزایای اصلی این سامانه در مقایسه با سیستمهای پروکاریوتی، توانایی آنها در تولید انبوه پروتئینهای یوکاریوتی است که نیاز به تغییرات پس از ترجمه دارند. مزیت دیگر این سامانه، توانایی آنها در تولید پروتئینها در مقیاس وسیع و در زمانی نسبتاً کوتاه(برخلاف سیستمهای پستانداران) است (9). هم چنین از آن جایی که تراکم ردههای سلولی حشرات نسبت به سلولهای پستانداران بیشتر است، به همین منظور حجم کوچکی از محیط کشت هم برای رشد آنها کافی به نظر میرسد(10).
از مزایای قابل توجه سامانه بیانی S2 میتوان به قدرت بیان بیشتر نسبت به سلولهای حشرات دیگر از قبیل Sf9 (10 تا 20 برابر)، تغییرات بعد از ترجمه یوکاریوتی از جمله گاما کربوکسیلاسیون، عدم لیز سلولها، عدم تداخل و میانکنش بین پروتئین بیانی با پروتئینهای رده سلولی، زمان کوتاه تهیه رده سلولی پایدار(حدود 2-3 هفته)، رشد با دانسیته بالا، رشد در دمای اتاق و عدم نیاز به CO2 اشاره کرد(14-11، 9، 5، 2).
سلولهای S2 نسبت به سایر ردههای سلولی حشرات و سلولهای پستانداران در برابر تغییرات pH ، دما، اکسیـژن و اسمولالیته مقـاوم میباشند لذا ممکن است سلول S2 برای بیش از یک ماه بدون تغییر محیط، کشت شوند(15). هم چنین این سامانه بیانی یک سامانه غیرلیتیک و برپایه وکتورهای پلاسمیدی است(13). بررسیها نشان دادهاند که وکتورهای بیانی این نوع سامانه به صورت چند نسخه به داخل کروموزوم سلولهای S2 دروزوفیلا وارد میشوند و این سلولها توانایی ورود بالغ بر 100 نسخه از یک کاست بیانی را به ژنوم خود در یک رخداد تراآلایی دارند(17، 16). به این ترتیب برای تثبیت رده سلولی پایدار با سطح بیان بالا، نیاز به دوره زمانی طولانی تکثیر پلاسمید نیست (9). با توجه به مزایای زیاد این سیستم، برخلاف محصولات موجود در پستانداران و سیستمهای بیانی آنها که به طور معمول در انتها دارای گالاکتوز و اسید سیالیک میباشند، محصولات گلیکوزیلاسیونی در حشرات و سیستمهای بیانی آنها به صورت انتهایی با واحد مانوزی کم یا انتهایی با واحد مانوزی زیاد و هیبرید با انتهای N- استیل گلوکز آمین دار میباشد(18، 8).
یکی از اولین گزارشها در به کارگیری این سامانه، بیان دوپامین بتا هیدروکسیلاز (DBH) به میزان mg/L 16 در مقیاس زیاد و اینترلوکین 5 انسانی به میزان mg/L 22 در سلولهای S2 در فلاسکهای 1 لیتری بوده است(20، 19). میزان بازدهی و تولید اریتروپویتین نوترکیب انسانی نیز در سیستم بیانی S2 پس از کشت در فلاسکهای mL 500 به مقدار mg/L 18 گزارش شده است(8). هم چنین پلاسمینوژن انسانی در سلولهای S2 در فلاسکهای 1 لیتری به میزان mg/L 10 تولید شد(21). تاکنون بیان پروتئینهای نوترکیب وابسته به ویتامین K که برای فعالیت خود نیازمند کربوکسیلاسیون اسید آمینههای گلوتامیک در انتهای آمینوی خود هستند، در این سامانه صورت نگرفته است. زیرا تصور میشد سلولهای حشرات از جمله سلولهای S2 دروزوفیلایی فاقد فعالیت گاما کربوکسیلازی هستند و یا آنزیم گاما کربوکسیلاز قابلیت شناسایی پروپپتید این نوع پروتئینها را ندارد(2). به دنبال آزمایشهای باندیوپادیای در شرایط in vitro و مطالعههای قبلی ما، مشخص گردید که نه تنها سلولهای S2 برخلاف سایر حشرات واجد فعالیت گاما کربوکسیلازیاند بلکه آنزیم گاماکربوکسیلاز دروزوفیلایی 5 برابر، محصول گاماکربوکسیله بیشتری تولید میکند(12، 5). نتایج این تحقیق نیز این مطلب را تایید میکند. بررسی غلظت فاکتور IX نوترکیب ترشح شده از سلولهای S2 ، حاکی از بیان حدود mg/L 9/0 است که در مقایسه با گزارشهای بیان در سلولهای CHO و سلولهای MSCs_hAM بسیار بیشتر است(23، 22). هم چنین فعالیت بالای فاکتور IX (mU/mL 153) نشاندهنده فعالیت بالای آنزیم گاما کربوکسیلاز در دروزوفیلا نسبت به این آنزیم در پستانداران است.
چندین روش مختلف برای بررسی و تشخیص فاکتور IX نوترکیب فعال از فاکتور IX غیرفعال استفاده میشود که همه آنها برپایه تغییرات کونفورماسیونی دومین گلا میباشد(24). رسوب باریوم سیترات یکی از اولین روشهای استفاده شده است که به عنوان روش تقریباً کارآمد در جداسازی پروتئینهای کربوکسیله و فعال از جمعیت غیرفعال مورد توجه است(24). در این روش، از خاصیت پروتیئنهای وابسته به ویتامین K در جذب نمک باریوم سیترات از طریق اسیدآمینه های گاما کربوکسی گلوتامیک استفاده میشود و مولکولهایی که به طور ضعیف یا اصلاً کربوکسیله نشدهاند، نمیتوانند به وسیله یونهای باریوم جذب و رسوب گردند، بنابراین به صورت محلول در سوپرناتانت باقی میمانند.
ارزیابی کمی فاکتور IX رسوب داده شده نشان داد که حدود 45-30 درصد از فاکتور IX مترشحه از سلولهای S2 جذب و رسوب شدهاند و بنابراین به احتمال زیاد به طور کامل کربوکسیله هستند. براین اساس حدود 70-55 درصد از فاکتور IX بیان شده جذب و رسوب نگردیده که ممکن است این قسمت از فاکتور IX ساخته شده به طور جزیی یا اصلاً کربوکسیله نشده باشد. هر چند که هم فعالیت انعقادی و هم رسوب با باریوم سیترات نشان میدهد که قسمتی از فاکتور IX انسانی مترشحه از سلولهای S2 به طور صحیح گاماکربوکسیله شدهاند اما تاکنون تعریف دقیقی از کربوکسیلاسیون صحیح پروتئینهای وابسته به ویتامین K ارایه نشده است. نتایج تحقیقات و پژوهشها نشان داده است که تمام واحدهای اسیدگلوتامیک در ناحیه گلا نقش کلیدی و اساسی ندارند. فاکتور 9 دارای 12 واحد اسیدآمینه گلوتامیک در دومین گلای خود است و اسیدهای آمینه شماره 7، 8، 15، 17، 20، 21، 26، 27، 30، 33، 36 و40 ، واحدهای اسیدآمینه گلوتامیک هستند. جهش در اسیدهای آمینه گلوتامیک در موقعیتهای 7، 15، 20، 27، 33 باعث کاهش شدید در فعالیت بیولوژیک فاکتور 9 میشود، اما جهش در سایر موقعیتها تاثیر چندانی روی فعالیت بیولوژیک این فاکتور ندارد(25).
بنابراین از آن جایی که تنها 5 اسیدآمینه گلوتامیک از 12 اسیدآمینه گلوتامیک موجود در دومین گلا برای فعالیت بیولوژیک فاکتور IX کافی است، لذا به نظر میرسد که فاکتور IX که به طور ناقص کربوکسیله شده ولی واجد فعالیتاند، در سوپرناتانت وجود داشته باشد. این فرض با نتایج کارآیی ترشح نیز تایید میشود. کارآیی حدود 80 درصدی ترشح فاکتور IX به وسیله سلولهای S2 نشان میدهد که حدود 20% فاکتور IX بیان شده در داخل سلول نگه داشته میشود. لذا بسیاری از پروتئینهای فاکتور IX در محیط کشت ممکن است به طور کامل کربوکسیله نشدهاند اما بدلیل کربوکسیلاسیون حداقل 5 اسید آمینه در ناحیه گلا، قادر به ترشح شدهاند.
نتیجهگیری
دادههای این مطالعه نشان میدهد که سلولهای S2 ، فـاکتـور IX فعـال بیولوژیکـی را بیان میکنند و لذا پیشنهاد میکند که سلولهای S2 قادر به کربوکسیلاسیون فاکتور IX انسانی میباشند. در واقع فعالیت انعقادی فاکتور IX مترشحه از سلولهای S2 ، شواهد متقاعد کنندهای را فراهم میکند که سلولهای S2 دروزوفیلایی، گاما کربوکسیلاسیون لازم را که برای فعالیت انعقادی لازم اسـت انجام میدهند.
تشکر و قدردانی
بدینوسیله از معاونت پژوهشی دانشگاه حکیم سبزواری به خاطر حمایت مالی پروژه، هم چنین آقای دکتر زمردیپور(پژوهشگاه ملی مهندسی ژنتیک و زیست فناوری) و خانم دکتر Mettine Bos (مرکز پزشکی دانشگاه لیدن هلند) به دلیل در اختیار قرار دادن برخی سلولها و مواد، کمال تشکر را داریم.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |





